I. Calor, movimiento y temperatura
CUANDO HABLAMOS de enfriamiento, lo primero que se nos viene a la mente son los deliciosos helados que tanto nos gusta saborear en verano. Recién servidos se ven deliciosos y bastante sólidos; pero muy pronto, por el calor del ambiente y de las manos que los sostienen, los helados empiezan a derretirse y parte de ellos se convierte en líquido. Hay que tomarlos con bastante prisa para evitar un desastre. Aquí hemos nombrado una palabra clave cuyo significado es claro para todos cuando se menciona, pero difícil de definir: el calor. El calor calienta los cuerpos, los derrite, los evapora y los quema; entonces, para enfriar un objeto hay que quitarle calor. Pero, ¿qué es el calor? ¿Dónde reside el calor que tienen las cosas y cómo se lo podemos “quitar”? Éstas son las preguntas que trataremos de responder en este capítulo.
EL CALOR
En la vida diaria, estamos acostumbrados a ver las cosas de la naturaleza en cuatro presentaciones: sólidas, líquidas, gaseosas y plasmas. Un trozo de metal, un poco de aceite, el aire y una descarga eléctrica son ejemplos comunes de cada una de ellas, respectivamente. A cada una de estas presentaciones acostumbramos llamarlas fases o estados de la materia. Pero su presentación no es permanente: el metal se puede derretir; el aceite se puede evaporar; el aire (a muy bajas temperaturas) puede pasar a estado líquido, y la descarga eléctrica que forma un plasma dura sólo un instante. ¿Cuál es la razón de estos cambios?
Para imaginar una respuesta haremos un experimento con una sustancia que nos es muy familiar: el agua. A menudo la vemos en tres de sus presentaciones: sólida, líquida y gaseosa. Empecemos por sacar unos cubos de hielo (agua sólida) del refrigerador; los colocamos en un recipiente, como se muestra en la figura I.1. No transcurrirá mucho tiempo para que aparezca sobre el hielo una fina capa de agua líquida que empezará a acumularse en el fondo del recipiente. El agua está pasando del estado sólido al líquido. Si introducimos ahora un termómetro en contacto con la mezcla de agua y hielo, veremos que señalará una temperatura de 0°C. Si seguimos observando, notaremos que mientras coexisten el hielo y el agua en el recipiente, la lectura del termómetro no cambia. La causa de este fenómeno la entenderemos más adelante, cuando podamos distinguir entre el calor y la temperatura. Por el momento, notaremos que, al cabo de cierto tiempo, todo el hielo se derrite. Una vez que tengamos toda el agua en estado líquido, observaremos que la lectura del termómetro empezará a subir. Para hacer más notable este hecho, pongamos el recipiente con agua en la flama de la estufa. Aquí sí sabemos qué está pasando: la flama de la estufa está calentando el agua; hasta nosotros sentimos el calor de la flama. Veamos qué pasa enseguida. Al cabo de algunos minutos, el agua empieza a burbujear (comienza la ebullición) y una parte se evapora. Estamos obteniendo agua en estado gaseoso. Si vemos el termómetro ahora que el agua se está evaporando, notaremos que marca 100°C (si estamos al nivel del mar, ya que la lectura exacta depende de la altura con respecto a este nivel) y se mantiene en esa posición durante el proceso de evaporación.
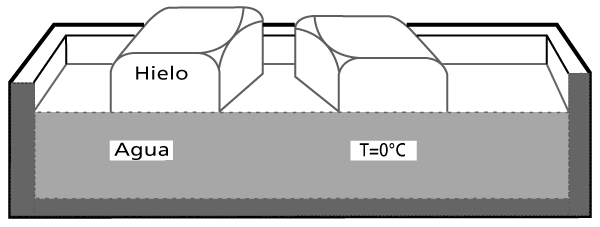
FIGURA I.1. Cambio de fase a la temperatura constante. El agua y el hielo coexisten a 0°C. La temperatura no aumenta mientras el hielo se derrite
Podemos imaginar el final de este experimento: toda el agua se evaporará, se dispersará por el ambiente y nos quedaremos con el recipiente seco. Si queremos que esto no suceda, podemos cerrar el recipiente perfectamente. Una buena idea es empezar el experimento tomando una olla de presión como recipiente. De esta manera, podemos seguir calentando el agua sin que se escape en forma gaseosa, como se muestra en la olla de presión del inciso a) de la figura I.2. Pero, ¿qué es lo que pasa con el agua gaseosa dentro de la olla de presión? Para saberlo, dejamos escapar un poco del vapor de agua por el pequeño orificio que, por seguridad, todas las ollas de presión tienen; de esta manera, sabremos qué está pasando adentro. Ésta es la parte crucial de nuestro experimento. Primero notaremos que sale un chorro de vapor de agua a cierta velocidad moderada. Al seguir calentando el agua, la velocidad del chorro aumenta y la olla de presión empieza a emitir un silbido característico. Pensemos un poco sobre lo que está pasando. Estamos calentando el vapor de agua y debido a esto su velocidad aumenta, como se observa en la olla del inciso b) de la figura I.2. ¡Estamos acelerando las moléculas del vapor de agua! Éste es el resultado que deseábamos encontrar; es muy importante y lo vamos a repetir: el calor acelera las moléculas del vapor de agua.
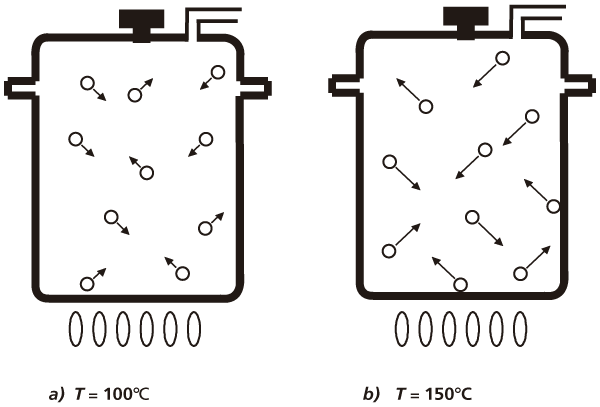
FIGURA I.2. Moléculas de vapor de agua dentro de una olla de presión a diferentes temperaturas. El tamaño de las flechas indica de manera figurada el valor promedio de la velocidad de las moléculas dentro del recipiente
Podríamos seguir nuestro experimento calentando el vapor aún más, pero encontraríamos resultados de otra índole, ya que las moléculas de agua están compuestas por dos átomos de hidrógeno y uno de oxígeno. Al llegar a temperaturas muy altas, estos átomos se separan (decimos que las moléculas se “disocian”); el agua deja de ser tal y se convierte en los dos gases mencionados, hidrógeno y oxígeno. Si hacemos el experimento con un elemento puro, plomo, por ejemplo, nos evitamos este problema, pero tenemos que calentar a temperaturas mucho mayores para obtener vapor de plomo.
Para analizar desde otro punto de vista el resultado obtenido, recordaremos que los objetos de la naturaleza están compuestos por átomos. Los átomos se clasifican en un poco más de cien especies, que se resumen en la tabla periódica de los elementos. Estos elementos forman compuestos según sus características físicas y químicas. Los compuestos pueden ser de átomos de una misma especie (como en el caso del plomo) o de varias especies (como es el caso del agua). Las moléculas de agua están formadas, como lo dijimos antes, por dos átomos de hidrógeno y uno de oxígeno, fuertemente unidos, que se comportan como un solo ente.
Ahora veamos el proceso de aceleración de una partícula. Las moléculas de vapor de agua tienen masa, y para acelerarlas tenemos que aplicar una fuerza, la cual, según las leyes de la mecánica enunciadas por Isaac Newton desde 1686, debe tener un valor igual al producto de la masa por la aceleración. En la figura I.3 se esquematiza la aceleración de una molécula. Durante el tiempo que aplicamos una fuerza sobre la partícula, su velocidad cambia de un valor inicial Vi a una velocidad final Vf y, además, la partícula se desplaza cierta distancia. Esto es muy importante, porque en la física, el trabajo realizado por una fuerza sobre un objeto se define como el producto del valor de esta fuerza por la distancia que recorre el objeto mientras la fuerza actúa sobre él. El trabajo, definido de esta manera, es una forma de transferir energía; por lo tanto, al calentar el vapor de agua estamos realizando un trabajo para acelerar sus moléculas y le estamos proporcionando energía. ¡El calor es una forma de energía! Éste es un resultado muy importante, aunque aún quedan varios puntos por aclarar de las observaciones hechas durante el experimento; ésos los vamos a entender más adelante.
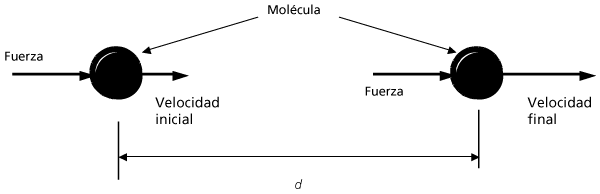
FIGURA I.3. Aceleración de una molécula al aplicarle una fuerza (F). La molécula pasa de una velocidad inicial a una velocidad final en una distancia (d). El trabajo realizado sobre la molécula es el producto de la fuerza la distancia recorrida
ENERGÍA Y MOVIMIENTO
Los procesos observados en el experimento anterior se explican por medio de la teoría cinético-molecular de la materia, la cual nos dice que las sustancias están compuestas por moléculas o átomos que se encuentran en constante movimiento. Éste depende del carácter de las interacciones entre las moléculas, y cambia cuando la sustancia pasa de un estado a otro. La intensidad del movimiento molecular depende del grado de calentamiento del cuerpo, que, correctamente hablando, se caracteriza por su temperatura (T). Debido a esto, el movimiento molecular se conoce también como movimiento térmico. De esta teoría se desprende que la energía promedio de las moléculas es proporcional a la temperatura (T). Por ejemplo, para moléculas compuestas por un solo átomo, la energía térmica promedio es 3kT/2, donde k es una constante que tiene el valor de 1.38x10−23 joules/Kelvin, y se conoce como la constante de Boltzmann. Veamos ahora qué formas tiene la energía (E) de un cuerpo.
Por energía se entiende la capacidad de hacer trabajo, y por cuerpo entendemos cualquier objeto de la naturaleza, desde una molécula hasta una estrella. Si recordamos lo mencionado anteriormente, el trabajo es el producto del desplazamiento por la fuerza que actúa sobre un cuerpo. Ahora, ¿cómo puede un cuerpo realizar trabajo sobre otro? Un ejemplo, que lamentablemente vemos con frecuencia en los cruceros viales, es el choque de dos autos; en un evento de esta naturaleza vemos cómo un objeto en movimiento puede desplazar a otro. Por lo tanto, ese cuerpo posee energía debido a su movimiento (si su velocidad es nula, no hay desplazamiento). Esta energía se conoce como energía cinética y es igual a la mitad del producto de la masa del cuerpo por el valor de su velocidad elevado al cuadrado.
Sin embargo, un cuerpo también puede poseer energía potencial. La energía potencial se concibe como aquella que el cuerpo tiene debido a su posición, como la que se tiene al iniciar el descenso en la montaña rusa. Como se muestra en el diagrama de la figura I.4, al descender de la montaña rusa uno adquiere mayor velocidad; es decir, la energía potencial se transforma en energía cinética. Por último, un cuerpo tiene también energía interna; esta energía se concibe como la energía que une a los átomos o moléculas que constituyen el cuerpo. Es la energía liberada en una reacción química, como en la explosión que se muestra en la figura I.5 o en un cambio de estado.

FIGURA I.4. Energía potencial y energía cinética. La energía potencial que tiene el carro debido a su altura en la cima de la montaña rusa se convierte en energía cinética al descender

FIGURA I.5. Liberación de la energía interna en la explosión de una bomba
En resumen, podemos decir que la energía total de un cuerpo será la suma de estas tres energías mencionadas: la cinética (Ec), la potencial (Ep) y la interna (U):
E= Ec+Ep+U.
¿Qué pasa entonces con el vapor de agua en la olla de presión? Las moléculas de agua estaban recibiendo energía en forma de calor. Pero, ¿a cuál de las tres energías antes mencionadas corresponde el calor absorbido por el vapor de agua? En principio podemos asegurar que parte del calor se convierte en energía cinética, ya que notamos el aumento de la velocidad del chorro de vapor de agua. La energía potencial depende de la posición del cuerpo; si consideramos la posición promedio del total de moléculas del vapor en la olla, veremos que no ha cambiado; por lo tanto, no hay transformación de calor en energía potencial. La parte de calor que se transforma en energía interna la podemos imaginar como un cambio en la vibración de los átomos dentro de la molécula. Notemos que para los átomos solitarios, la única energía térmica que tenemos es la energía cinética. No obstante, podemos tener energía interna debido a la configuración electrónica y nuclear de los átomos; pero este tipo de energía no es térmica; eso lo trataremos más adelante, al estudiar la estructura interna de los átomos. Volviendo al vapor de agua, consideremos que no cambió la energía interna de las moléculas; por lo tanto, el calor absorbido por el vapor se convirtió casi totalmente en energía cinética de sus moléculas.
LA TEMPERATURA
Aún queda otra duda por resolver: ¿por qué hubo momentos en nuestro experimento en los que la temperatura aumentó y otros en que no lo hizo? Hay que recordar que la teoría cinético-molecular de la materia nos dice claramente que el movimiento de las moléculas depende del tipo de interacción que tenemos entre ellas. En el vapor de agua, las moléculas se mueven independientemente unas de otras y su interacción es mínima, salvo en el caso de choques entre ellas. En el estado líquido, por el contrario, las moléculas están muy juntas unas con otras y su interacción es mucho mayor. Entonces, el movimiento de las moléculas se ve afectado al pasar de un estado a otro, sea de gaseoso a líquido, de líquido a sólido, de sólido a gaseoso o viceversa.
Aunque más adelante sólo vamos a trabajar con átomos en estado gaseoso, es bueno aclarar lo que pasa con la temperatura durante los cambios de estado. Consideremos la situación de nuestro experimento, en el cual el agua se convertía en vapor. ¿Cómo podemos imaginar esto? En estado líquido, las moléculas se mantienen unidas, como vemos en la figura I.6, mientras que en estado gaseoso se mueven de manera independiente, como se observa en la figura I.7. Una idea inmediata es que existe una fuerza que mantiene unidas a las moléculas en estado líquido. Por lo tanto, para pasarlas al estado gaseoso, debemos alejarlas unas de otras en presencia de esta fuerza; esto implica la realización de un trabajo. Obtenemos la energía necesaria para realizar ese trabajo del calor que el líquido está absorbiendo. Durante el tiempo en que se realiza el cambio de estado, las moléculas utilizan la energía extra para separarse de sus compañeras, y no para aumentar su energía cinética. Esto se relaciona con el estancamiento térmico mencionado, con el no incremento de la temperatura. Si la energía cinética de las moléculas no aumenta, tampoco aumenta la temperatura. Así resulta que la temperatura es la medida de la energía cinética de las moléculas que conforman un cuerpo.

FIGURA I.6. Movimiento de las moléculas en un líquido. La distancia entre las moléculas es pequeña y éstas chocan constantemente
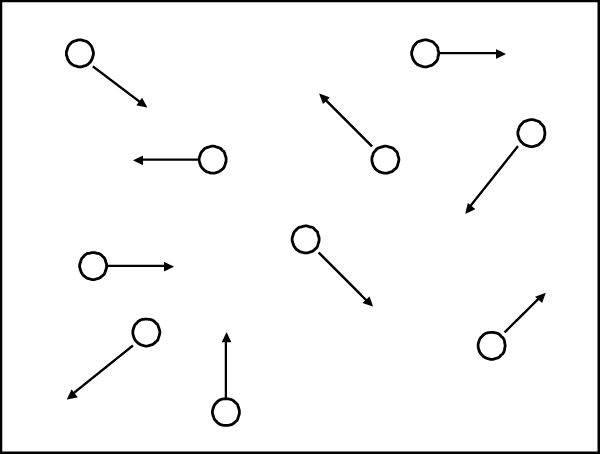
FIGURA I.7. Movimiento independiente de las moléculas en un gas. La distancia entre moléculas es muy grande y hay poca interacción entre ellas
De manera similar se puede pensar en la transición de sólido a líquido. En un sólido, el movimiento de las moléculas se realiza mediante vibraciones alrededor de una posición determinada, como se muestra en la figura I.8. Sin embargo, en un líquido, los movimientos de las moléculas son de mayor alcance. El calor que se absorbe durante la transición sólido-líquido proporciona la energía necesaria para sacar a las moléculas de sus posiciones fijas. De esta manera, tampoco aumenta la energía cinética de las moléculas y su temperatura permanece constante. En un cuerpo extenso sería demasiada coincidencia que todas las moléculas se comportaran igual en un mismo tiempo. Seguramente habrá algunas con mayor energía cinética que otras; habrá algunas que se movieron de sus posiciones fijas y otras que no.

FIGURA I.8. Movimiento de las moléculas en un sólido. En un estado sólido, las moléculas vibran alrededor de posiciones fijas. La distancia entre ellas es pequeña y no cambia
Entonces, ¿qué mide el termómetro? El termómetro (pensemos en uno de bulbo de mercurio y capilar) es un objeto muy grande comparado con las dimensiones de las moléculas. La manera en que el termómetro registra el movimiento de las mismas es mediante los choques que éstas tienen con el termómetro; pero en un instante dado, son una gran cantidad de moléculas las que chocan contra el termómetro; de modo que la temperatura indicada por éste resulta ser un promedio del estado de movimiento térmico de las moléculas.
ESCALAS DE TEMPERATURA
Hasta este punto queda claro que la temperatura es la medida de la energía cinética promedio de las moléculas. Pero, ¿en qué unidades se mide?, ¿qué temperatura corresponde a un valor determinado de la velocidad promedio de las moléculas? y viceversa, ¿qué velocidad promedio de las moléculas corresponde a un valor dado de la temperatura?
Durante el desarrollo histórico de los conceptos de calor y temperatura, sus significados no eran claros, y hubo muchas propuestas de diseño y construcción de termómetros y de escalas de temperatura de las cuales sólo unas cuantas sobreviven a la fecha. Una manera de construir una escala de temperatura es simplemente tomar dos puntos fijos de temperatura, a los cuales se les asigna un valor numérico arbitrario, y después se colocan cuantas divisiones sean necesarias en la escala para definir la temperatura en puntos intermedios. Fahrenheit construyó de esta manera la escala que lleva su nombre: tomó como puntos fijos la temperatura de fusión del hielo y la temperatura del cuerpo humano, a los cuales asignó los valores de 32 y 96, respectivamente.
Así como ésta, hubo otras escalas de temperatura, y su permanencia se debió a cuán práctico resultaba usarlas. La escala Celsius o centígrada fue construida por Anders Celsius, quien tomó como punto fijo inferior, el punto de congelación del agua, con un valor de 0 grados y el punto fijo superior, el punto de ebullición del agua, con un valor de 100 grados, y dividió la escala en cien partes iguales. Esta escala resultó muy práctica y es ampliamente usada en el mundo de nuestros días. Sin embargo, como seguramente lo habrá notado el lector, la elección del punto correspondiente al cero de la escala de temperatura resulta totalmente arbitraria.
Con la idea de encontrar un punto adecuado para el cero de la escala de temperatura, lord William Kelvin realizó cálculos sobre la teoría cinética de los gases, y determinó que no podía existir una temperatura más baja que −273.15 grados Celsius. Con base en esto, construyó una escala colocando el cero absoluto de temperatura en este punto, y a partir de ahí midió la temperatura absoluta con divisiones en su escala del mismo tamaño que los grados Celsius, de manera que la temperatura de congelación del agua resulta ser 273.15 Kelvin, y la de ebullición 373.15 Kelvin en lugar de los 0 y 100 grados de la escala Celsius. Como se mencionó anteriormente, la teoría cinético-molecular de la materia considera que en un gas monoatómico (cuyas moléculas tienen un solo átomo) a temperatura T, las moléculas tienen una energía promedio igual a: E = 3kT/2. En este caso, no tiene energía potencial ni interna que considerar, así que esta energía debe ser igual a la energía cinética promedio de las moléculas.
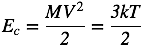
De aquí obtenemos que el valor de la velocidad V para una temperatura dada T es:
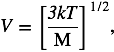
donde T corresponde a la temperatura medida en la escala absoluta o escala Kelvin y M es la masa de las moléculas. En esta escala, como se puede comprobar con la relación anterior, el cero absoluto corresponde a una velocidad promedio cero, ¡el cero absoluto corresponde a la ausencia total de movimiento!
La relación anterior entre la velocidad y la temperatura no es válida para moléculas de dos o más átomos, ya que éstas pueden tener energía interna en diversos modos de vibración y rotación de sus átomos. Aunque la temperatura es una propiedad del total de moléculas que constituyen un cuerpo, con la relación anterior, podemos asignar un valor de temperatura a una molécula o átomo aislado según el valor de su energía cinética. Así, podemos hablar de un haz de átomos de cesio con temperatura de 300K cuando queremos expresar que la velocidad promedio de los átomos en el haz es de 237m/s. Por último, para enfriar un conjunto de átomos lo único que debemos hacer es reducir su energía cinética, disminuir su velocidad promedio. En los siguientes capítulos veremos los mecanismos para desacelerar los átomos con el uso del rayo láser.