CAPÍTULO 1
El átomo de carbono, el principal responsable: del grafito al grafeno
El grafeno se define como una lámina de carbono de un solo átomo de espesor. Comenzaremos, pues, el recorrido por el mundo del grafeno desde el átomo de carbono, tratando de comprender cómo contribuye al carácter único de este material. Haremos un especial énfasis en el grafito, puesto que fue el material de partida para que Geim y Novoselov aislaran la lámina de grafeno y porque se ha erigido en un producto estratégico para la consolidación del mercado del grafeno.
Configuración electrónica del carbono y tipos de enlace
El carbono es un elemento químico que pertenece al grupo de los no metales, de número atómico 6 y símbolo C. Tiene tres isótopos, dos de ellos estables (12C y 13C) y uno radioactivo (14C), siendo el 12C (figura 1) el más abundante en la naturaleza. El carbono se presenta en cuatro formas alotrópicas (misma composición, diferente estructura cristalina): grafito, diamante, carbino, fullereno; o como carbono amorfo (sin estructura cristalina) y es el pilar básico de la química orgánica. Se conocen cerca de 16 millones de compuestos de carbono y forma parte de todos los seres vivos conocidos. Además, la síntesis de carbono en las estrellas constituye una etapa básica del ciclo por el cual se forman muchos otros elementos.
Figura 1
Átomo de carbono 12.
Por su configuración electrónica (figura 1), 1s22s22p2, el átomo de carbono es muy versátil. Tiene la capacidad de unirse con otros elementos o consigo mismo a través de distintos tipos de enlace y formar una gran variedad de compuestos y estructuras que generan materiales de muy diferentes propiedades.
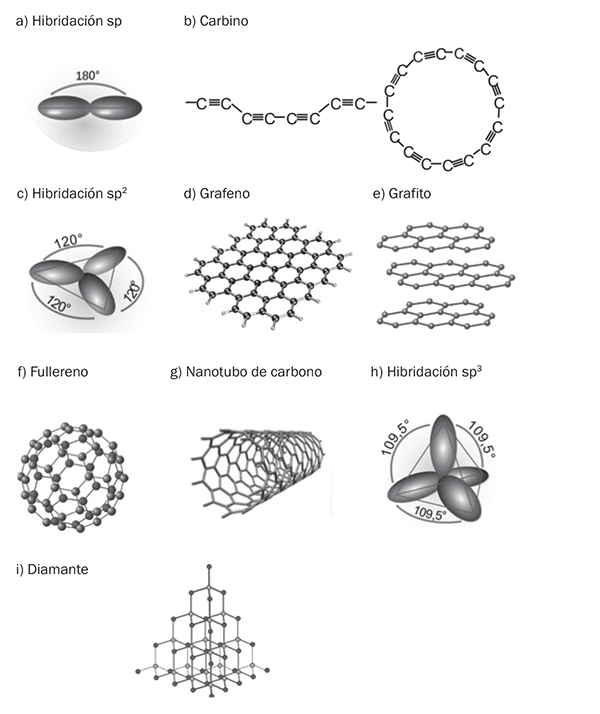
Cuando está unido a otro átomo de carbono por un enlace triple y a un segundo átomo de carbono por un enlace sencillo (a través de orbitales híbridos sp; figura 2a) da lugar a estructuras lineales que pueden ser tan largas como se desee. Este tipo de estructuras constituyen una forma de carbono poco común que se denomina carbino, el cual puede presentarse en forma lineal o cíclica (figura 2b). Existe un escaso conocimiento sobre los carbinos y ciertas dudas sobre su existencia real en forma pura. No obstante, se han descrito una serie de variedades impuras denominadas α- y β-carbinos, chaoíta, carbono VI, carbonos VIII-XIII, etc. Algunos de estos sólidos son de origen natural (la chaoíta fue descubierta en el cráter del meteorito Ries, Alemania) y otros fueron sintetizados a partir del acetileno. En la actualidad está despertando un gran interés, ya que estudios teóricos muestran al carbino como un material más fuerte que el grafeno y los nanotubos de carbono, solo falta que sea confirmado experimentalmente.
Si cada átomo de carbono se une covalentemente a otros 3 átomos de carbono a través de una red plana de tipo hexagonal (orbitales híbridos sp2; figura 2c) se llega al grafito. Los átomos de carbono forman un sistema de anillos condensados que dan lugar a láminas paralelas entre sí. Los enlaces químicos en el plano presentan uniones muy fuertes, mientras que las interacciones entre las láminas se deben a fuerzas de Van der Waals (interacciones a través de la nube electrónica, mucho más débiles). Cuando el átomo de carbono está unido a otros 4 átomos de carbono formando una estructura tridimensional (vía hibridación sp3; figura 2h) da lugar al diamante (figura 2i).
En el fullereno los átomos de carbono presentan una hibridación intermedia entre la sp2 y la sp3 (figura 2f). Esto hace posible que los átomos de carbono puedan combinarse formando hexágonos y pentágonos con estructuras tridimensionales cerradas. La presencia de anillos de 5 átomos de carbono es la que permite la formación de curvaturas. El fullereno más común es el C60 (de 60 átomos de carbono) y es similar a un balón de fútbol, aunque también se han descrito otros fullerenos como C70, C80, etc. Los nanotubos de carbono presentan también este tipo de hibridación intermedia (figura 2g).
Figura 2
Distintos tipos de hibridación y formas de carbono.
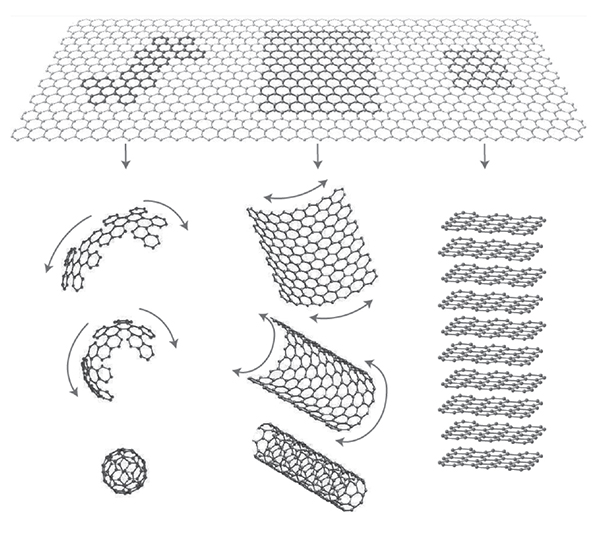
La mayoría de los materiales de carbono con hibridación sp2 se pueden considerar formados por unidades grafénicas, con mayor o menor orden estructural, conectadas por regiones menos ordenadas (figura 3). El grafeno puede hacerse una pelota para formar fullerenos, enrollarse formando nanotubos o apilarse para formar grafito.
Los materiales de carbono
Los distintos tipos de enlace del carbono hacen posible la existencia de materiales de carbono de muy diversa estructura y propiedades, así como de distinta morfología y arquitectura. Nos movemos desde el carbono vítreo hasta los grafenos, pasando por carbones activados, espumas, fibras de carbono (unidireccionales, telas, preformas), fullerenos y nanotubos. Estos materiales pueden ser estructuralmente ordenados o desordenados, densos o porosos, conductores o aislantes.
Según su grado de perfección estructural se pueden clasificar en materiales grafíticos y no grafíticos. En los grafíticos, el carbono está dispuesto en planos paralelos unos a otros formando una red cristalina tridimensional próxima a la del grafito. De ahí que el término grafito suela emplearse, aunque de forma incorrecta, para definir los distintos materiales grafíticos.
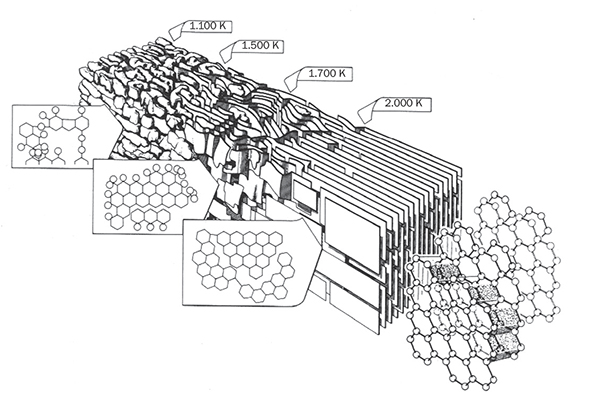
Los materiales no grafíticos pueden ser de dos tipos: grafitizables y no grafitizables. Un material de carbono grafitizable es aquel que, si bien inicialmente no es grafítico, se puede transformar en grafítico mediante un tratamiento a temperaturas superiores a 2.500 °C (figura 4). Por su parte, los materiales no grafitizables son aquellos cuya estructura nunca se aproximará a la del grafito aunque se sometan a elevadas temperaturas.
Figura 3
El grafeno como unidad estructural básica de los materiales de carbono. (Figura adaptada con permiso de McMillan Publishers Ltd: Nature Materials [Geim, 2007], copyright [2007].)
Como se observa en la figura 4, un material grafitizable presenta apilamientos relativamente paralelos de las unidades estructurales grafíticas, pero tanto la forma como el tamaño de estas láminas es bastante heterogéneo. Además, la estructura hexagonal es poco regular, ya que existen numerosas vacantes y heteroátomos (oxígeno, nitrógeno…). Con el aumento gradual de la temperatura (siempre en atmósfera inerte, porque si no se quemaría), los planos crecen lateralmente al unirse unos a otros, mientras va disminuyendo el número de defectos presentes en cada lámina. En el rango de temperaturas 2.000-2.300 °C se forma una estructura en la que el ordenamiento cristalino es de corto alcance, ya que los diferentes apilamientos no poseen ninguna correlación con los adyacentes. A temperaturas superiores a los 2.300 °C los apilamientos de los planos alcanzan un mayor grado de paralelismo y los heteroátomos desaparecen completamente, aproximándose a la estructura propia del grafito.
Figura 4
Proceso de transformación de un material de carbono no grafítico (pero sí grafitizable) en grafítico. (Modelo Marsh-Griffiths, 1982.)
El grafito: progenitor del grafeno
En el grafito, según hemos visto al inicio de este capítulo, los átomos de carbono están fuertemente unidos en el plano mediante enlaces covalentes, configurando capas (planos basales). Estas capas están apiladas paralelamente y unidas entre sí por fuerzas de Van der Waals, más débiles. La distancia entre planos basales es de 0,335 nm. Cuando se habla de grafito lo más correcto es utilizar el término capa, y el de lámina cuando esa capa ya está aislada y constituye el grafeno propiamente dicho.
Figura 5
Clasificación de los distintos tipos de grafito.
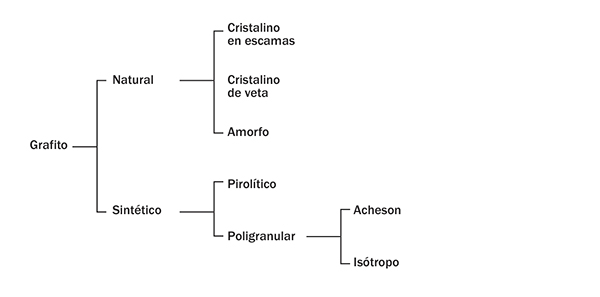
Cuando nos referimos al grafito como material o como mineral, debemos plantearnos el término en plural, “grafitos”, porque no hay un grafito único, sino que existe una amplia gama de productos que se aproximan en mayor o menor medida a su estructura. Esto es importante de cara a exigir que siempre que se hable de obtención de grafeno a partir de grafito se le pongan los apellidos correspondientes, se identifique el tipo de grafito, ya que puede influir en las características del grafeno, como veremos más adelante.
Los grafitos se pueden dividir en dos grandes grupos de acuerdo con su origen, natural o sintético (figura 5).
El grafito natural es el producto de la recristalización metamórfica de la materia orgánica contenida en las rocas. Cuando este proceso se produce sobre capas de carbón, o sobre rocas que contienen hidrocarburos líquidos (petróleo), se generan yacimientos, que también pueden tener origen volcánico o hidrotermal.
Es relativamente abundante en la naturaleza, está constituido mayoritariamente por carbono (80-90%) y presenta impurezas inorgánicas de distinta naturaleza (sílice, alúmina, óxido férrico, etc.), que se eliminan mediante procesos de flotación en disolventes; si se requiere un mayor grado de pureza, deben utilizarse tratamientos químicos. Sus propiedades y composición vienen determinados por su localización geológica (principalmente se encuentra en China, la India, Brasil, Corea del Norte y Canadá) y su proceso natural de formación. China es el mayor productor de grafito natural, seguida de Corea del Sur y la India. De acuerdo con los datos de que disponemos, en España existen yacimientos en distintos lugares que fueron explotados entre los siglos XVIII-XIX y a lo largo del siglo XX, si bien la producción de grafito natural cesó en 1961 (mina Coto Guadamur, Toledo). Se presenta en tres formas (figura 6): grafito cristalino en escamas (flake, en inglés), grafito cristalino de veta (término reservado a un grafito especial que procede de Sri Lanka) y grafito amorfo (denominación un tanto errónea si se considera que tiene un cierto grado de orden estructural, con cristales de pequeño tamaño). Otras clasificaciones se limitan a considerar solo dos tipos de grafito: microcristalino (integrado por escamas y cristales de tamaño relativamente pequeño) y macrocristalino (integrado por escamas y cristales de mayor tamaño).
El grafito cristalino en escamas (el que se utiliza principalmente en la preparación de grafeno) está constituido por partículas discretas en forma de placas planas con bordes angulosos, redondeados o irregulares. Se encuentra en rocas metamórficas como el mármol gneiss, el cuarzo o la mica. Su contenido en carbono es del 70-96%.
El grafito cristalino de veta, como su nombre indica, cristaliza en forma de vetas que se acumulan en grandes bolsas. Se cree que su origen se debe al depósito de carbono en fase líquida o gaseosa. Su contenido en carbono es del 80-99%.
El tercer tipo de grafito natural que se conoce es el grafito amorfo, que se forma a partir de sedimentos ricos en hulla y posee cierta estructura cristalina, en la que los cristales son muy pequeños y no están bien definidos. Su contenido en carbono es menor del 85%. En principio, sería el menos adecuado para la preparación de grafenos por su más bajo orden estructural y elevado contenido en materia mineral.
Si el desarrollo del grafeno cumple con las expectativas previstas, la demanda de grafito será muy superior a su producción actual. Si a esto le añadimos la localización geográfica de los principales yacimientos, que se concentran fundamentalmente en Asia, es evidente que el grafito sintético está llamado a desempeñar un papel clave para garantizar el suministro de materia prima, con el valor añadido de la variedad de grafitos de distinta estructura cristalina de que se puede disponer. El grafito sintético fue preparado por primera vez a principios del siglo XX. Para obtenerlo, un precursor orgánico (derivado del carbón o del petróleo) se trata a temperaturas del orden de los 1.000 ºC, en atmósfera inerte (proceso conocido como carbonización), generando el coque, que posteriormente se grafitiza a temperaturas superiores a los 2.500 ºC (figura 4).
Figura 6
a) Grafito cristalino en escamas; b) bloque de grafito cristalino de veta.

Los grafitos comerciales tradicionales son poligranulares, término que incluye a todos los grafitos sintéticos compuestos de granos que pueden distinguirse claramente al microscopio, siendo el de tipo Acheson y los isótropos los más habituales. El primero de estos grafitos debe su nombre a E.G. Acheson, quien, después de patentar en 1893 un método para fabricar carburo de silicio a partir de carbono amorfo y óxido de silicio, descubrió que calentando el carburo de silicio a alta temperatura (> 2.500 °C) se descomponía y daba lugar a un grafito sintético prácticamente puro. El grafito isótropo se utiliza en la fabricación del grafito moldeado. Para su obtención se calienta una mezcla de coque y un aglomerante (brea de alquitrán de hulla o de petrólero, generalmente) a baja temperatura (~ 150 °C) para que funda el aglomerante y se mezclen; esta mezcla se prensa, se carboniza y se grafitiza. Finalmente, puede tener lugar un proceso de mecanizado.
El grafito pirolítico también es un grafito sintético que se obtiene mediante el depósito de carbono a partir de un hidrocarburo gaseoso (metano, acetileno, etileno) a temperaturas superiores a 1.800 °C (proceso que se conoce como CVD, Chemical Vapour Deposition) o por tratamiento térmico de grafitización de un material de carbono pirolítico previamente preparado. Este tipo de grafitos presentan un alto grado de orientación cristalográfica. Si el grafito pirolítico se trata, a su vez, a temperaturas superiores a 2.500 °C y bajo presión da lugar a un grafito pirolítico con una estructura cristalina aún más orientada que recibe el nombre de grafito pirolítico altamente orientado (HOPG, Highly Oriented Pyrolytic Graphite). Este tipo de grafito es fácilmente exfoliable y genera unas láminas de grafeno de gran calidad, como se verá más adelante. El inconveniente es la pequeña cantidad que se obtiene mediante este procedimiento.
Propiedades del grafito
El grafito natural es un mineral suave, de color gris a negro y brillo metaloide (figura 6b), es estable, inodoro y no tóxico. Tiene la peculiaridad de que no funde en condiciones normales (presión atmosférica), sublimando a temperaturas del orden de 3.725 °C, por lo que es extremadamente refractario. Tiene una densidad de 2,26 g cm-3. No obstante, la mayoría de los materiales grafíticos presentan valores de densidad menores de 2,26 g cm-3, debido a la presencia de imperfecciones estructurales, tales como porosidad, vacantes atómicas y dislocaciones.
Tabla 1
Propiedades del grafito en función de la dirección de medida.

El hecho de que el grafito esté estructurado en capas le confiere un alto grado de anisotropía, es decir, que algunas de sus propiedades varíen considerablemente cuando se miden en la dirección de los planos basales o perpendicularmente a estos (tabla 1). Así, puede ser considerado un buen conductor del calor en la dirección paralela a los planos basales, mientras que en la dirección perpendicular su conductividad cae de manera importante y se comporta como un aislante térmico. La expansión térmica depende también de la fortaleza del enlace atómico, por lo que en la dirección de los planos basales es baja, inferior a la de la mayor parte de los materiales, mientras que en la dirección perpendicular, donde los enlaces son más débiles, la expansión térmica supera a la anterior en un orden de magnitud. Las propiedades eléctricas también varían considerablemente, siendo un buen conductor eléctrico en la dirección paralela a los planos y un aislante en la perpendicular.
Una propiedad muy importante del grafito con relación a la producción de grafeno es que se deslamina fácilmente en la dirección perpendicular a los planos, donde la fuerza de los enlaces es baja, mientras que en el plano basal su ruptura es difícil. La facilidad para deslizarse unas capas sobre otras permite su uso como lubricante y abre la puerta a emplearlo como materia prima en la obtención de grafeno, como se verá en el capítulo siguiente.
Químicamente, el grafito es uno de los materiales más inertes, siendo resistente a la mayoría de los ácidos, bases y agentes corrosivos. La principal excepción a su excelente resistencia química son los elementos del grupo 16 del sistema periódico (oxígeno, azufre, selenio y teluro), con los que reacciona a temperaturas superiores a 400 °C. Su reactividad química también se ve afectada por su anisotropía, motivo por el cual es mucho más inerte en los planos basales que en los bordes o que en los defectos estructurales de los planos. Por ello, los materiales grafíticos constituidos por grandes cristales y pocos defectos son los menos reactivos.
Aplicaciones del grafito
Una de sus aplicaciones más comunes, a la que ya se hizo referencia al comienzo de este libro, es la fabricación de la mina de los lápices. Pero, además, encuentra aplicación en sectores como energía móvil, industria del automóvil, tribología-lubricantes, polímeros conductores, metalurgia e industria química.
Dentro de la energía móvil se utilizan en baterías alcalinas, baterías recargables de ión-litio y pilas de combustible. En las baterías alcalinas, el grafito se emplea como un aditivo conductor en el cátodo; al mismo tiempo da lubricidad y reduce el desgaste. Aunque se utilizan ambos, el natural y el sintético, se requiere un estricto control de las impurezas inorgánicas del grafito natural para evitar problemas de corrosión. En el caso de las baterías recargables de ión-litio, el grafito se utiliza ampliamente como material activo del ánodo, debido a su capacidad para insertar de forma reversible los iones de litio. En las pilas de combustible, las placas bipolares están hechas normalmente de grafito por su buen comportamiento frente a la corrosión, alta conductividad eléctrica y estabilidad mecánica, entre otras propiedades.
En el área de la automoción se utiliza en materiales de fricción, escobillas y juntas. En las pastillas de freno y tambores suministra el nivel de coeficiente de fricción requerido a diferentes condiciones de operación y también contribuye a mantener los niveles de temperatura, vibración y ruido, logrando además que la velocidad de desgaste y el precio de producto se encuentren dentro de unos límites aceptables. El grafito es el principal componente de la mayoría de las escobillas de carbono utilizadas en motores eléctricos; sus propiedades permiten ajustar la lubricidad, densidad, dureza, desgaste y conductividad eléctrica de las escobillas; el grafito natural de elevado grado de pureza da excelentes resultados. En juntas se usan láminas de grafito natural expandido por su flexibilidad y estabilidad térmica.
En tribología-lubricantes, se puede utilizar como lubricante en polvo sólido. A modo de ejemplo, garantiza la lubricación de las zapatas de freno de las ruedas de los trenes. Su lubricidad también se explota en suspensiones de aceite o grasa. Dispersiones de grafito en agua con aditivos (surfactantes) se pulverizan en mandriles de acero calientes a altas temperaturas para garantizar la lubricación durante la producción de tubos para sondeos petrolíferos; también se utiliza durante la propia operación de sondeo.
Dentro de la industria metalúrgica, la de refractarios es probablemente su principal consumidora. Durante años, el grafito se ha convertido en un aditivo esencial merced a sus excelentes propiedades térmicas y lubricidad, combinadas con su carácter inerte e hidrófobo. La adición de grafito a ciertos productos refractarios aumenta significativamente su resistencia al choque térmico y a la corrosión. La aplicación más extendida en la industria del hierro y del acero es indudablemente en ladrillos cerámicos de magnesia-carbono, por su capacidad para resistir la corrosión producida por los depósitos de impurezas inorgánicas que se generan en el metal fundido.
En la industria química se emplea en la fabricación de caucho, explosivos y pulimentos, en la elaboración de fibras y municiones. También es un componente en la elaboración de pinturas y pigmentos.
Todo esto nos permite ver la gran utilidad histórica del grafito para muy distintas aplicaciones de tipo convencional y de alta tecnología. Ha formado parte de manera directa de nuestra vida cotidiana e indirectamente a través de sectores como el transporte, la construcción, la salud, el energético, etc. Lo que nadie hubiese podido imaginar hace unos años es que se pudiesen separar las capas que integran el grafito, y menos que este hecho tuviese la trascendencia y repercusión que está alcanzando. El grafito ha pasado, de este modo, de ser un material muy útil a ser la llave de una revolución científica y tecnológica como la del grafeno.