capítulo 3
ANATOMÍA MICROSCÓPICA
Tejidos epiteliales
Características generales de los tejidos epiteliales
Los tejidos epiteliales cubren la superficie externa del cuerpo, delimitan las cavidades corporales y forman las glándulas. Su estructura básica corresponde a una lámina de células estrechamente asociadas entre sí, la cual se asocia a un material extracelular llamado lámina basal que lo une al tejido conjuntivo subyacente, donde se ubican los vasos sanguíneos que irrigan a la lámina epitelial (Figuras 3-1a y b).
Las células soportan las tensiones mecánicas, por medio de resistentes filamentos proteicos que se entrecruzan, en el citoplasma de cada célula epitelial, formando el citoesqueleto. Para transmitir la tensión mecánica de una célula a las siguientes, estos filamentos están unidos a proteínas transmembrana que se ubican en sitios especializados de la membrana celular. Estas proteínas se asocian, en el espacio intercelular, ya sea con proteínas similares de la membrana de las células adyacentes, o con proteínas propias de la lámina basal subyacente (Figuras 3-2a, b y c).
La presencia de uniones especializadas entre sus células permite a los epitelios formar barreras para el movimiento de agua, solutos o células, desde un compartimiento corporal a otro. Un epitelio separa el lumen intestinal de los tejidos subyacentes y un epitelio separa a la pared intestinal de la cavidad abdominal.
Los epitelios también pueden organizarse en glándulas, las que corresponden a estructuras complejas cuyas células están destinadas fundamentalmente a la secreción. A este grupo pertenecen los epitelios glandulares (Figura 3-3a y b).
Funciones que realizan los epitelios
Los epitelios pueden presentar adaptaciones estructurales que les permiten realizar, como función principal, las siguientes tareas específicas:
• Servir como barrera de protección
• Transportar material a lo largo de su superficie
• Absorber una solución de agua e iones desde el líquido luminal
• Atraer moléculas desde el líquido luminal hacia el tejido subyacente
• Sintetizar y secretar material glicoproteico hacia la superficie epitelial
Epitelios que sirven como barrera de protección
Estos epitelios están formados por varios estratos de células, de las cuales solo la primera capa está en contacto con la lámina basal. En este primer estrato se ubican las células troncales y a partir de ellas nacen continuamente nuevas células. Las nuevas células se diferencian mientras migran hacia los estratos más superficiales para reemplazar a las células que enfrentan la superficie libre, las que se desprenden finalmente del epitelio.
La estructura del epitelio se mantiene estable gracias a una dinámica bien regulada entre los procesos de proliferación, diferenciación y descamación que enfrentan sus células. El caso más notable lo constituye la epidermis, epitelio plano pluriestratificado cornificado que sirve de protección ante los traumatismos mecánicos y forma una barrera impermeable al agua, capaz de proteger a los organismos terrestres de la desecación (Figura 3-4a).
Las células de los estratos más superficiales están rodeadas de un material rico en glicolípidos, sintetizado y secretado por ellas, que impide el paso de agua a través de los espacios intercelulares de este epitelio (Figura 3-4b). Las capas superficiales aparecen además como escamas córneas con su citoplasma lleno de manojos de filamentos de queratina asociados a la proteína filagrina. Estos manojos engloban a los organelos que ya no son visibles.
Epitelios que transportan material a lo largo de su superficie libre
La superficie de los epitelios que realizan esta función está bañada por un líquido y la cara luminal de las células presenta numerosos cilios (Figura 3-5a).
El epitelio de revestimiento de la tráquea es un buen ejemplo, ya que tanto las partículas como los microorganismos presentes en el aire inhalado son atrapados en el mucus que baña su superficie, y el desplazamiento de esta capa mucosa por la superficie luminal es realizado por el movimiento coordinado de sus cilios (Figura 3-5b).
El batido de los cilios consiste en un desplazamiento hacia adelante, parecido al golpe de un látigo, que termina con el cilio completamente extendido, perpendicular a la superficie celular, y con su extremo en la capa de mucus (movimiento efectivo).
Este movimiento es seguido de una ondulación hacia abajo y atrás (movimiento de preparación) durante la cual el extremo del cilio se aproxima a la superficie celular y el cilio se desplaza cerca de la célula en la capa acuosa de menor resistencia (Figura 3-5c).
Para que se genere una onda organizada de movimiento que permita desplazar a la capa de líquido con las partículas que contenga, el movimiento de los cilios debe estar coordinado tanto en cada célula como entre las células adyacentes.
Epitelios que absorben moléculas desde el líquido luminal hacia el tejido subyacente
Estos epitelios se caracterizan porque la superficie luminal de las células presenta abundantes microvellosidades. Un caso típico es el epitelio de revestimiento del intestino delgado, en el cual ellas forman la chapa estriada (Figuras 3-6a y b).
La existencia de las microvellosidades se traduce en un notable incremento del área de superficie celular expuesta al líquido luminal. La membrana plasmática luminal contiene proteínas que realizan el transporte específico de moléculas. Por ejemplo, la glucosa podrá entrar hacia el citoplasma siempre que sea cotransportadas con Na+.
La concentración intracelular de Na+ se mantiene baja, ya que la Na/K-ATPasa, ubicada en la membrana de las caras laterales, efectúa el transporte activo de Na+ hacia los espacios intercelulares (Figura 3-6c).
Epitelios capaces de absorber iones y agua desde el líquido luminal
Un ejemplo es el epitelio de revestimiento de la vesícula biliar, que participa en la concentración de la bilis (Figura 3-7a). Para ello, absorbe Na+, Cl– y H20 desde la bilis. El epitelio libera hacia el tejido subyacente una solución de cloruro de sodio que es isotónica con la solución que baña su superficie luminal (Figura 3-7a).
Las células de este epitelio cilíndrico monoestratificado se caracterizan porque:
• Su membrana plasmática luminal es permeable al agua, sodio y cloruro.
• La membrana plasmática de sus caras laterales es permeable al cloruro y al agua, y contiene a la Na/K-ATPasa, capaz de transportar activamente sodio desde el citoplasma hacia el espacio intercelular, intercambiándolo por potasio.
• Contiene abundantes mitocondrias, capaces de sintetizar el ATP necesario para el transporte activo de sodio (Figura 3-7b).
Al activarse el transporte activo de sodio, se produce también la salida de Cl– desde la célula. El aumento de Na+ y Cl– en el espacio intercelular crea un microambiente hipertónico que genera la salida de agua desde el citoplasma. Mientras esta solución fluye por el espacio intercelular hacia la zona basal del epitelio, continúa el arrastre osmótico de agua, hasta que esta solución se hace isotónica con la del contenido luminal. Así la existencia de los espacios intercelulares permite acoplar el transporte activo de Na+ a la absorción de agua (Figura 3-7c).
Epitelios que secretan material glicoproteico hacia su superficie luminal
Entre las células epiteliales especializadas en la secreción de glicoproteínas, un buen ejemplo son las células caliciformes, ubicadas en el epitelio de revestimiento de la tráquea y del intestino delgado (Figura 3-8a).
Estas células, que funcionan como glándulas unicelulares, se caracterizan por tener en su citoplasma retículo endoplásmico rugoso y un aparato de Golgi muy desarrollado organizados en forma tal, que la secreción de las glicoproteínas ocurre solo hacia el polo luminal de la célula, donde al hidratarse forman el mucus que baña a la superficie epitelial (Figura 3-8b).
Clasificación tradicional de los epitelios
Considerando el número de capas celulares que forman los distintos tipos de epitelios que existen en el organismo, ellos se subdividen en:
• Simples o monoestratificados: Láminas epiteliales formadas únicamente por una capa de células.
• Estratificados: Están formados por dos o más capas celulares.
• Seudoestratificados: Son aquellos que parecen como estratificados, pero todas sus células llegan a la membrana basal y solo las células más altas forman la superficie luminal.
Epitelios simples
De acuerdo a la forma de sus células, se clasifican en:
• Planos o escamosos: Las células son planas, mucho más anchas que altas (Figura 3-9a). A este tipo corresponde la hoja parietal de la cápsula de los glomérulos renales, el endotelio de los vasos sanguíneos y el mesotelio del peritoneo (Figura 3-10a).
• Cúbicos: Sus células tienen un ancho similar a su alto (Figura 3-9b). Se les encuentra, por ejemplo, revistiendo los túbulos distales en el riñón (Figura 3-10b).
• Cilíndricos: Las células tienen un alto mucho mayor que su ancho (Figura 3-9c). A este tipo corresponden el que reviste el lumen de la vesícula biliar y el epitelio de revestimiento intestinal que contiene tanto a las células de absorción como a las células capaces de sintetizar una secreción glicoproteica (Figura 3-10c).
Epitelios estratificados
Ellos están formados por un número variable de capas celulares. Las células de cada capa tienen formas diferentes. El nombre específico del epitelio estratificado se define según la forma de las células vecinas a la superficie, siendo el más frecuente el epitelio estratificado plano que muestra sus células más superficiales planas (Figura 3-11a), mientras que las adyacentes a la lámina basal son cilíndricas y las células de los estratos intermedios son más bien poliédricas. Este tipo de epitelio reviste la superficie del lumen del esófago (Figura 3-11b). Mientras que en la epidermis (Figura 3-11c) se encuentra el epitelio plano pluriestratificado cornificado, en el cual ocurre una notable diferenciación de los componentes celulares y extracelulares de su cara luminal (Figura 3-11d).
Epitelios seudoestratificados
Parecen formados por dos o más capas de células, pero si bien todas sus células están en contacto con la lámina basal, solo algunas células llegan hasta el borde luminal. Por ello presentan dos o más filas de núcleos, ubicados a alturas sucesivas en la lámina epitelial (Figura 3-12a).
Se les encuentra revistiendo el lumen de la tráquea (Figura 3-12b) y del epidídimo. La superficie de las células que llegan al lumen presenta, por lo general, diferenciaciones tales como cilios en la tráquea o estereocilios en el epidídimo.
Un caso especial es el epitelio de transición llamado también urotelio (Figura 3-13a), propio de las vías renales, el cual cambia su forma según el estado de distensión del lumen del órgano. Aparecen estratificados planos cuando la lámina epitelial está tensa y como estratificados cuboidales cuando el epitelio está distendido. Ellos corresponden a un tipo especial de epitelio seudoestratificado, ya que todas sus células están en contacto con la lámina basal y puede modificarse la forma de sus células (Figura 3-13b).
Características de los epitelios simples o monoestratificados
Se analizará la organización estructural básica de los epitelios monoestratificados, que les permite especializarse para diversas funciones. El detalle de la organización estructural específica de diferentes epitelios estratificados y seudoestratificados se analizará al estudiar los órganos que los contienen.
En la organización de un epitelio monoestratificado, tal como el epitelio de revestimiento del intestino delgado, destacan los siguientes hechos (Figuras 3-14a y b):
• Está formado por una sola capa de células, todas ellas cilíndricas.
• Existen al menos dos tipos de células que forman esta única lámina epitelial: células glandulares secretoras de glicoproteínas y células especializadas en la absorción de componentes específicos desde el lumen intestinal hacia el estroma subyacente al epitelio.
• Las células que forman esta lámina epitelial presentan una notable polaridad, tanto en la organización intracelular de sus organelos como en la estructura de su membrana plasmática y en las especializaciones de las distintas superficies celulares.
Uniones entre células epiteliales
Las células epiteliales forman láminas continuas, ya que cada célula epitelial tiene, en sus caras laterales, especializaciones que le permiten formar uniones estables con las células adyacentes.
Existen tres clases de uniones intercelulares:
• Uniones de adherencia de las cuales existen dos tipos: zónulas adherentes o bandas de adhesión, vecinas al borde luminal de las células (Figura 3-15a) y desmosomas o máculas adherentes, distribuidos en las caras laterales de las células (Figura 3-15b).
• Uniones de oclusión ubicadas junto al borde luminal de las células (Figura 3-15c).
• Uniones de comunicación entre los citoplasmas de células vecinas, distribuidas en las caras laterales de las células adyacentes (Figura 3-15d).
Uniones de adherencia
Su función es formar uniones entre los citoesqueletos de las células epiteliales, permitiendo la transmisión de fuerzas mecánicas a lo largo de la lámina epitelial. Si la unión es entre los microfilamentos de actina, estas uniones reciben el nombre de zónulas adherentes o bandas de adhesión; y si la asociación es entre filamentos intermedios, estas uniones se denominan desmosomas o máculas adherentes. Su estructura general se ilustra en la Figura 3-16.
Ellas están formadas por los siguientes componentes:
• Glicoproteínas transmembrana, cuyo dominio citoplasmático se asocia a proteínas intracelulares, mientras que su dominio extracelular interactúa con el de la glicoproteína transmembrana ubicada en la membrana celular de la célula vecina.
• Proteínas de unión intracelular, que conectan a la glicoproteína transmembrana de cada célula con los filamentos del citoesqueleto asociados a la unión.
Zónula adherens (o banda de adhesión)
Ellas se ubican en el borde lateral de cada célula, vecina a la superficie apical (Figuras 3-17a y b).
En esta zona se reconoce un corte al microscopio electrónico porque:
• Las membranas plasmáticas de células adyacentes corren paralelas, separadas por un espacio de 20 nm, el cual está ocupado por el dominio extracelular de las moléculas transmembrana de la familia de las caderinas. En este espacio ocurre la unión entre las E-caderinas de ambas membranas. La capacidad de adhesión intercelular de las caderinas depende de la presencia de Ca++.
• Una delgada placa densa a los electrones se asocia a la cara interna de cada membrana celular y en ella se ubican los dominios intracelulares de las moléculas de E-caderina. Cada uno de ellos se asocia a moléculas de cateninas, las cuales los unen a filamentos de F-actina.
• Los microfilamentos de actina se disponen como un anillo paralelo a la membrana plasmática y se anclan lateralmente, mediante las cateninas, a las E-caderinas (Figura 3-17c). Su función es unir los citoesqueletos de actina a las células epiteliales adyacentes. La zónula adherente contribuye además a la mantención de la forma de la superficie luminal de las células diferenciadas y parece jugar un rol fundamental en la morfogénesis, y en los procesos de cambio en la forma de plegamiento de las láminas epiteliales.
Desmosoma (macula adherens)
Estas uniones tienen la forma de un botón y pueden ubicarse vecinos entre sí, en el contorno celular que mira hacia los espacios intercelulares. Esto resulta muy evidente en los epitelios pluriestratificados (Figura 3-18a).
En cortes al microscopio electrónico de transmisión (Figura 3-18b) se reconocen porque:
• Las membranas de las células adyacentes corren paralelas entre sí, separadas por un espacio de unos 20 nm, el que presenta una línea densa en su zona media.
• Adherida a la cara intracelular de la membrana plasmática, se encuentra una banda densa llamada placa desmosómica.
• Insertos en la placa desmosómica aparecen numerosos filamentos intermedios.
La organización molecular de la estructura de un desmosoma se muestra en la Figura 3-18c.
El espacio entre las membranas adyacentes contiene a los dominios extracelulares de las moléculas transmembrana llamadas desmogleínas y desmocolinas. Estos dominios extracelulares interactúan en forma homofílica asociando a las dos células adyacentes. La mantención de la interacción entre las caderinas depende de la presencia de Ca++.
El dominio citoplasmático de las desmogleínas y desmocolinas se ubica en la placa desmosómica. En este sitio se unen a proteínas ubicadas en la placa desmosómica y son las desmoplaquinas, las que se asocian con la cara lateral de los filamentos intermedios que se insertan en la placa, formando una horquilla. Su función es mantener unidas a las células del epitelio, asociando los citoesqueletos de filamentos intermedios de las células vecinas, formando así una red transcelular con una alta resistencia a la tracción mecánica. Esto permite que las células mantengan su forma y que la lámina epitelial exista de modo estable.
Uniones de oclusión (Zónula occludens)
Ellas corresponden a una banda continua en el borde apical de las células epiteliales que forma:
• una barrera que restringe la difusión de proteínas y lípidos de la membrana plasmática desde la superficie luminal hacia la superficie basolateral de las células;
• una estructura que regula el paso de iones y moléculas por los espacios intercelulares mediante una vía paracelular.
En cortes observados al microscopio electrónico de transmisión (Figura 3-19a), se caracterizan porque las membranas plasmáticas de las dos células adyacentes parecen fusionarse cerca del borde apical, desapareciendo el espacio intercelular en zonas de 0,1 a 0,3 um de longitud.
Estos puntos de contacto resultan de la interacción, en el extracelular, de dos tipos de proteínas transmembrana llamadas: occludinas y claudinas que se caracterizan por presentar una zona hidrofóbica en su dominio extracelular, lo que permite la interacción entre dos occludinas que se enfrentan en el espacio intercelular (Figura 3-19b). Esta zona se extiende en forma de cinturón alrededor de todo el perímetro celular, interactuando cada célula con las células adyacentes a ella, cerrándose así el espacio intercelular.
En preparaciones por criofractura a través de una zónula ocluyente, se observa que las caras citoplasmática (P) y extracelular (E) de la membrana plasmática presentan estructuras lineales. En la cara (P), aparecen como crestas o eminencias, mientras que en la cara (E) aparecen como surcos poco profundos (Figura 3-19c).
Cada una de estas eminencias lineales (cara P) está formada por la asociación de sucesivas moléculas de occludinas; mientras que los surcos lineales (cara E) corresponden a los sitios ocupados previamente por moléculas de occludina que al ocurrir la fractura quedaron en la otra cara de la membrana celular. Tanto el número de líneas como su entrecruzamiento varían según el tipo de epitelio.
Las células del revestimiento gástrico muestran unas zónula s ocluyentes muy anchas y con muchos puntos de fusión, mientras que entre los hepatocitos se observan pocos puntos de fusión y más separación.
Uniones de comunicación (uniones de hendidura)
Estas uniones tienen forma de botón y se distribuyen de modo discreto en los límites intercelulares.
Se reconocen en cortes al microscopio electrónico de transmisión porque (Figuras 3-20a y b) las membranas plasmáticas adyacentes corren paralelas entre sí, separadas por 20 nm.
En cortes adecuados es posible observar que un bandeo fino atraviesa este espacio intercelular. La existencia de estructuras que atraviesan este espacio se demuestra al marcar con trazadores el espacio intercelular.
La estructura de una unión de comunicación se muestra en la Figura 3-20c y d. En preparaciones obtenidas por criofractura, la cara citoplasmática de la membrana (cara P) presenta un número variable de partículas que hacen eminencia, mientras que la cara E (extracelular) complementaria muestra un conjunto de invaginaciones cuyo tamaño y disposición concuerdan con la disposición de las partículas en la cara P.
Las partículas que se observan en la cara P forman las unidades funcionales de las uniones y se llaman conexones. Los conexones están constituidos por seis proteínas transmembrana llamadas conexinas, las cuales al interactuar entre sí pueden dejar un canal hidrofílico central. Los dominios extracelulares de los conexones pueden interactuar entre sí, uniendo a las células y creando un canal hidrofílico entre los citoplasmas de las células adyacentes.
Su función es formar un canal que atraviese las membranas de células vecinas, permitiendo la comunicación entre sus citoplasmas. La apertura del canal, regulando la posición de las conexinas, permite a las células tanto su acoplamiento eléctrico como metabólico.
Polaridad en epitelios monoestratificados
La organización polarizada de las células que forman la lámina epitelial es una característica fundamental de los epitelios. La mantención de esta propiedad depende tanto de las interacciones que establecen las células epiteliales tanto entre sí como de su relación con la matriz extracelular de su membrana basal.
En las células de los epitelios simples, la polaridad se manifiesta en:
• diferencias en la estructura y en las propiedades de la superficie apical, lateral y basal de cada célula (Figura 3-21a), la distribución vectorial de los organelos celulares en el interior del citoplasma, para facilitar mecanismos tales como absorción de iones o la secreción de glicoproteínas (Figuras 3-22a y b);
• una estructura molecular de la membrana plasmática que reviste la superficie luminal, diferente a la de la membrana que cubre la superficie lateral y la superficie basal de las células (Figura 3-21b).
Superficie luminal de las células epiteliales
Ella puede presentar especializaciones del citoplasma y de la superficie celular, de acuerdo a la función que desempeña el epitelio. Entre ellas, destacan la existencia de prolongaciones digitiformes del citoplasma de la superficie libre, las cuales pueden ser de tres tipos: las microvellosidades, los estereocilios y los cilios.
Microvellosidades
Son particularmente numerosas en aquellos epitelios simples que cumplen funciones de absorción y transporte transepitelial como es el caso de los túbulos proximales del riñón (ribete en cepillo) (Figura 3-23a) y el epitelio de revestimiento intestinal (chapa estriada) (Figura 3-23b). Estas prolongaciones digitiformes miden 0,080 um de ancho y 1,0 um de longitud y producen un aumento de alrededor de 20 veces en la superficie de absorción (Figura 3-23c).
La estructura de cada microvellosidad se mantiene gracias a un manojo de entre 19 y 30 microfilamentos de actina, que nacen desde la punta de la microvellosidad y se extienden hacia la red terminal (Figura 3-24a). Los microfilamentos de actina se disponen con su extremo (+) asociado a la membrana plasmática del ápice de las vellosidades mediante moléculas de formina. Estos filamentos se mantienen unidos entre sí mediante proteínas ligantes de actina y los microfilamentos de actina de la periferia de cada manojo de asocian a la membrana plasmática de la microvellosidad por su interacción con moléculas de miosina-1.
En la base de las microvellosidades, los filamentos de actina se anclan en la red terminal, que es una región especializada del citoesqueleto de las células intestinales que contiene una densa malla de espectrina que entrecruza los microfilamentos de actina de microvellosidades adyacentes y que, hacia el interior de la célula, se asocia a una red de filamentos intermedios de citoqueratina. El anclaje de los microfilamentos a esta zona le otorga rigidez a las microvellosidades.
La membrana que cubre las microvellosidades intestinales es altamente especializada, y presenta una gruesa cubierta extracelular, rica en polisacáridos, denominada cubierta celular o glicocálix. Los carbohidratos que forman la cubierta celular corresponden a oligosacáridos presentes en glicolípidos, proteoglicanos y glicoproteínas integrales de la membrana. En el caso del epitelio intestinal, algunas glicoproteínas, que forman parte del glicocálix, corresponden a disacaridasas y gamma-glutamil-transpeptidasas, enzimas que participan en el proceso digestivo (Figura 3-24b).
Estereocilios
Son microvellosidades inmóviles extremadamente largas. Se les encuentra en el epitelios del epidídimo y del segmento inicial del conducto deferente (Figuras 3-25a y b) y en las células vellosas del órgano de Corti.
Cilios
Son diferenciaciones de la superficie apical de las células epiteliales que participan en el transporte de sustancias a lo largo de la superficie epitelial. Así, los epitelios que tapizan el oviducto y las vías del tracto respiratorio, contienen células ciliadas (Figuras 3-5a y 3-12b).
Cada una de estas prolongaciones mide 8 um longitud y 0,25 um de diámetro, y contiene un eje de microtúbulos (Figuras 3-26a y b), que nace desde el cuerpo basal, ubicado en el citoplasma en el cual los microtúbulos se organizan como nueve tripletes.
En cada axonema hay un par central de microtúbulos y nueve pares periféricos o dobletes. Esta disposición 9 + 2 es característica de los cilios móviles. Cada de uno de los dobletes está formado por un microtúbulo completo y otro parcial, fusionados de tal manera que comparten parte de su pared (Figura 3-26b y c).
Las proteínas que se asocian a los microtúbulos del axonema se disponen en forma regular a lo largo de los microtúbulos.
Sus principales funciones son:
• Mantener unidos a los microtúbulos que forman el axonema.
• Generar la fuerza que permite el movimiento de inclinación del cilio.
• Regular la interacción de los componentes del axonema para producir un cambio coordinado en la forma del cilio.
La más importante de estas proteínas accesorias es la dineína ciliar, proteína con actividad ATPásica, cuyos brazos laterales se extienden entre los pares de microtúbulos que forman los dobletes externos. Esta proteína es responsable de generar la fuerza de deslizamiento entre los dobletes que permite la inclinación de los cilios (Figura 3-26c y d).
Superficie lateral de las células epiteliales
En la zona vecina a la cara libre del epitelio, la superficie lateral de las células presenta un sistema de uniones intercelulares llamado complejo de unión, que une a las células entre sí y define las caras luminal y basolateral de cada célula.
Complejo de unión
Está formado por la asociación de tres tipos de uniones: la zónula ocluyente o banda de oclusión, la zónula adherente o banda de adhesión y los desmosomas o máculas de adhesión (Figuras 3-27a y b).
Zónula ocluyente
Juega un rol fundamental en la mantención de la diferencia en la composición molecular de las membranas apical y basolateral. Los lípidos de la lámina interna de la bicapa lipídica difunden lateralmente a través de la zona de oclusión; en cambio, los lípidos de la lámina externa no pueden atravesarla. A su vez, las proteínas intrínsecas se desplazan libremente en su dominio de la membrana celular, pero no pueden atravesar la zona de oclusión para pasar al dominio adyacente.
Si las uniones estrechas desaparecen, la asimetría en la distribución de moléculas en las membranas luminal y basolateral no se mantiene y se pierde la organización polarizada de la membrana celular.
Superficie basal de las células epiteliales
La superficie basal de las células epiteliales está en contacto con una especialización de la matriz extracelular, denominada lámina basal. Esta estructura se une a la membrana plasmática de la base de las células a través de proteínas receptoras específicas, que forman parte de las uniones adherentes de la base.
Estructura de la lámina basal
Es una especialización de la matriz extracelular, que se ubica entre el epitelio y el tejido conjuntivo subyacente. Las moléculas que la forman son sintetizadas, de modo conjunto, por las células epiteliales y las células conjuntivas subyacentes (Figura 3-28a).
Al microscopio electrónico de transmisión, la lámina basal aparece formada por la lámina lúcida o rara, que sigue estrechamente el contorno basal de la célula, y por la lámina densa. Junto a la lámina densa existe una zona de grosor variable llamada capa reticular, formada principalmente de fibrillas reticulares sintetizadas por células conjuntivas subyacentes (Figura 3-28b). La asociación de la lámina basal con las fibrillas colágenas se denomina membrana basal y es visible al microscopio de luz.
En aquellos órganos en que los capilares sanguíneos se adosan al epitelio, como en los alvéolos pulmonares y en el glomérulo renal, las láminas basales producidas por el endotelio y el epitelio se fusionan (Figuras 3-29a y b). Por convención, la lámina rara vecina al endotelio se denomina lámina rara interna y la cercana al epitelio se llama lámina rara externa.
Estructura molecular de la lámina basal
La lámina basal es, esencialmente, un retículo laminar de moléculas de colágeno tipo IV, unido a moléculas específicas que le permiten asociarse a las células vecinas y/o a la matriz extracelular. Las moléculas asociadas al colágeno corresponden a glicoproteínas como laminina y entactina, y a proteoglicanos de heparán sulfato, llamados perlecanes (Figura 3-30a). Estas moléculas pueden asociarse tanto entre sí como entre ellas (Figura 3-30b).
La localización inmunocitoquímica de estas moléculas muestra la siguiente distribución en la lámina basal (Figura 3-30c):
• El colágeno de tipo IV se ubica en la lámina densa.
• Las moléculas de proteoglicano se concentran a ambos lados de la lámina densa.
• Las moléculas de la laminina, molécula de 120 nm de longitud, atraviesa ambas láminas. La laminina contribuiría a anclar las células epiteliales a la lámina densa, ya que ella tiene sitios de unión para moléculas de integrina de la membrana celular de la base celular, para colágeno de tipo IV y para entactina.
• La entactina posee sitios de unión para colágeno tipo IV y laminina. De ahí que se plantee que juega un rol en la asociación de la malla de colágeno tipo IV a laminina.
• La fibronectina une la lámina densa a fibrillas colágenas de la lámina reticular.
Entre las funciones de la lámina basal mencionaremos: sirve de elemento de anclaje para las células epiteliales; participa en la determinación de la polaridad celular; e induce la diferenciación celular.
Uniones adherentes de la base celular a la matriz extracelular
Los epitelios se adhieren al tejido conjuntivo subyacente, a través de la lámina basal. La membrana plasmática de la base celular contiene proteínas transmembrana que por su porción extracelular pueden asociarse a macromoléculas que forman la lámina basal; y por su porción intracelular, interactúan con filamentos del citoesqueleto celular. Cuando la unión es con filamentos intermedios, ella corresponde a un hemidesmosoma y cuando es al citoesqueleto de actina, se trata de contactos focales.
Hemidesmosomas
Tal como su nombre lo indica, su ultraestructura es similar a la mitad de un desmosoma; sin embargo, las moléculas que lo forman son diferentes (Figuras 3-31a y b). Están formados por una placa densa adosada a la membrana celular, en la que los filamentos intermedios se insertan, uniéndose a proteínas de conexión, del tipo de las desmoplaquinas, las cuales se conectan a la porción citoplasmática de las proteínas integrales de la membrana celular, que pertenecen a la familia de las integrinas. La porción extracelular de cada molécula de integrina actúa como receptor capaz de unirse específicamente a moléculas de laminina o a moléculas de colágeno IV de la membrana basal.
Contactos focales
En este caso son los microfilamentos de actina que se asocian a la matriz extracelular. Las proteínas de unión transmembrana que participan son de la familia de las integrinas. El dominio intracelular de la integrina se une a través de una proteína conectora llamada talina, a las proteínas asociadas al microfilamento de actina, la vinculina y la alfa actinina. El dominio extracelular de la integrina se une a moléculas de la lámina basal (Figura 3-31c).
Pliegues basales
En la mayoría de los epitelios, la superficie basal presenta un contorno liso. Sin embargo, los epitelios especializados en el transporte de electrolitos y agua suelen presentar profundos pliegues basales que permiten la amplificación de la superficie baso-lateral.
El aumento de la superficie basal es una característica de las células que realizan la absorción activa de Na+ con arrastre osmótico de agua. Las células del túbulo proximal del riñón presentan esta diferenciación basal (Figuras 3-32a y b).
El ATP necesario para la actividad de la bomba de Na+ es producido por mitocondrias que se ubican en el citoplasma de los pliegues basales. La disposición paralela de estos organelos le da un aspecto estriado a la región basal celular. En la membrana plasmática, que reviste las profundas invaginaciones del citoplasma basal, se localiza la Na /K-ATPasa, que transporta activamente al Na+ hacia el exterior de la célula. Se crea así una alta concentración de NaCl en el espacio extracelular entre los pliegues basales, lo que genera la salida de agua desde el citoplasma por arrastre osmótico (Figura 3-32c). De esta manera se forma una solución de NaCl que fluye hacia el conjuntivo subyacente, donde se ubican los capilares que irrigan al epitelio. Esta solución de NaCl que puede llegar a ser isotónica con la solución presente en el lumen tubular.
Tejidos Conectivos
Definición y funciones
Los tejidos conjuntivos, derivados del mesénquima, constituyen una familia de tejidos que se caracterizan porque sus células están inmersas en un abundante material intercelular, llamado matriz extracelular.
Existen dos variedades de células conjuntivas:
• Células estables, las que se originan en el mismo tejido y que sintetizan los diversos componentes de la matriz extracelular que las rodea.
• Población de células migratorias, originadas en otros territorios del organismo, que llegan a habitar transitoriamente el tejido conjuntivo.
La matriz extracelular es una red organizada, formada por el ensamblaje de una variedad de polisacáridos y de proteínas secretadas por las células estables, que determina las propiedades físicas de cada una de las variedades de tejido conectivo.
Existen varios tipos de tejidos conectivos, ya que ellos se organizan en diversas formas, adaptada cada una de ellas a funciones específicas, tales como:
• Mantener unidos entre sí a los otros tejidos del individuo, formando el estroma de diversos órganos (Figura 3-33a): tejidos conjuntivos laxos.
• Contener las células que participan en los procesos de defensa ante agente extraños, constituyendo el sitio donde se inicia la reacción inflamatoria (Figura 3-33b): los tejidos conjuntivos laxos.
• Formar un medio adecuado para alojar a aquellas células en proliferación y diferenciación para constituir tanto los elementos figurados de la sangre, como glóbulos rojos y plaquetas, y los distintos tipos de glóbulos blancos que migran luego a los tejidos conjuntivos para realizar en ellos sus funciones específicas, como células cebadas, macrófagos, células plasmáticas, linfocitos y granulocitos (Figura 3-33c): los tejidos conjuntivos reticulares.
• Almacenar grasas, para su uso posterior como fuente de energía, ya sea por ellos mismos o para otros tejidos del organismo (Figura 3-33d): los tejidos adiposos.
• Formar láminas con una gran resistencia a la tracción, tal como ocurre en la dermis de la piel y en los tendones y ligamentos (Figura 3-34a): los tejidos conjuntivos fibrosos densos.
• Crear placas o láminas relativamente sólidas, caracterizadas por una gran resistencia a la compresión (Figura 3-34b): los tejidos cartilaginosos.
• Establecer el principal tejido de soporte del organismo, caracterizado por su gran resistencia tanto a la tracción como a la compresión (Figura 3-34c): los tejidos óseos.
Células conectivas
Las células que están presentes en los tejidos conectivos y corresponden a dos grupos distintos:
• Células propias de cada tipo de tejido, que constituyen una población celular estable, responsable de la formación y mantención del tejido al que pertenecen, razón por la cual se las llama células de sostén (Figura 3-35a).
• Células conectivas libres, que llegan a residir en los tejidos conectivos. Estas células se forman en los órganos hematopoyéticos, circulan como glóbulos blancos en la sangre, y migran a un tejido conectivo en particular, estableciéndose en él (Figura 3-35b).
Células propias de los tejidos conectivos
Estas células, llamadas estables o de sostén, corresponden a células diferenciadas cuyo principal rol es producir la matriz intercelular propia de cada tipo de tejido. Se originan a partir de las células mesenquimáticas que están ubicadas en el sitio del organismo en que formarán el tejido conectivo (Figuras 3-36a y b). Ellas se caracterizan por encontrarse en proceso de diferenciación para sintetizar a la matriz extracelular que caracteriza al tipo de tejido conectivo que corresponda. Poseen un retículo endoplásmico rugoso bien desarrollado, un aparato de Golgi definido y escasas vesículas de secreción, organelos que se relacionan con la síntesis de moléculas precursoras del colágeno, elastina, proteoglicanos y glicoproteínas de la matriz extracelular.
Fibroblastos
Forman los tejidos conectivos fibrosos cuya matriz extracelular está constituida por fibras colágenas y fibras elásticas, asociadas a glicosaminoglicanos, proteoglicanos y glicoproteínas (Figuras 3-37a, b y c).
Condroblastos
Producen el tejido cartilaginoso, cuya matriz extracelular se caracteriza por la presencia de una cantidad importante de proteoglicanos asociados a ácido hialurónico y a microfibrillas de colágeno tipo II. Al quedar totalmente rodeados por la matriz cartilaginosa, ellos pasan a llamarse condrocitos (Figura 3-38a).
Osteoblastos
Producen el tejido óseo, sintetizando el componente orgánico de la matriz extracelular ósea que se caracteriza por un alto contenido en colágeno tipo I, glicosaminoglicanos y glicoproteínas. Al quedar totalmente rodeados por la matriz ósea, pasan a llamarse osteocitos (Figura 3-38b).
Lipoblastos
Producen el tejido adiposo. Ellos se diferencian para formar los adipocitos o células adiposas y se rodean de una lámina basal.
Células conectivas libres
Estas células se originan en la médula ósea hematopoyética y usan la circulación sanguínea como un medio de transporte hacia los tejidos conectivos, donde realizan sus principales funciones. Entre ellas se encuentran las células cebadas (o mastocitos) y los macrófagos (o histiocitos), que son componentes estables del tejido conectivo al que llegan (Figura 3-39a).
Un grupo distinto lo forman las células plasmáticas, los linfocitos y los granulocitos polimorfonucleares, todos ellos células de vida media relativamente corta y que tienden a concentrarse en las zonas de tejido conectivo en que ocurren reacciones relacionadas con la defensa (Figura 3-39b).
Células cebadas
Son células grandes, de forma redondeada (20-30 um), y al microscopio de luz, se caracterizan por presentar el citoplasma lleno de gránulos basófilos que se tiñen metacromáticamente con azul de toluidina. Su núcleo es esférico y está situado en el centro de la célula (Figuras 3-40a y b). Ellas se ubican de preferencia vecinas a los vasos sanguíneos.
Los gránulos contienen heparina, proteoglicano sulfatado de 750 kD, que forma la matriz de los gránulos. A ella se asocian varias moléculas de bajo peso molecular como histamina, proteasas neutras y factores quimiotácticos para eosinófilos y para neutrófilos.
Su superficie muestra prolongaciones finas y su citoplasma contiene pocos organelos. En la membrana de las células cebadas se ubican receptores para el fragmento Fc de las IgE (Figura 3-40b), anticuerpos secretados por las células plasmáticas. Cuando la IgE, anclada en su receptor, se une a su antígeno se produce una señal hacia el citoplasma de la célula cebada que estimula la síntesis de leucotrieno y su liberación hacia el extracelular, y estimula el proceso de exocitosis de los gránulos. Se origina así una reacción de hipersensibilidad inmediata a escasos minutos de haber penetrado el antígeno (alérgeno), la que se manifiesta en fenómenos como edema, rinitis alérgica, asma y shock anafiláctico.
La principal función de las células cebadas es almacenar los mediadores químicos de la respuesta inflamatoria. Comparten así muchas características con los leucocitos basófilos de la sangre, pero son otra familia celular.
Macrófagos
Los macrófagos de los tejidos conjuntivos miden entre 10 y 30 um de diámetro y su estructura se modifica según su estado de actividad. Son células mononucleadas que se caracterizan por su capacidad de fagocitar y degradar material particulado. Se originan a partir de las células de la médula ósea que dan origen a los monocitos de la sangre, los que luego migran desde el lumen de los capilares sanguíneos al tejido conjuntivo donde terminan su diferenciación.
Su superficie presenta numerosas prolongaciones digitiformes, su núcleo es indentado y en su citoplasma presenta numerosas vacuolas endocíticas, lisosomas primarios y fagolisosomas. Tienen un retículo endoplásmico rugoso desarrollado y su aparato de Golgi es prominente. Poseen, además, microtúbulos, filamentos intermedios y microfilamentos de actina. Los macrófagos activados tienen más prolongaciones de membrana, un mayor número de vacuolas, lisosomas, fagosomas y cuerpos residuales. Estas células se reconocen fácilmente cuando han fagocitado partículas visibles al microscopio (Figuras 3-39a y 3-41a y b).
En respuesta a ciertos procesos infecciosos, los macrófagos se pueden fusionar originando células de 20 o más núcleos, llamadas células gigantes multinucleadas. Bajo estímulos adecuados también modifican su aspecto, rodeando materiales extraños y formando las células epitelioides de cuerpo extraño.
Entre sus funciones destacan:
• Su capacidad fagocítica les permite cumplir un rol importante en la eliminación de microorganismos, tejidos dañados y contaminantes particulados y corresponden al sistema de fagocitos mononucleares.
• Participan como células presentadoras de antígenos en la respuesta inmune.
• Sintetizan y secretan diversas citoquinas y su participación en la respuesta inmune.
Células plasmáticas
Ellas se originan en los tejidos linfáticos por diferenciación de linfocitos B activados y llegan a los tejidos conjuntivos por la circulación sanguínea. En los tejidos conjuntivos su vida media es de 10 a 20 días. Su función es sintetizar y secretar los anticuerpos, moléculas que pertenecen a una familia de proteínas llamadas inmunoglobulinas.
Estas células tienen de 10 a 20 um de diámetro, su forma es ovalada, con un citoplasma muy basófilo. El núcleo, redondo y excéntrico, se caracteriza porque la heterocromatina se dispone como ruedas de carreta. Su citoplasma se caracteriza por un gran desarrollo del retículo endoplásmico rugoso, responsable de la basofilia de su citoplasma, y por un aparato de Golgi muy desarrollado (Figura 3-42a). Los anticuerpos que sintetizan se pueden localizar tanto en el espacio perinuclear como en las cisternas del retículo endoplásmico rugoso del aparato de Golgi. Normalmente no se observan gránulos de secreción almacenados en el citoplasma de estas células (Figura 3-42b).
Linfocitos
Son leucocitos que juegan un rol fundamental en la respuesta inmune. La mayoría de los linfocitos circulantes son linfocitos pequeños. Mediante marcadores citoquímicos, es posible distinguir tres tipos de linfocitos: linfocitos B, linfocitos T y linfocitos NK.
Los linfocitos de los tejidos conectivos corresponden a linfocitos pequeños, de 6 a 8 um de diámetro. Poseen un núcleo ovoide, con cromatina muy condensada, y una pequeña cantidad de citoplasma suavemente basófilo (Figura 3-43a). Al microscopio electrónico de transmisión muestran una superficie irregular debido a la presencia de numerosas proyecciones citoplasmáticas. El citoplasma contiene escasas mitocondrias, ribosomas libres, escasas cisternas de ergastoplasma y un Golgi pequeño (Figura 3-43b).
Según el tipo de linfocito, su vida media puede variar entre unos pocos días hasta meses y años. Su duración como células libres del tejido conjuntivo es en general de pocos días. Cumplen un rol fundamental en la respuesta inmune, ya que las relaciones complejas entre linfocitos B, linfocitos T y células presentadoras de antígeno generan las respuestas de defensa inmune humoral y celular.
Granulocitos
Corresponden a leucocitos que presentan un núcleo lobulado (polimorfonucleares) y contienen en su citoplasma gránulos específicos (Figura 3-44a).
Los más abundantes son los granulocitos neutrófilos, que tienen una vida media en los tejidos conjuntivos de 1 a 4 días. Son células de 12 a 15 um de diámetro, cuyo núcleo está formado por 2 a 5 lóbulos de cromatina condensada unidos entre sí. Poseen abundante citoplasma, pobre en organelos, que contiene dos variedades de gránulos que se tiñen poco con los colorantes usuales. Los gránulos específicos contienen fosfatasa alcalina, colagenasa, lactoferrina y proteínas básicas como lisozima y fagocitinas. Los granos azurófilos son lisosomas primarios. El citoplasma es en general pobre en otro tipo de organelos (Figuras 3-44b y c). Constituyen un mecanismo de defensa contra la invasión de microorganismos, especialmente bacterias. Fagocitan activamente partículas pequeñas, por lo que se les ha llamado fagocitos polimorfonucleares para distinguirlos de los macrófagos.
Matriz extracelular
El análisis microscópico de la estructura del material intercelular muestra (Figura 3-45a):
• fibras conjuntivas, que pueden ser colágenas, reticulares o elásticas;
• un material poco estructurado al que se denomina sustancia fundamental amorfa; y
• en los sitios en que la matriz extracelular conjuntiva se asocia a células de otros tejidos se observan las láminas basales (Figura 3-45b).
Las variaciones en la forma en que estos componentes están organizados dan origen a la dura matriz extracelular del hueso y la transparente matriz extracelular de la córnea.
El análisis de la composición del espacio extracelular demuestra que las principales clases de macromoléculas presentes son:
• Cadenas de polisacáridos de la clase de los glucosaminoglicanos, que pueden unirse covalentemente a proteínas, formando macromoléculas más complejas llamadas proteoglucanos. Estas moléculas forman el gel altamente hidratado que constituye la sustancia fundamental en la cual están embebidas las células y fibras conjuntivas.
• Proteínas que se organizan para formar estructuras bien definidas de la matriz extracelular como son las fibrillas colágenas, la lámina densa de las láminas basales, las fibras elásticas y las proteínas de adhesión que asocian entre sí a células, fibras y proteoglucanos del tejido conectivo.
Fibras conjuntivas
Estructuras formadas por fibrillas colágenas
Se caracterizan por su gran resistencia a las fuerzas de tracción. Ellas son el principal componente de:
• las fibras colágenas de los tejidos conjuntivos fibrosos;
• las fibras reticulares; y
• las laminillas colágenas de la córnea y del hueso.
Cada fibrilla colágena está constituida por moléculas de colágeno que se asocian en polímeros lineales visibles al microscopio electrónico (Figura 3-46a). Cada fibrilla puede tener una longitud mayor a 100 micrones y presentan siempre una estriación transversal característica repetida cada 67 nm que refleja la forma regularmente espaciada en que disponen las moléculas de colágeno (Figura 3-46b). El diámetro de las fibrillas varía entre 10 y 300 nm, según el tipo de colágeno de que se trate.
Las moléculas del colágeno son proteínas largas y rectas (300 x 1,5 nm), formadas por la asociación helicoidal de tres cadenas polipeptídicas, llamadas cadenas alfa (Figura 3-46c), las cuales contienen entre sus aminoácidos a glicina, prolina e hidroxiprolina y lisina.
Existen más de 25 tipos de cadenas alfa codificadas por genes diferentes, las que se asocian a unos 15 tipos distintos de moléculas de colágeno.
De hecho, las fibrillas del colágeno de tipo II, propias de la matriz extracelular del cartílago hialino, son muy delgadas (10 nm de diámetro) y están formadas por moléculas de colágeno tipo II, asociadas a moléculas de colágeno IX y XI.
Las fibras colágenas, de varios um de grosor, están formadas por la asociación de numerosos manojos de fibrillas de colágeno de tipo I, de 150 a 300 nm de diámetro (Figuras 3-47a y b), integradas por moléculas de colágeno tipo I, asociadas a moléculas de colágeno V.
Las fibras reticulares, de 0,5 a 2,0 nm de grosor (Figuras 3-47c y d), están formadas por manojos de fibrillas de colágeno tipo III, de 50 nm diámetro, integradas por moléculas de colágeno t tipo III.
Las laminillas colágenas están constituidas por capas sucesivas de fibrillas de colágeno de tipo I. En cada capa, las fibrillas se disponen paralelas entre sí, pero las capas sucesivas alternan ordenadamente la orientación de sus fibrillas en ángulos rectos. Esta disposición laminillar se observa en el estroma de la córnea y en las laminillas del hueso secundario.
Fibras elásticas
Se estiran fácilmente y recuperan su longitud original cuando la fuerza deformante ha desaparecido. Al microscopio electrónico, aparecen formadas por un material amorfo rodeado y penetrado por microfibrillas de unos 10 nm de diámetro (Figura 3-48a). El material amorfo corresponde a un material proteico muy insoluble, llamado elastina, que confiere a estas fibras su capacidad de recobrar su forma y dimensiones primitivas cuando cesa el esfuerzo que había determinado su deformación.
Se caracteriza por un alto contenido en aminoácidos apolares como prolina y valina, y tiene un alto contenido en aminoácidos no cargados como la glicina. Contiene además dos aminoácidos exclusivos: desmosina e isodesmosina (Figura 3-48b).
La elastina se crea por las interacciones entre las moléculas solubles de tropoelastina, polipéptido de unos 70.000 de PM que contiene el aminoácido lisina y carece del aminoácido desmosina. La interacción entre las lisinas de cuatro polipeptidos de tropoelastina (catalizada por la enzima lisil-oxidasa, en presencia de cobre) pueden dar origen a la desmosina y unir en puntos específicos a estas 4 moléculas. Se ha propuesto que en estado de reposo, cada hebra polipeptídica, rica en aminoácidos apolares, se encuentra plegada sobre sí misma y que al tensionar la fibra elástica, se induce su estiramiento y son obligadas a ponerse paralelas entre sí, enfrentándose al medio acuoso del extracelular, permaneciendo unidas solo a nivel de las desmosinas. Al desaparecer la fuerza deformante, cada una de estas zonas de las hebras polipeptídicas vuelven a su conformación plegada y en forma espontánea la fibra elástica recupera su longitud inicial (Figura 3-48c).
Las microfibrillas tienen como principal componente una glicoproteína llamada fibrilina, rica en aminoácidos hidrofílicos, y que contiene residuos de cistina, los cuales pueden formar puente disulfuro, estabilizando la estructura de las microfibrillas. En las fibras elásticas juegan un rol estructural, creando una especie de vaina alrededor de la elastina, permitiendo así la formación de estructuras fibrilares elásticas. En ausencia de microfibrillas, la elastina se deposita de manera menos organizada, formando láminas elásticas, como ocurre por ejemplo en la pared de las arterias.
Sustancia fundamental
Corresponde a la matriz translúcida que rodea a las células y fibras conjuntivas, y que no presenta una organización estructural visible al microscopio de luz (Figura 3-49a). Este componente constituye un gel semisólido, bioquímicamente complejo y altamente hidratado. Las principales macromoléculas que componen la sustancia fundamental corresponden a polisacáridos de la clase de los glucosaminoglicanos, que pueden existir como tales o pueden unirse covalentemente a proteínas, formando macromoléculas más complejas llamadas proteoglucanos.
Glucosaminoglicanos
Los glucosaminoglicanos son largas cadenas de polisacáridos no ramificadas formadas por la repetición sucesiva de la unidad de disacáridos, compuesta por ácido glucourónico y hexosamina acetilada, la cual puede estar sulfatada.
El ácido hialurónico es un glucosaminoglicano no sulfatado formado por una cadena muy larga de unidades sucesivas de ácido D-glucourónico + N-acetil-glucosamina (Figura 3-49b).
Por su riqueza en grupos ácidos está cargado negativamente y tiende a atraer cationes como el Na+ que, al ser osmóticamente activo, captan agua, disponiéndose cada molécula de hialuronato como un ovillo laxamente plegado y altamente hidratado, que ocupa un volumen importante del espacio intercelular.
Los glicosaminoglicanos sulfatados están generalmente asociados a proteínas, formando proteoglicanos (Figura 3-50a). Los principales de ellos son:
• Condroitín sulfato: Se forma con una secuencia de 70 a 200 unidades sucesivas de (N-acetil-galactosamina sulfatada y ácido glucourónico).
• Dermatan sulfato: Se compone de una secuencia de 70 a 200 unidades sucesivas de (N-acetil-galactosamina sulfatada y ácido L-iourónico).
• Heparán sulfato: Se constituye por una secuencia de 20 a 100 unidades sucesivas de (N-acetil-glucosamina sulfatada y ácido glucourónico o L-idurónico sulfatado.
• Keratan sulfato: Se conforma por la secuencia de un número variable de unidades de (D-galactosa y N-acetil glucosamina sulfatada).
Proteoglucanos
Los proteoglucanos son macromoléculas formadas por una proteína central, a lo largo de la cual se asocian, por su extremo terminal, numerosas moléculas de glucosaminoglicanos sulfatados. Existe una enorme variedad de proteoglucanos, dependiendo del tipo y largo de la proteína central, y del tipo, número y longitud de los glucosaminoglicanos asociados a ella.
El proteoglicano decorina, que recubre la superficie de las fibrillas colágenas, contiene una molécula ya sea de condroitin o de dermatan sulfato (Figura 3-50b), mientras que el proteoglucano aggrecan, que es uno de los principales componentes de la matriz extracelular del cartílago, presenta alrededor de 100 moléculas de condroitin sulfato y 30 moléculas de keratan sulfato, unidas a una proteína central de más de tres mil aminoácidos.
Existe además la posibilidad de que la sustancia fundamental se organice en agregados moleculares aún mayores, ya que los proteoglicanos pueden asociarse por uno de sus extremos a la molécula de proteína central a lo largo del ácido hialurónico, por medio de proteínas globulares de unión (Figura 3-50c).
De esta manera se logra la posibilidad de estabilizar la estructura de la sustancia fundamental, la cual podrá adoptar la consistencia de un gel prácticamente sólido como en el caso del cartílago hialino o un gel relativamente fluido como es el caso de los tejidos conjuntivos laxos.
La mayoría de las funciones estructurales de los proteoglucanos se relacionan con sus características moleculares, las que le permiten interactuar con cationes y agua, tendiendo a inmovilizarlos y resistiendo muy bien las fuerzas de compresión. El líquido que los rodea constituye el líquido tisular y través de él fluyen los metabolitos y difunden los gases respiratorios.
Glucoproteínas de adhesión
Las glucoproteínas de adhesión de la matriz extracelular se caracterizan por ser moléculas que presentan diversos dominios que les permiten interactuar simultáneamente tanto con componentes de la matriz extracelular como con las células conjuntivas.
En esta parte nos referiremos como ejemplo solo a dos de ellas: la fibronectina (Figura 3-51a), que asocian entre sí a células, fibras y proteoglicanos del tejido conjuntivo, y la laminina (Figura 3-51b), que asocia a células no conjuntivas con las macromoléculas de la lámina basal.
Láminas basales
Son estructuras laminares que corresponden a una forma especializada de la matriz extracelular, que actúan como interfase entre las células de los tejidos epiteliales, musculares y nerviosos en los sitios en que ellas se asocian al tejido conjuntivo.
Al microscopio electrónico aparece formada por dos capas laminares: la que está vecina a la célula es poco densa a los electrones y se denomina lámina rara (o lúcida); la segunda capa es densa a los electrones y se denomina lámina densa; a ella se asocia una tercera capa, que contiene fibrillas colágenas llamada lámina fibrorreticular y que es continua con la matriz conjuntiva adyacente (Figura 3-52a).
Entre las funciones que desempeña la lámina basal se destacará que ella constituye una interfase, de modo que las células poseen mecanismos de adhesión para fijarse a la membrana basal y ella a su vez está anclada en la matriz extracelular conjuntiva gracias a las fibrillas colágenas.
Las membranas basales están formadas por moléculas de:
• colágeno tipo IV, cuyas moléculas polimerizan formando la lámina densa;
• perlecan, que es un proteoglucano de heparansulfato, formado por una proteína central de unos 600.000 de PM, asociada a entre 2 y 15 cadenas de heparansulfato, el cual puede interactuar directamente con colágeno IV y con lámina (proteoglicano de heparansulfato);
• laminina, que es una glucoproteína de gran tamaño (850.000) que presenta dominios funcionales que le permiten interactuar tanto con receptores de la membrana plasmática de la célula como con heparansulfato, colágeno IV y entactina;
• entactina, que es una glucoproteína pequeña (150kD), con afinidad por laminina y la red de colágeno IV.
• colágeno VII, que forma fibrillas de anclaje: las fibrillas de colágeno III de la lámina fibrorreticular (Figura 3-52b).
Fibroblastos y síntesis de la matriz extracelular
Es la célula propia de los tejidos conjuntivos fibrosos, cuya principal función es sintetizar y mantener a la matriz extracelular propia del tejido.
De acuerdo a su actividad biosintética se pueden distinguir morfológicamente a los fibroblastos, que corresponden a la célula en un estado de alta actividad (Figuras 3-53a y b), de los fibrocitos, que son las células poco activas.
La organización ultraestructural de los fibroblastos refleja el compromiso de este tipo de células en la síntesis de moléculas que forman la matriz extracelular. Poseen un retículo endoplásmico desarrollado, un Golgi perfectamente definido y escasas vesículas de secreción, organelos que se relacionan con la síntesis de moléculas precursoras del colágeno, elastina, proteoglicanos y glicoproteínas de la matriz extracelular (Figuras 3-53a y c).
Presentan un desarrollado citoesqueleto de microtúbulos y de microfilamentos de actina implicados en procesos de motilidad celular. Esta propiedad es importante en la cicatrización de heridas, ya que los fibroblastos tienen la capacidad de migrar hacia la zona lesionada, proliferar y producir los componentes de la matriz extracelular.
En los tejidos conjuntivos fibrosos reticulares las células propias del tejido, responsable de la síntesis y mantención del estroma reticular, reciben el nombre de células reticulares. Este nombre suele inducir a confusión, ya que inicialmente se usó para denominar a las células asociadas al estroma reticular. Actualmente se distingue la célula reticular propiamente tal de otras células que pueden asociarse al estroma como, por ejemplo, los macrófagos fijos. La estructura de las células reticulares es similar a la de los fibroblastos.
Fibroblastos y síntesis de microfibrillas colágenas
Los fibroblastos sintetizan y secretan el procolágeno, molécula que presenta en ambos extremos una porción globosa no helicoidal. Los pasos intracelulares (Figura 3-54a) en el proceso de síntesis de esta molécula implican las siguientes etapas:
• síntesis en los ribosomas del retículo endoplásmico rugoso de cada cadena pro-alfa;
• en el lumen del ergastoplasma ocurre la hidroxilación de prolinas y lisinas, y posteriormente las hidroxilisinas son glicosiladas;
• luego las tres cadenas pro-alfa que correspondan se asocian y forman las moléculas de procolágeno: cuya estructura helicoidal es estabilizadas por puentes de hidrógeno y cuyos extremos son más globosos y contienen enlaces disulfuro;
• estas moléculas se acumulan en el aparato de Golgi y son transportadas en gránulos de secreción hacia la superficie celular, liberándose por exocitosis hacia el espacio extracelular, que ocupa profundas invaginaciones en la superficie de los fibroblastos extracelular.
Los pasos extracelulares que permiten la formación de las fibrillas colágenas son:
• remoción de los extremos globosos de las moléculas de procolágeno por acción las procolágeno-peptidasas, quedando la molécula de colágeno, de menor peso molecular (Figura 3-54b);
• las moléculas de colágeno se asocian entre sí por interacciones entre las caras laterales de moléculas vecinas, que se disponen paralelas entre sí, pero desplazadas en un quinto de su longitud. Esta interacción lateral se estabiliza por la formación de enlaces covalentes entre las moléculas vecinas. La resistencia a la tracción de las fibrillas colágenas depende del número de enlaces covalentes que existan entre las moléculas paralelas de colágeno (Figura 3-54c);
• al polimerizar las moléculas de colágeno quedan espacios a lo largo de la fibrilla en formación, entre los extremos carboxi- y amino-terminales de las sucesivas moléculas de colágeno. Al observar las fibrillas al microscopio electrónico, luego de usar tinción negativa (paso 11), se observa la penetración del colorante en los sitios huecos de la fibrilla, que aparecen como un bandeo denso a los electrones (negro), mientras que los sitios de total superposición de las moléculas adyacentes aparecen como un bandeo poco denso a los electrones (blanco) (Figura 3-54d). Estas fibrillas se agrupan en manojos, formando las fibras colágenas (Figura 3-54e).
Variedades de tejidos conjuntivos
Tejido conjuntivo laxo
Se caracteriza por presentar una matriz extracelular formada por fibras colágenas y elásticas, laxamente dispuestas en una sustancia fundamental bastante fluida (Figuras 3-55a y b) y una población relativamente alta de células, ya sean propias como fibroblastos y adipocitos o migratorias como macrófagos y células cebadas (Figura 3-55c).
Las fibras colágenas que predominan están formadas por microfibrillas de colágeno I asociadas a cantidades variables de microfibrillas de colágeno III, pero en menor cantidad y le confieren resistencia a la tracción.
Las fibras elásticas, aunque menos abundantes que las de colágeno, cumplen un rol importante, ya que le otorgan al tejido la capacidad de retomar su organización original luego de ser traccionado.
La sustancia fundamental, que ocupa los espacios entre las fibras, tiene como principal componente a grandes moléculas de ácido hialurónico, el cual estabiliza una importante cantidad de agua, adoptando la estructura de un gel poco consistente, de modo que existen innumerables espacios intermoleculares que sirven de reservorio al líquido intersticial (“fluido tisular”). Este fluido facilita la difusión del oxígeno y nutrientes desde los capilares del conjuntivo hacia las células de otros tejidos (epitelios, cartílago o músculo) y de los productos de desecho del metabolismo en sentido inverso. La capacidad de la sustancia fundamental de acumular líquido es la base del proceso llamado edema. Debido a la variedad de células que lo habitan y a la capacidad de acumular líquido proveniente del plasma sanguíneo, el conjuntivo laxo juega un rol muy importante en la iniciación del proceso de defensa orgánica a través de la generación de las respuestas inflamatoria e inmune.
Tejido conjuntivo reticular
Es una variedad de tejido conjuntivo especializado que forma una malla tridimensional estable, que otorga un soporte estructural a las células migratorias de órganos relacionados directamente con los leucocitos de la sangre como son el bazo (Figura 3-56a), los linfonodos (Figura 3-56b) y la médula ósea hematopoyética.
Las células reticulares, que corresponden a fibroblastos especializados, secretan las fibrillas de colágeno III, las que se asocian en manojos formando las fibras reticulares (Figuras 3-56c). Estas se disponen formando una malla fibrilar fina a lo largo de la cual se ubican las células reticulares, cuyos procesos envuelven las fibras reticulares y a la escasa sustancia fundamental asociada a ellas. En los espacios entre los elementos de esta trama reticular pueden desplazarse células y fluidos.
Tejido conjuntivo fibroso denso
Presenta un contenido relativamente bajo de células que corresponden principalmente a fibroblastos. Su matriz extracelular es muy abundante y su principal componente son gruesas fibras colágenas. La sustancia fundamental es relativamente escasa, y en ella predominan proteoglucanos de dermatan-sulfato.
De acuerdo a la forma en que se disponen las fibras de colágeno, se distingue:
Tejido conjuntivo denso desordenado
Se le encuentra, por ejemplo, en la dermis (Figura 3-57a) y formando la cápsula de órganos como los linfonodos y el hígado.
Las fibras colágenas forman una red tridimensional, lo que le otorga resistencia en todas las direcciones. Asociada a esta red colágena, existen fibras elásticas. Entre las fibras colágenas y elásticas, se ubican los fibroblastos (Figuras 3-57b y c).
Tejido conjuntivo denso ordenado o regular
El tejido conjuntivo denso ordenado está adaptado para oponer una alta resistencia a la tracción ejercida en la dirección en que se disponen las fibras. Tal es el caso de tendones (Figura 3-58a) y aponeurosis.
Las fibras de colágeno se disponen en un patrón que refleja una respuesta a la dirección del requerimiento mecánico predominante. Las fibrillas de colágeno tipo I paralelas se asocian entre sí por interacción con moléculas de colágeno tipo XII, lo que le otorga una mayor firmeza. Los fibroblastos se ubican entre los haces de fibras formando líneas paralelas. Estas células presentan núcleos alargados y de cromatina condensada con un cuerpo celular alargado, cuyo citoplasma se dispone en delgadas láminas que abrazan los manojos de fibrillas colágenas (Figuras 3-58b y c).
Tejido conjuntivo elástico
Es una variedad de tejido fibroso denso en el cual las fibras conjuntivas presentes corresponden a fibras o láminas elásticas dispuestas en forma paralela. Los espacios entre las fibras elásticas están ocupados por una fina red de fibrillas colágenas, con unos pocos fibroblastos (Figura 3-59a).
El tejido conjuntivo elástico forma capas en la pared de los órganos huecos sobre cuyas paredes actúan presiones desde adentro, como es el caso de los pulmones y de los vasos sanguíneos, y forma algunos ligamentos como los ligamentos amarillos de la columna vertebral (Figura 3-59b) y la membrana cuadrangular y el cono elástico en los pligues vocales.
Tejido adiposo
Es un tejido en el que predominan las células conjuntivas llamadas adipocitos, las que se originaron por diferenciación de células llamadas lipoblastos. Es uno de los tejidos más abundantes y representa alrededor del 15% al 20% del peso corporal del hombre y del 20% al 25% del peso corporal en mujeres. Los adipocitos almacenan energía en forma de triglicéridos. Debido a la baja densidad de estas moléculas y su alto valor calórico, el tejido adiposo es muy eficiente en la función de almacenaje de energía. Los adipocitos diferenciados pierden la capacidad de dividirse; sin embargo, son células de una vida media muy larga y con capacidad de aumentar la cantidad de lípidos acumulados. Además, el tejido adiposo posnatal contiene adipocitos inmaduros y precursores de adipocitos residuales a partir de los cuales pueden diferenciarse adipocitos adicionales.
Tejido adiposo unilocular
Corresponde a la variedad de tejido adiposo más corriente en adultos (Figuras 3-60a y b). Sus células son polihédricas, miden entre 50 y 150 um de diámetro y contienen una sola gota de lípido que llena todo el citoplasma, desplazando los organelos hacia la periferia.
Al microscopio de luz, cada célula aparece como un pequeño anillo de citoplasma rodeando una vacuola, resultado de la disolución de la gota lipídica, y que contiene un núcleo excéntrico y aplanado. Al microscopio electrónico revela que cada célula adiposa contiene solo una gota de lípido. En el citoplasma perinuclear se ubican un Golgi pequeño, escasas mitocondrias de forma ovalada, cisternas de retículo endoplasmático rugoso (RER), poco desarrolladas, y ribosomas libres. En el citoplasma, que rodea la gota de lípido, contiene vesículas de retículo endoplasmático liso (REL), algunos microtúbulos y numerosas vesículas de pinocitosis. Cada célula está rodeada por su lámina basal y por una red de fibras reticulares. Los capilares sanguíneos se ubican vecinos a la lámina basal.
Tejido adiposo multilocular
Esta variedad de tejido adiposo es de distribución restringida en el adulto. Sus células son poligonales y más pequeñas que las del tejido adiposo unilocular. Su citoplasma contiene gotas de lípido de diferente tamaño y separadas por cuantiosas mitocondrias, ricas en abundantes crestas. Su núcleo es esférico y se ubica en el centro de cada célula. Este tejido adiposo se asocia con numerosos capilares sanguíneos y se conoce también como grasa parda. En embriones humanos y en el recién nacido, este tipo de tejido adiposo se concentra en la región interescapular y su función es generar calor al metabolizar los lípidos que acumula.
Tejido cartilaginoso
El tejido cartilaginoso se origina en el mesénquima, a partir de células que se redondean y agrupan en conglomerados con escaso material intercelular entre ellas. Este conjunto de células precartilaginosas se llama blastema.
Las células del blastema son inducidas a sintetizar matriz cartilaginosa y a partir de ese momento se les llama condroblastos. Ellas se separan progresivamente a medida que aumenta la cantidad de matriz sintetizada y pasan a llamarse condrocitos. El tejido mesenquimático que rodea a la masa condrogénica pasará a constituir el pericondrio. El tejido cartilaginoso está formado por una abundante matriz extracelular en la cual los condrocitos se ubican en espacios llamados lagunas (Figura 3-61a).
Los condrocitos sintetizan y secretan los componentes orgánicos de la matriz extracelular, que son básicamente colágeno, ácido hialurónico, proteoglucanos y glucoproteínas, y según las características de la matriz, se distingue el cartílago hialino, elástico y fibroso.
Los vasos sanguíneos no penetran a la matriz cartilaginosa y los condrocitos se nutren con material que difunde desde los capilares sanguíneos del tejido conjuntivo adyacente. Cada placa o lámina de tejido cartilaginoso está rodeada por el pericondrio, que corresponde a tejido conectivo denso en el que se distingue una capa externa fibrosa y una capa interna celular, en la cual se ubican las células condroprogenitoras, que pueden dar origen a los condroblastos (Figura 3-61b). Los condroblastos presentan un ergastoplasma y un aparato de Golgi muy desarrollados y poseen vesículas y granos de secreción, lo que guarda relación con su rol de sintetizar y secretar los distintos componentes de la matriz extracelular cartilaginosa, la que está formada principalmente por colágeno de tipo II, proteoglucanos de condroitin y keratan-sulfato, ácido hialurónico y glucoproteínas.
Al reducir su actividad de síntesis, disminuye tanto del ergastoplasma como del aparato de Golgi, acumulan glicógeno y lípidos en su citoplasma, y se les llama condrocitos cuando ellos aparecen rodeados por una matriz pericapsular muy basófila (Figura 3-61c).
Crecimiento del cartílago
Las placas de tejido cartilaginoso pueden crecer mediante dos mecanismos:
1. Crecimiento por aposición. Ocurre desde el pericondrio, cuya capa celular contiene células capaces de dividirse dando origen a células que se diferenciarán a condroblastos los que depositan matriz cartilaginosa sobre la superficie del cartílago preexistente; los condroblastos atrapados en la matriz que producen y pasando a ser condrocitos (Figuras 3-62a y b).
2. Crecimiento intersticial. Ocurre porque los condrocitos son capaces de dividirse y la matriz cartilaginosa es distensible. Las células hijas ocupan la misma laguna, pero a medida que ellas secretan nueva matriz intercelular se van separando. Estas células hijas pueden volver a dividirse formándose los llamados grupos isógenos, que se encuentran frecuentemente en cartílagos en crecimiento (Figuras 3-62c y d).
Tipos de cartílago
De acuerdo a las características de su material intercelular, se distinguen tres tipos de tejidos cartilaginosos:
• Cartílago hialino
• Cartílago elástico
• Cartílago fibroso o fibrocartílago
Características del cartílago hialino. El colágeno corresponde al 40% de los componentes orgánicos de la matriz cartilaginosa. Está organizado como fibrillas de colágeno II, que se disponen como un red laxa en toda la matriz del cartílago hialino. A lo largo de las fibrillas de colágeno II, se asocian moléculas de colágeno IX, de modo que uno de los extremos de cada molécula se proyecta hacia la matriz extracelular circundante (Figura 3-63a).
Los principales glucosaminoglicanos son el ácido hialurónico y proteoglucanos de condroitin y queratan-sulfato. En la matriz cartilaginosa el ácido hialurónico se asocia a entre 80 y 200 unidades de proteoglicanos, por medio de proteínas de enlace (Figura 3-63b). Los enormes conglomerados de hialuronato están unidos a las fibrillas colágenas por enlaces electrostáticos y puentes cruzados glucoproteicos.
Más del 60% del peso neto del cartílago hialino corresponde a agua, gran parte de la cual interactúa con los glucosaminoglicanos, encontrándose parcialmente fijada; sin embargo, existen zonas en que la interacción es lo suficientemente laxa como para permitir el flujo de solutos por la matriz cartilaginosa. La gran hidratación y la posibilidad de movimiento de agua son los dos factores que permiten al cartílago su capacidad para soportar la compresión y su recuperación ante la aplicación de cargas variables, como ocurre en los cartílagos articulares.
Los proteoglucanos se concentran en la cápsula o matriz territorial que rodea a cada laguna y de hecho los grupos isógenos están en conjunto rodeados de una zona rica en proteoglicanos, en la cual son escasas la fibrillas de colágeno II (Figuras 3-63c y d) a diferencia de lo que ocurre en la matriz localizada entre las células cartilaginosas denominada matriz interterritorial.
La adhesión entre los condrocitos y la matriz que los rodea es estabilizada por la condronectina, glucoproteína que se asocia a receptores en la membrana plasmática de las células y a los componentes de la matriz territorial.
El cartílago hialino forma el esqueleto provisional durante el desarrollo (Figura 3-64a) y las placas epifisiarias durante el crecimiento de los huesos, además de revestir las superficies óseas en las articulaciones (Figura 3-64b). Forma parte de la pared en las grandes vías respiratorias (Figura 3-64c).
Cartílago elástico. Se le encuentra en el pabellón auricular y en la pared de la laringe. Su estructura es parecida a la del cartílago hialino rodeado de una capa de pericondrio y los condrocitos rodeados de la matriz intercelular, pero su matriz interterritorial contiene fibras elásticas (Figura 3-65a), las cuales se concentran en la matriz interterritorial.
Cartílago fibroso o fibrocartílago. Contiene condrocitos, generalmente encapsulados en una matriz territorial parecida a la del cartílago hialino, pero la matriz interterritorial es penetrada por manojos de fibrillas de colágeno I, que son continuas, con fibras colágenas que penetran al tejido cartilaginoso (Figura 3-65b).
Tejido óseo
En relación al tejido óseo se revisarán los siguientes aspectos:
• Estructura y características del tejido óseo
• Organización histológica del hueso esponjoso y del hueso compacto
• Histogénesis del tejido y la formación de los huesos
Estructura y características del tejido óseo
El tejido óseo es una variedad de tejido conjuntivo que se caracteriza por su rigidez y su gran resistencia tanto a la tracción como a la compresión. Está formado por la matriz ósea, que es un material intercelular calcificado (Figura 3-66a), y por células, que pueden corresponder a:
• Osteoblastos: Encargados de sintetizar y secretar la parte orgánica de la matriz ósea durante su formación (Figura 3-66b). Se ubican siempre en la superficie del tejido óseo, ya que este solo puede crecer por aposición.
• Osteocitos: Responsables de la mantención de la matriz ósea, que se ubican en cavidades o lagunas rodeadas por el material intercelular calcificado. La nutrición de los osteocitos depende de los canalículos que penetran la matriz ósea y conectan a los osteocitos vecinos entre sí y con canales vasculares que penetran al hueso (Figura 3-66c) o que se ubican en el tejido conjuntivo que revisten la superficie del hueso (periostio y endostio). De hecho, ningún osteocito se encuentra a más de una fracción de milímetros de un capilar sanguíneo.
• Osteoclastos: Células responsables de la reabsorción del tejido óseo, que participan en los procesos de remodelación de los huesos y pueden encontrarse en las depresiones superficiales de la matriz ósea llamadas lagunas de Howship (Figura 3-66d).
Matriz intercelular ósea
La matriz intercelular ósea está formada por los siguientes componentes:
• Matriz orgánica u osteoide: Corresponde al 50% del peso seco del hueso (Figura 3-67a). Más del 90% de ella corresponde a fibrillas de colágeno I, que son organizadas en laminillas de unos 5 um de grosor (Figura 3-67b). En cada laminilla ósea, las fibrillas colágenas se sitúan paralelas entre sí, pero las laminillas sucesivas alternan ordenadamente la orientación de sus fibrillas en ángulos rectos. Esta disposición alternada de las fibrillas colágenas en laminillas sucesivas destaca especialmente al observar cortes de hueso con microscopía de luz polarizada (Figura 3-67c).
El resto de los componentes orgánicos son principalmente glucoproteínas como la osteonectina, proteínas ricas en ácido gamma-carboxiglutámico, como la osteocalcina, y proteoglucanos de condroitín y queratansulfato. Son moléculas ricas en grupos ácidos, con gran tendencia a asociarse entre sí, capaces de unirse a calcio y que juegan un rol importante en el proceso de mineralización de la matriz ósea.
• Sales minerales inorgánicas: Depositadas en el osteoide, confieren al tejido su rigidez y dureza, y actúan como una reserva de sales minerales, sensible a estímulos endocrinos. Las más abundantes son fosfato de calcio amorfo y cristales de hidróxidos de calcio y de fosfato llamados hidroxiapatita (Ca10 (PO4)6(OH)2). Los cristales de hidroxiapatita son aplanados (30 nm por 3 nm) y se depositan a lo largo de las fibrillas colágenas, a intervalos de unos 67 nm (Figura 3-67d). La superficie del cristal está hidratada y existe una vaina de agua con iones rodeándolo, lo que facilita el intercambio de iones entre el cristal y el líquido intersticial.
Células del tejido óseo
Las células propias del tejido óseo son: osteoprogenitoras, osteoblastos y osteocitos. A ellas se deben agregar los osteoclastos, cuyos precursores se forman en la médula ósea hematopoyética.
Células osteoprogenitoras
Son células alargadas, con citoplasma poco prominente, que se originan de las células mesenquimáticas primitivas y forman una población de células troncales capaces de dividirse y dar origen a células que se diferencian a osteoblastos (Figuras 3-68a y b).
Osteoblastos
Son células diferenciadas globosas que sintetizan el colágeno y la sustancia fundamental ósea. Cuando están en plena actividad (Figura c68), su abundante citoplasma contiene un ergastoplasma muy desarrollado; además, tienen un prominente aparato de Golgi. Son células polarizadas que vacían sus productos de secreción por la zona del citoplasma en contacto con la matriz ósea ya formada (osteoide). Ellas presentan prolongaciones citoplasmáticas que son rodeadas por el osteoide producido y que se asocian a prolongaciones similares de los osteoblastos vecinos mediante uniones de comunicación (Figura 3-68c).
Los osteoblastos participan también en el proceso de mineralización de la matriz orgánica, ya que producen vesículas de matriz, de unos 100 nm de diámetro, rodeadas de membrana celular, las que acumulan Ca++ y PO4= y son ricas además en fosfatasa alcalina y pirofosfatasa, enzimas que son capaces de generar iones PO4=, elevando su concentración en el medio extracelular y creando centros de nucleación para el depósito de las sales minerales.
Los osteoblastos tienen dos destinos posibles: ser rodeados por la matriz ósea que producen y pasan a ser osteocitos, y permanecer en la superficie del tejido óseo recién formado, aplanándose y constituyendo las células del revestimiento óseo.
Osteocitos
Son las células propias del tejido óseo formado. Su citoplasma presenta ergastoplasma, aparato de Golgi y puede presentar lisosomas. Son capaces de sintetizar y de reabsorber, en forma limitada, a componentes de la matriz ósea (“osteolisis osteocítica”), procesos que tienen importancia en la regulación de la calcemia.
Cada osteocito, bañado por una delgada capa de líquido tisular, ocupa su laguna (Figura 3-69a) y proyecta sus prolongaciones citoplasmáticas por los canalículos (Figuras 3-69b y c), dentro de los cuales toma contacto con prolongaciones de osteocitos vecinos mediante uniones de comunicación, o con células de revestimiento óseo bañadas por el líquido tisular del tejido conjuntivo que rodea a los capilares sanguíneos.
Células de revestimiento óseo
Son células aplanadas que revisten las superficie óseas del interior de los huesos, y en su mayor parte corresponden a osteoblastos inactivos (Figura 3-70a) que están asociados entre sí y con prolongaciones de los osteocitos.
Osteoclastos
Son células móviles, gigantes y multinucleadas, y se localizan adosadas a la superficie de tejido óseo que debe ser removido (Figura 3-70b). Se originan por fusión de monocitos que han abandonado la sangre circulante y pertenecen de hecho al sistema de fagocitos mononucleares.
Contienen numerosos lisosomas y en la superficie del osteoclasto, que está en contacto con la matriz a remover, se distinguen dos zonas distintas (Figura 3-70c):
1. un anillo externo que delimita el área que se va a reabsorber y que es una unión de adhesión en la cual la membrana plasmática asocia la superficie celular a la matriz ósea; y
2. la región central o borde estriado que presenta profundos repliegues de la superficie celular bajo los cuales se concentran gran cantidad de lisosomas y mitocondrias, además de ergastoplasma y cisternas del Golgi.
La membrana de los lisosomas primarios se fusiona con la membrana celular que reviste a los repliegues del borde festoneado, liberando las enzimas lisosomales hacia el exterior y produciendo una acidificación del microambiente que baña al tejido óseo por reabsorber. El borde festoneado contiene además gran cantidad de vesículas endocíticas y lisosomas secundarios, indicando que ocurre asimismo un proceso de fagocitosis del material parcialmente solubilizado por el ambiente ácido y la acción lítica de las enzimas lisosomales.
Organización histológica de los huesos
En un hueso ya formado, la disposición de los componentes del tejido óseo en cada zona de él está en estricta relación con las fuerzas de tracción y compresión a que esa zona está sometida habitualmente. Sin embargo, el tejido óseo que se forma primero en el feto y luego en los huesos en desarrollo no se dispone de acuerdo a estos requerimientos mecánicos, sino que constituye un tejido óseo de base, llamado hueso primario o reticular (“entrelazado”), que posteriormente será reemplazado por el hueso secundario o laminillar. La principal diferencia entre el hueso reticular y el laminillar radica en la disposición de las fibrillas de colágeno I, las cuales en el hueso primario se disponen en forma de manojos dispuestos de modo irregular.
De acuerdo al aspecto macroscópico que presentan, se distinguen dos tipos de huesos:
• hueso esponjoso (Figura 3-71a), en el cual el tejido óseo se dispone en trabéculas que delimitan las cavidades, en las que se ubica normalmente la médula ósea; y
• hueso cortical, formado por tejido óseo compacto, el que, salvo en las superficies articulares, está cubierto por el periostio.
El periostio es una capa de tejido conjuntivo denso que en la zona vecina al hueso, contiene células osteoprogenitoras. Desde el periostio nacen vasos sanguíneos que se adosan ya sea a las trabéculas del hueso esponjoso o que penetran en el hueso cortical compacto a través de los conductos de Volkman y de Havers (Figuras 3-71a y b).
Estructura del hueso esponjoso o trabecular
Están formados por unas delgadas trabéculas que están rodeadas por células de revestimiento óseo (Figura 3-72a). Los osteocitos de las trabéculas óseas se irrigan desde los capilares sanguíneos vecinos que se ubican en la médula ósea adyacente.
La orientación de cada trabécula y la disposición de sus laminillas óseas mineralizadas están determinadas por las tensiones mecánicas locales, con el objeto de resistir las compresiones y las tensiones a que es sometida. De modo que en los huesos ya formados, corresponden a tejido óseo laminillar (Figura 3-72b). Si cambia la dirección de los requerimientos mecánicos a que es sometida una trabécula (aumento de peso del individuo, crecimiento u otro), ella debe modificar su orientación.
El cambio en la forma de una trabécula se realiza mediante dos procesos coordinados que ocurren en zonas precisas de la trabécula por remodelar:
• crecimiento por aposición de la trabécula por acción de los osteoblastos, los que depositan laminillas sucesivas de tejido óseo en la zona en que existe una requerimiento mecánico; y
• remoción del tejido óseo de la trabécula, por acción de los osteoclastos en los sitios en que no está sometido a tracción ni compresión (Figura 3-72c).
Organización del hueso compacto
En la diáfisis de los huesos largos, el tejido óseo laminillar se organiza de tres formas:
1. Sistemas de Havers (Figuras 3-73a y b).
2. Sistemas laminillares intersticiales (Figuras 3-73a y b).
3. Sistemas circunferenciales subperióstico (Figura 3-73c) y subendóstico.
Remodelación interna del hueso compacto
En la unidad de remodelación ósea del hueso compacto, existen un cono perforante que avanza y un cono de cierre que le sigue (Figura 3-74a).
El cono perforante o conducto de reabsorción contiene osteoclastos activos (Figura 3-74b), los cuales avanzan removiendo el tejido óseo que no responde a tracción ni compresión y forman un conducto de unos 200 mm de diámetro, a expensas de partes de los sistemas de Havers existentes y porciones de sistemas de laminillas intersticiales. Este espacio va siendo ocupado por un asa capilar rodeada de células preosteoblásticas. El diámetro de este conducto establece el diámetro del nuevo sistema de Havers que se formará en él.
Las células preosteoblásticas se diferencian de los osteoblastos y comienzan a sintetizar la matriz orgánica del hueso (osteoide) y a depositarla sobre las paredes del conducto en laminillas sucesivas (Figuras 3-74c y d). Posteriormente, la matriz ósea de cada laminilla se mineraliza y a medida que avanza el depósito de laminillas hacia el centro del conducto, los osteoblastos quedan atrapados en la matriz ósea, transformándose en osteocitos, y el diámetro del conducto se estrecha hasta alcanzar el diámetro del conducto de Havers maduro, el cual contiene capilares, células de revestimiento óseo y escaso conjuntivo laxo (Figura 3-74d).
Crecimiento de los huesos
Se revisará el proceso en los siguientes tipos de aumento en el tamaño de un hueso:
• Crecimiento en grosor.
• Crecimiento en longitud de los huesos largos.
• Aumento en diámetro de la diáfisis.
Crecimiento en grosor
El crecimiento ocurre a partir de las células presentes en la capa interna o celular del periostio, en la que existen, adosadas a la capa externa o fibrosa, células osteoprogenitoras, las cuales al dividirse originan células que se diferencian de los osteoblastos. Los osteoblastos se disponen en la superficie externa del hueso y sintetizan la matriz ósea orgánica, la que posteriormente se mineraliza. Los osteoblastos atrapados pasan a formar los osteocitos del nuevo tejido óseo (Figura 3-75a). Mientras ocurre el crecimiento en grosor no se observa el sistema laminillar subperióstico (Figura 3-75b), que está bien desarrollado en el hueso adulto (Figura 3-75c).
Crecimiento en longitud
Ocurre a expensas del cartílago de la placa epifisaria, que prolifera aumentando su longitud por crecimiento intersticial, y luego se modifica bajo el control de la hormona somatotropa y es reemplazada por hueso, de acuerdo a los pasos del proceso de osificación endocondral.
En la Figura 3-76a se muestran los cambios que experimenta el tejido cartilaginoso durante este proceso. El cartílago hialino normal que se observa en la zona de reposo experimenta luego un proceso de multiplicación celular, formando columnas paralelas de células aplanadas en el sentido longitudinal del hueso, tal como se observa en la zona del cartílago seriado (Figura 3-76b).
Luego los condrocitos aumentan su tamaño, acumulan glicógeno y grasa, y secretan colágeno X y fosfatasa alcalina. La matriz cartilaginosa se reduce a tabiques delgados, tal como se observa en la zona del cartílago hipertrófico y ocurre la calcificación de la matriz cartilaginosa debido a la alteración en su composición por la presencia del colágeno X y de fosfatasa alcalina. Los condrocitos hipertrofiados quedan aislados en la matriz cartilaginosa calcificada. Esta es penetrada por osteoclastos, que permiten el paso de vasos sanguíneos que provienen desde el canal medular y que se acompañan de osteoblastos, los cuales se adosan a la superficie de la matriz cartilaginosa calcificada y sintetizan y secretan la matriz ósea orgánica (osteoide). Los osteoclastos remueven parte de los tabiques de la matriz cartilaginosa calcificada, formando grandes cavidades delimitadas por espículas de la matriz cartilaginosa que permanecen unidas al cartílago epifisario y que están recubiertas por tejido óseo primario (Figura 3-76c).
Este proceso permite alargar la diáfisis del hueso por desplazamiento de la epífisis. Las espículas óseas, con base cartilaginosa, pueden crecer y fusionarse con el hueso cortical (Figura 3-76d) y posteriormente ser removidas (Figura c94b) y experimentar remodelación ósea interna (Figura 3-76e), formándose posteriormente sistemas de Havers.
Aumento en el diámetro de la diáfisis
Este proceso suele ir acompañado de un aumento en el diámetro de la cavidad medular, y por esta razón ocurre de hecho un desplazamiento lateral del hueso cortical con un aumento proporcionalmente reducido del grosor de la pared ósea misma.
Esto implica la acción coordinada de tres procesos:
1. crecimiento en grosor del hueso a expensas de la capa osteogénica del periostio;
2. reabsorción desde el endostio, por acción de osteoclastos; y
3. remodelación interna del hueso cortical para establecer una distribución de sistemas de Havers adecuada al requerimiento mecánico del hueso en cada etapa de su vida.
Histogénesis del tejido óseo
El tejido óseo se desarrolla siempre por sustitución de un tejido conjuntivo preexistente, ocurriendo este proceso de dos maneras: por osificación intramembranosa y por osificación endocondral.
Osificación intramembranosa
Es el mecanismo mediante el cual se forman generalmente los huesos planos en el feto. Tiene lugar en condensaciones de tejido mesenquimático muy vascularizado en las cuales ciertas células mesenquimáticas se dividen, formándose el blastema óseo donde células osteoprogenitoras se multiplican y dan origen a células que se diferencian a osteoblastos, los que sintetizan y secretan al osteoide que los rodea y que posteriormente se mineraliza y engloba a los osteoblastos que se transforman en osteocitos (Figura 3-77a). Las trabéculas de hueso primario así formada crecen por aposición y son posteriormente remodeladas de acuerdo al hueso que pertenezcan (Figura 3-77b).
Osificación endocondral
Es el proceso mediante el cual se forman, en el feto, los huesos largos y los huesos cortos de los miembros superiores e inferiores y vértebras y los de la base del cráneo.
El proceso se produce en la siguiente forma (Figura 3-78a):
• Se desarrolla un modelo cartilaginoso de un modo parecido a la del hueso al que dará origen y que está rodeado de su pericondrio.
• En el pericondrio de la zona media aumenta su irrigación y se diferencian las células osteoprogenitoras, y ellas originan osteoblastos que producen un collar óseo subperióstico mediante un proceso de osificación directa o membranosa.
• Simultáneamente ocurren en el cartílago subyacente, modificaciones similares a los descritos previamente en el cartílago epifisario, formándose un centro de osificación endocondral primario. Las espículas óseas formadas sobre los restos de la matriz cartilaginosa calcificada se unen al mango del hueso cortical, que sigue engrosándose a partir de la capa osteógena del periostio (Figura 3-78b).
• Posteriormente se forman los centros de osificación secundaria en los extremos del cartílago a partir del cual se formará el hueso esponjoso y cesará primero la osificación endocondral del cartílago hacia las epífisis.
Tejido muscular
Definición de tejido muscular
Este tejido, de origen mesodérmico, contiene células especializadas, llamadas células musculares, que se contraen bajo estímulos adecuados. La maquinaria contráctil de estas células está formada por filamentos que se orientan de modo paralelo a la dirección del movimiento. La organización precisa de los filamentos en la fibra permite que su interacción genere movimiento, aprovechando la energía química almacenada en el ATP y transformándola en energía mecánica.
Este tejido está constituido por (Figura 3-79):
• células musculares (fibras musculares), capaces de generar movimientos al contraerse bajo estímulos adecuados; y
• tejido conjuntivo estrechamente asociado a las células musculares. Este actúa como sistema de amarre y acopla la tracción de las células musculares para que puedan actuar en conjunto. Además, conduce los vasos sanguíneos y la inervación propia de las fibras musculares.
Tipos de tejido muscular
En los vertebrados, se distinguen tres tipos de tejidos musculares (Figuras 3-80a, b y c):
1. músculos esqueléticos voluntarios;
2. músculo cardíaco; y
3. músculos lisos propios de las vísceras.
Cada tipo de músculo está compuesto por células de estructura distinta adaptadas a su función específica, pero en todos ellos la maquinaria intracelular contráctil está formada por filamentos que se orientan en la dirección del movimiento.
Se distinguen así las células musculares estriadas esqueléticas de las células musculares estriadas cardíacas y de las células musculares lisas las células asimétricas, cuyo eje mayor se orienta en la dirección del movimiento.
En las células musculares, algunos organelos tienen nombres que difieren del que se conocen en otras variedades celulares. Así, la membrana plasmática se denomina sarcolema, el citoplasma se llama sarcoplasma y el retículo endoplásmico liso se conoce como retículo sarcoplásmico.
Tejido muscular esquelético
Este tipo de músculo está formado por manojos, más o menos paralelos, de células cilíndricas muy largas, multinucleadas y estriadas, llamadas fibras musculares estriadas.
El diámetro de las fibras varía entre 10 y 100 um y su longitud puede alcanzar hasta 30 cm. Los numerosos núcleos ovalados se ubican en la periferia, inmediatamente por debajo del sarcolema (Figuras 3-81a y b). La multinucleación resulta de la fusión, durante el desarrollo embrionario, de mioblastos mononucleados.
A cada fibra muscular esquelética multinucleada llega una terminación del axón de una neurona motora, formándose en la zona de unión una estructura denominada placa motora (Figura 3-81c).
Cada fibra muscular está rodeada por una lámina basal (lámina externa), cuya capa reticular contiene fibrillas de colágeno III que disponen de manera de transferir, en la forma más efectiva posible, la contracción de las fibras musculares a los sitios de inserción del músculo.
Los tendones, que unen los músculos esqueléticos a los huesos, son continuos, con una cubierta conjuntiva llamada epimisio (Figura 3-82a), que rodea externamente al músculo completo. El tejido conjuntivo penetra al interior del músculo formando el perimisio, que corresponde a delgados septos de tejido conjuntivo que rodean a manojos o fascículos de fibras musculares.
A partir del perimisio, se origina el endomisio, que rodea a cada una de las fibras musculares, el cual incluye a la lámina externa sintetizada por la fibra muscular y que encierra también a las células satélites asociadas a ella, y que incluye delgadas redes de fibras reticulares y matriz extracelular sintetizadas por fibroblastos (Figuras 3-82b y c).
La presencia de las uniones de adhesión entre la fibra muscular y la matriz extracelular del endomisio es crítica para la estabilidad del tejido muscular. De hecho, existen estructuras especiales llamadas costámeros en los que se asocia el citoesqueleto de las fibras musculares a la lámina basal, mediante estructuras parecidas a los contactos focales y a los hemidesmosomas a lo largo de cada fibra muscular (Figura 3-82d).
Los vasos sanguíneos penetran al músculo a través de estos septos conjuntivos. El tejido conjuntivo del endomisio contiene numerosos vasos sanguíneos y nervios. La inervación del tejido muscular esquelético se relaciona directamente con la regulación de la contracción de cada fibra muscular y en consecuencia con el estado de tensión del músculo completo.
Estructura de las fibras musculares estriadas esqueléticas
Estrechamente asociadas a las fibras musculares esqueléticas se encuentran las células satélites, separadas del endomisio por la misma membrana basal que rodea a la fibra muscular. Ellas son células musculares indiferenciadas que juegan un rol importante en el crecimiento y reparación de los músculos.
Las fibras musculares esqueléticas se caracterizan por la presencia de estriaciones transversales periódicas en las cuales se disponen en forma alternada zonas más teñidas y menos teñidas con los colorantes usados (hematoxilina y eosina) (Figura 3-83a). Esta estriación resulta de la existencia en su citoplasma de estructuras especiales llamadas miofibrillas que ocupan alrededor del 70% del citoplasma y que son las responsables de la capacidad de contracción de la fibra muscular.
Las miofibrillas son estructuras cilíndricas largas (1 a 3 um de diámetro) que van paralelas al eje longitudinal de la célula, y están formados por miofilamentos finos y miofilamentos gruesos, dispuestos de tal modo que inducen la apariencia de bandas claras y oscuras que se repiten a lo largo de cada miofibrilla, determinando la organización de los sarcómeros (Figura 3-83b). En el citoplasma que rodea a las miofibrillas se disponen tanto las mitocondrias como las cisternas del retículo sarcoplásmico a las cuales se asocian los túbulos T, en una organización precisa con respecto a los sarcómeros a lo largo de todas las células musculares esqueléticas.
El patrón de bandeo de la fibra muscular es un reflejo de la organización ultraestructural de cada miofibrilla. Las bandas claras y oscuras de todas las miofibrillas están en registro, lo que le otorga el aspecto estriado a la célula muscular. La banda oscura se conoce como banda A (anisótropa: desvía la luz polarizada) y la clara como banda I (isótropa: no altera la luz polarizada). Al centro de la banda A, hay una zona más clara que corresponde a la banda H, en cuyo centro está la línea M (Figura 3-83c). Cada banda I aparece bisectada por una línea transversal oscura denominada disco o línea Z. La unidad repetitiva del aparato contráctil en esta variedad de músculo es el sarcómero, y se extiende de línea Z a línea Z.
El sarcómero presenta una estructura y composición molecular que permite entender el mecanismo de contracción de las fibras musculares estriadas, en el cual ocurre el deslizamiento de los miofilamentos gruesos sobre los miofilamentos finos.
El microscopio electrónico de transmisión muestra la presencia de dos tipos de filamentos dispuestos paralelos al eje mayor de las miofibrillas: los filamentos gruesos y los filamentos finos (Figuras 3-84a y b):
• Los filamentos gruesos (1,6 um de largo y 15 nm de ancho) corresponden a filamentos de miosina y se localizan en la banda A.
• Los filamentos finos (1,0 um de largo y 8 nm de ancho) corresponden a microfilamentos de actina y se disponen paralelos a los filamentos gruesos, con uno de sus extremos anclado a la línea Z.
En la banda A, los filamentos gruesos se alternan con los filamentos finos. Los filamentos gruesos llegan solo hasta el límite de la banda A; en cambio, los filamentos finos nacen en la línea Z, atraviesan la banda I y penetran la banda A, excepto en la zona de la banda H, que consta solo de filamentos gruesos. La banda A presenta filamentos gruesos y finos, la banda I solo filamentos finos y la banda H solo filamentos gruesos. Los filamentos finos de los sarcómeros adyacentes, anclados a un mismo disco Z, presentan polaridad opuesta (Figura 3-84c).
Es posible observar puentes que se extienden radialmente desde los filamentos gruesos hacia los filamentos finos y que corresponden a las cabezas de las moléculas de miosina que protruyen desde el filamento grueso.
La línea M refleja una modificación estructural del centro del filamento grueso. A ese nivel, 6 extensiones dispuestas radialmente se asocian a 6 filamentos gruesos adyacentes. La proteína mayoritaria en la línea M es la creatina kinasa, enzima que cataliza la transferencia de un grupo de fosfato desde la fosfocreatina al ADP. A este nivel también se describe la presencia de una proteína que liga filamentos de miosina, llamada miomesina.
Durante el proceso de contracción, los filamentos finos son empujados hacia el centro de la banda A y se produce el acortamiento del sarcómero (Figuras 3-85a y b). Como consecuencia de este proceso, se oblitera la banda H y disminuye la longitud de la banda I, sin que se modifique la longitud de la banda A. El grado de traslapamiento entre filamentos gruesos y finos explica este fenómeno.
Estructura molecular de los microfilamentos y sus interacciones
Los filamentos finos están formados por tres tipos de proteínas: actina, tropomiosina y troponinas.
Los microfilamentos de actina corresponden a un polímero compuesto por dos hebras de moléculas asimétricas de G-actina que se enrollan una sobre la otra, formando microfilamentos de actina con una polaridad definida (Figura 3-86a).
La tropomiosina es una molécula con forma de bastón, de alrededor de 40 nm de longitud. Estas se unen, cabeza con cola, formando filamentos que corren a lo largo del borde externo de la depresión que se produce al enrollarse las dos hebras de G-actina.
La troponina es un complejo de tres subunidades que se dispone en forma discontinua a lo largo del microfilamento. El complejo está formado por TnT, que se une fuertemente a la tropomiosina, TnC, que une iones calcio, y TnI, que inhibe la interacción actina-miosina.
En los filamentos finos, cada molécula de tropomiosina cubre siete moléculas de G-actina y tiene un complejo de troponinas unido a su superficie. Los filamentos finos de sarcómeros vecinos se anclan en la línea Z a través de las proteínas cap Z y alfa- actinina, que se unen selectivamente al extremo (+) de los filamentos de actina.
Los filamentos gruesos están compuestos principalmente por moléculas de miosina II, que se caracterizan porque las dos cadenas pesadas presentan en su extremo amino-terminal, una estructura globular llamada cabeza, la que se continúa en una zona con forma de bastón, de unos 150 nm de largo, porción que correspode a la cola (Figura 3-86b).
Así cada filamento grueso es una estructura bipolar formada por la asociación antiparalela de alrededor de 300 moléculas de miosina-II. La región central del filamento grueso está compuesta de un conjunto de colas dispuestas en forma traslapada y antiparalela.
Los filamentos gruesos son simétricos a nivel de la región central desnuda y su polaridad se revierte a ambos lados de esta zona. Las cabezas protruyen del filamento en un ordenamiento helicoidal a intervalos de 14 nm. Esta zona globular de la miosina tiene una actividad ATPásica activada por actina (Figura 3-86b).
En la molécula de miosina, existen dos sitios que pueden experimentar cambios conformacionales: uno a nivel de la unión de la cabeza con la cola y otro a nivel del sitio en que el inicio de la cola se une se une a las otras moléculas de miosina. Estas modificaciones se relacionan con las interacciones que establece la molécula de miosina con ATP y/o moléculas de G-actina del filamento fino.
Estructura molecular del sarcómero y contracción muscular
La secuencia de eventos que genera la contracción del músculo estriado es la siguiente (Figura 3-87a):
• En la primera etapa (estado 1), la cabeza de miosina une una molécula de ATP y la hidroliza; y la energía liberada se almacena como un cambio conformacional de la molécula de miosina, la que mantiene unidos ADP y Pi (estado 2).
• La cabeza de la miosina activada puede contactar a una molécula de actina y unirse a ella débilmente. Esto desencadena la liberación del Pi, lo que se traduce en una unión estrecha entre la cabeza de la miosina y la molécula de G-actina (estado 3).
• Una vez unida a la actina, la cabeza de la miosina experimenta un cambio conformacional que como resultado produce un desplazamiento del filamento fino y la liberación del ADP (estado 4).
• Luego, una nueva molécula de ATP se une a la cabeza de la miosina, lo que produce la separación de la cabeza de la miosina del filamento fino. De esta manera, cada cabeza de miosina camina en una sola dirección a lo largo de un filamento fino adyacente, siendo el movimiento siempre hacia el extremo (+) del filamento.
• Mientras la concentración de Ca++ sea alta y exista ATP disponible, los ciclos de formación de puentes actina-miosina continúan y el sarcómero sigue contrayéndose. En ausencia de ATP, el complejo actina-miosina se estabiliza, fenómeno que explica el rigor mortis.
Regulación de la contracción del sarcómero
La contracción muscular está regulada por las variaciones en los niveles citosólicos de Ca++, los que afectan las interacciones entre las cabezas de miosina y los filamentos de actina a través de las proteínas accesorias asociadas a actina en el filamento fino: troponinas y tropomiosina (Figura 3-87b).
En el músculo en reposo (concentración de Ca++ 10–7 M en el citosol), la miosina no puede asociarse a la actina debido a que los sitios de unión para las cabezas de miosina en las G-actina, están bloqueados por la tropomiosina. Al aumentar las concentraciones citosólicas de Ca++ (10–5 M), la subunidad TnC de la troponina se une al Ca++, produciéndose un cambio conformacional de la molécula de troponina y el desplazamiento de la molécula de tropomiosina hacia la parte más profunda de la hendidura de la hélice de actina. Como consecuencia, los sitios en la G-actina, capaces de interactuar con las cabezas de la miosina, quedan libres.
Las variaciones en las concentraciones citosólicas de Ca++ se producen en respuesta a los estímulos nerviosos que inducen la contracción muscular y que actúan desencadenando la liberación de Ca++ desde el retículo sarcoplásmico hacia el citosol.
Retículo sarcoplásmico y túbulos T (túbulos transversos)
Cada miofibrilla está rodeada de un elaborado sistema de membranas lisas que corresponden al retículo sarcoplásmico. Estas membranas están alineadas en forma precisa con respecto al patrón de bandeo de las miofibrillas. En la zona de unión de la banda A con la banda I, el retículo sarcoplásmico se expande para formar las cisternas terminales. Las dos cisternas terminales paralelas se asocian estrechamente a un tubo transverso (T), formando un complejo denominado tríada (Figuras 3-88a y b).
El sistema de tubos T está formado por numerosos túbulos continuos con la membrana plasmática (sarcolema) de la célula muscular. Cada uno de estos túbulos corre transversalmente entre dos cisternas terminales.
La contracción de una fibra muscular, que responde a la estimulación nerviosa a nivel de su placa motora, requiere de la contracción simultánea de todas sus miofibrillas. La forma y distribución del sistema T permite que la onda de depolarización, responsable de la contracción muscular, se distribuya rápidamente desde la superficie celular hacia el interior del citoplasma alcanzando a cada miofibrilla. La depolarización de la membrana plasmática de la célula muscular, que se propaga a lo largo de los túbulos T, induce un cambio en la forma de proteínas sensoras del túbulo T, que se transmite directamente a la proteína que forma los canales de Ca++ del retículo sarcoplásmico (Figura 3-88c).
Tipos de fibras musculares esqueléticas
Se distinguen tres tipos de fibras musculares esqueléticas: rojas, blancas e intermedias.
Las fibras rojas están en las unidades motoras de contracción lenta. Son de diámetro pequeño, contienen gran cantidad de mioglobina y numerosas mitocondrias, que se disponen en filas entre las miofibrillas y en acúmulos por debajo del sarcolema (Figura 3-89a). Son resistentes a la fatiga y son adecuadas para una actividad muscular prolongada.
Las fibras blancas son de diámetro mayor, pobres en mioglobina, con menos mitocondrias que se disponen, de preferencia, entre las miofibrillas, a nivel de la banda I. Producen ATP por glicólisis, su contracción es rápida, pero pronto se fatigan (Figura 3-89b).
Las fibras intermedias presentan características de ambos tipos de fibras.
Inervación del tejido muscular esquelético
• Inervación motora. Cada fibra muscular está inervada por un terminal axónico de una neurona motora de la médula espinal o del tronco del encéfalo. Al aproximarse a la zona de contacto, la fibra nerviosa pierde su vaina de mielina y se asocia a una región especializada de la superficie de la fibra muscular, para formar la unión neuromuscular o placa motora (Figura 3-90a).
En la zona de contacto, la terminal axónica produce una dilatación que se aloja en una depresión poco profunda de la superficie de la fibra llamada hendidura sináptica primaria (Figura 3-90b). El sarcolema que reviste la hendidura sináptica primaria muestra numerosos pliegues que constituyen las hendiduras sinápticas secundarias. En la zona de unión, la lámina basal de la célula de Schwann se fusiona con la lámina basal de la célula muscular. Esta cubierta celular fusionada se extiende hacia la hendidura sináptica primaria, separando la fibra nerviosa de la fibra muscular, y penetra al interior de cada hendidura sináptica secundaria. Cuando la fibra nerviosa está estimulada y el potencial de acción alcanza a la placa motora, el neurotransmisor acetilcolina, contenido en las vesículas sinápticas, se libera y difunde a través de la hendidura. Este mediador se une a receptores de acetilcolina presentes en la membrana postsináptica, concentrados principalmente en la entrada de los pliegues sinápticos secundarios, e induce la depolarización del sarcolema que es transmitida a los tubos T.
Se entiende por unidad motora (Figura 3-90c) al conjunto de fibras musculares esqueléticas inervadas por ramificaciones del axón de una misma neurona motora y que, en consecuencia, son estimuladas simultáneamente a contraerse. Las ramas de una misma motoneurona pueden llegar a inervar hasta 500 fibras musculares. Sin embargo, mientras más fino el movimiento que debe efectuar el músculo, menor es el tamaño de la unidad motora, existiendo situaciones en que cada fibra nerviosa inerva solo una fibra muscular.
• Inervación sensitiva. El músculo esquelético posee receptores sensibles a la distensión, que forman parte de un sistema de retroacción para mantener el tono muscular normal.
Las fibras sensitivas que entregan información sobre la tensión en el músculo esquelético tienen dos orígenes:
1. terminaciones nerviosas encapsuladas que responden a la distensión en el tendón del músculo: el órgano tendinoso de Golgi; y
2. terminaciones nerviosas espirales (fibras aferentes sensitivas), sensibles a la distensión y tensión en fibras musculares especializadas, que son contenidas en un órgano sensorial especial del músculo que se denomina huso muscular.
Estructura del huso neuromuscular
El huso está delimitado por una cápsula de formada por fibroblastos aplanados, cuya capa externa es continua con el perineuro de las fibras nerviosas, y cuya capa interna rodea a un grupo de 8 a 15 fibras musculares delgadas (que se conocen como fibras musculares intrafusales; ellas se disponen paralelas a las fibras musculares extrafusales (Figura 3-91).
Se distinguen 2 tipos de fibras intrafusales:
• fibras de la bolsa nuclear fusiformes, con un agregado central de
núcleos y
• fibras de cadena nuclear de ancho uniforme y núcleos dispuestos en una fila.
Las fibras intrafusales están inervadas por fibras nerviosas aferentes sensitivas de tipo IA que nacen como terminaciones nerviosas espirales, que forman una envoltura alrededor de las fibras intrafusales; ellas responden al estiramiento muscular excesivo de las fibras musculares intrafusales. Las por fibras aferentes sensitivas de tipo IA viajan hacia la médula espinal y hacia el encéfalo y modulan la actividad de las fibras nerviosas eferentes motoras gama que inervan a las fibras musculares intrafusales; su estimulación permite ajustar la longitud de las fibras intrafusales, acuerdo al estado de distensión del músculo. Cuando el músculo se estira las terminaciones sensitivas envían impulso hacia el sistema nervioso central y ellas modulan la actividad de las fibras motoras alfa que inervan a las fibras musculares extrafusales.
Tejido muscular cardíaco
El músculo cardíaco está formado por células musculares ramificadas, que poseen uno o dos núcleos y que se unen entre sí a través de un tipo de unión propia del músculo cardíaco llamada disco intercalar.
A diferencia del músculo esquelético, las fibras musculares cardíacas corresponden a un conjunto de células musculares cardíacas unidas entre sí en disposición lineal. Las caras laterales de las células musculares cardíacas están rodeadas por una lámina basal que se asocia al endomisio, para coordinar la transmisión de fuerza con las células adyacentes.
Las células musculares cardíacas, de unos 15 um de diámetro y unos 100 um de largo, tienen el núcleo ubicado al centro del citoplasma y presentan estriaciones transversales similares a las del músculo esquelético (Figuras 3-92a y b). El retículo sarcoplásmico no es muy desarrollado y se distribuye irregularmente entre las miofibrillas, que no aparecen claramente separadas. Sin embargo, las mitocondrias, que son extremadamente numerosas, están distribuidas regularmente dividiendo a las células cardíacas en miofibrillas aparentes. En el sarcoplasma hay numerosas gotas de lípido y partículas de glicógeno. Con frecuencia, las células musculares cardíacas presentan pigmentos de lipofuscina cerca de los polos nucleares.
Estructuralmente, las miofibrillas del músculo cardíaco son esencialmente iguales a las miofibrillas del músculo esquelético. Por otra parte, los túbulos T del músculo cardíaco son de mayor diámetro que los del músculo esquelético y se ubican a nivel del disco Z (Figura 3-92c). Los túbulos se asocian generalmente con una sola expansión de las cisternas del retículo sarcoplásmico. De manera que lo característico del músculo cardíaco son las díadas, compuestas de un túbulo T y de una cisterna de retículo endoplásmico.
Existen diferencias estructurales entre el músculo de los ventrículos y el de los atrios. Las células musculares de los atrios son más pequeñas y vecinas al núcleo, en asociación con complejos de Golgi presentes en esa zona, se observan gránulos de unos 0,4 um de diámetro que contienen el factor natriurético auricular, auriculina o atriopeptina.
Discos intercalares
Los sistemas de unión que asocian a las células musculares cardíacas que componen las fibras del miocardio se ubican en los discos intercalares. Su forma es tal que aparecen como estructuras escaleriformes (Figuras 3-93a
y b).
Al analizar la estructura de los discos intercalares se observa en ellos:
• una porción transversa, en la cual se ubican dos tipos de uniones intercelulares de adhesión: fascia adherens y mácula adherens; y
• una porción lateral, que corre paralela a los miofilamentos, en la cual se ubican las uniones de comunicación (nexos) (Figura 3-93c).
La fascia adherens es un tipo de unión propia del corazón, pero su estructura es semejante a la de la zónula adherens de los epitelios. Ellas se ubican a nivel de las líneas Z de las miofibrillas de las células adyacentes y anclan los filamentos de actina a la membrana plasmática mediante receptores transmembrana de la familia de las N-caderinas, que forman la unión con la membrana de las células adyacentes. De esta manera, asocian el aparato contráctil de cada célula con el de la célula vecina.
La mácula adherens corresponde a desmosomas típicos que se ubican en las porciones transversas y paralelas del disco. Estas estructuras anclan los filamentos intermedios de desmina de la fibra cardíaca y participan en la adhesión de las membranas plasmáticas de células vecinas.
Las uniones de comunicación (nexos) corresponden a sitios que permiten el paso de iones y moléculas pequeñas desde el citoplasma de una célula a la célula vecina. Su estructura y composición molecular es similar a la de las uniones de comunicación descritas en el capítulo de los epitelios.
Tejido muscular liso
El músculo liso está formado por fibras musculares lisas que corresponden a células mononucleadas, delgadas y aguzadas en los extremos, cuya longitud varía entre 20 y 500 um (Figuras 3-94a y b). Este tipo de músculo forma la porción contráctil de la pared de diversos órganos, tales como tubo digestivo (Figura 3-94c) y vasos sanguíneos, que requieren de una contracción lenta y sostenida. Las células se organizan en grupos, formando haces, rodeados de tejido conjuntivo fibroso que contiene vasos sanguíneos.
El núcleo de las fibras musculares lisas se ubica en el centro de la fibra y los organelos citoplasmáticos, tales como mitocondrias, aparato de Golgi, retículo endoplásmico rugoso y ribosomas libres, se localizan, mayoritariamente, en la vecindad de los polos nucleares (Figura 3-95a). El resto del citoplasma está ocupado por abundantes miofilamentos finos de actina, una proporción menor de miofilamentos gruesos de miosina, y un citoesqueleto de filamentos intermedios formados por desmina. Existen, también, numerosos cuerpos densos, estructuras que anclan filamentos finos.
Las fibras musculares lisas se disponen desplazadas una respecto de la otra, de modo que el extremo delgado de una fibra se ubica al lado de la parte ancha de la fibra vecina. Esta disposición de las fibras y la localización del núcleo en el centro, explican el aspecto del músculo liso en corte transversal (Figura 3-95b). Las fibras musculares lisas están rodeadas por una lámina basal (lámina externa), comparable a la lámina basal de los epitelios, y por fuera de la lámina externa, se dispone una trama de fibras reticulares (Figura 3-95c). En sitios discretos, las células adyacentes están asociadas por uniones de comunicación (nexos), de estructura y función similares a la explicada en los tejidos epiteliales.
Bases estructurales de la contracción del músculo liso
El aparato contráctil del músculo liso se contrae más lentamente que el del músculo estriado, pero permite un acortamiento mayor de las fibras musculares lisas. El mecanismo de contracción, en esta variedad de músculo, también se basa en el deslizamiento de los filamentos finos sobre los filamentos gruesos. Los filamentos de actina de las fibras musculares lisas son fáciles de detectar a nivel ultraestructural (Figura 3-96a). En cambio, la visualización de los filamentos gruesos requiere de condiciones de fijación especiales, que demuestran que en el músculo liso por cada filamento grueso hay una proporción mucho mayor de filamentos finos (1:14) que la que se observa en el músculo esquelético (1:6).
En estas células, la contracción es regulada asimismo por un alza en las concentraciones citosólicas de Ca++. Sin embargo, la regulación de la contracción está asociada a miosina y no a actina. Un alza en las concentraciones citosólicas de Ca++ induce la fosforilación de las cadenas livianas de la miosina, lo que provoca los siguientes fenómenos:
• produce una modificación en la cola de la molécula que permite la formación de filamentos gruesos; y
• genera un cambio conformacional en la cabeza, lo que posibilita su interacción con la actina.
Los filamentos gruesos preparados in vitro, a partir de miosina de músculo liso, aparecen polarizados en una sola dirección en un lado del filamento y en la dirección opuesta a lo largo del otro lado (Figura 3-96b). En esta configuración, no existe una zona libre de puentes, como la que se ve en el filamento grueso del músculo esquelético. Esta disposición tiene la ventaja de que las actinas y las cabezas de la miosina pueden interactuar sin interrupción a lo largo de todo el filamento grueso.
Cuando la cabeza de la miosina se defosforila, los filamentos se desensamblan y la miosina se disocia de la actina. La fosforilación es catalizada por una enzima (quinasa de la cadena liviana de la miosina), cuya acción requiere de la presencia del complejo Ca-calmodulina.
El modelo aceptado de contracción de las fibras musculares lisas establece que los manojos de filamentos finos de actina, asociados a filamentos gruesos de miosina, se anclan por un extremo a cuerpos densos adheridos a la membrana plasmática y por el otro a filamentos intermedios no contráctiles a través de cuerpos densos citoplasmáticos. La a-actinina es uno de los componentes de los cuerpos densos. El rol de los cuerpos densos es similar al de los discos Z de las miofibrillas del músculo estriado. Los manojos contráctiles se orientarían oblicuos respecto del eje mayor de la célula (Figura 3-96c), lo que explicaría el acortamiento que experimentan las fibras musculares lisas durante su contracción.
En la superficie de las células musculares lisas, existen numerosas vesículas membranosas o cavéolas (Figura 3-96a), vecinas a cisternas o túbulos de retículo endoplásmico liso. Se cree que este sistema membranoso juega un papel en la captura y liberación de calcio, similar al que desempeña el retículo sarcoplásmico en el músculo estriado.
Además de su actividad contráctil, las células musculares lisas tienen la capacidad de sintetizar colágeno tipo III, elastina y proteoglicanos.
Inervación del músculo liso
El músculo liso está inervado por fibras nerviosas de los sistemas simpático y parasimpático (Figura 3-97a). Con frecuencia, los axones de los nervios terminan en una serie de dilataciones en el conjuntivo que rodea a las células musculares. Algunas de estas dilataciones axónicas están muy próximas (10-20 nm) a la superficie de la célula muscular, dando origen a las uniones neuromusculares.
De acuerdo a la proporción de células inervadas en un determinado músculo, se distinguen los siguientes tejidos: tejido muscular liso unitario o visceral y tejido muscular multiunitario.
• Tejido muscular liso unitario o visceral: Posee grandes unidades motoras en las que solo algunas células musculares poseen una unión neuromuscular propia. La excitación se transmite a un número variable de células musculares que no reciben inervación directa, a través de uniones de comunicación (nexos). Esto permite que todas las células musculares de la unidad motora se contraigan o relajen en conjunto (Figura 3-97b).
• Tejido muscular multiunitario: Presente en órganos como el iris del ojo o las arteriolas que requieren una modulación precisa del grado de contracción de sus células. En este tipo de músculo liso, las unidades motoras son pequeñas, predominando aquellas en que existe asociación de solo una célula muscular con cada terminación nerviosa (Figura 3-97c).
Regeneración del tejido muscular
La capacidad de regeneración es diferente en las tres variedades de músculo.
1. El músculo esquelético tiene la capacidad de regenerar parcialmente a partir de las llamadas células satélites. Estas corresponden a células mononucleadas, fusiformes, que yacen dentro de la lámina basal que rodea a cada fibra. Se considera que corresponden a mioblastos que persisten luego de la diferenciación del músculo. Frente a daño muscular u otros estímulos, estas células, relativamente escasas, se activan, proliferan y se fusionan para formar nuevas fibras. Un proceso similar es responsable, en parte, de la hipertrofia muscular (aumento de tamaño) que se produce por fusión de estas células con la fibra a la que están asociadas, aumentando la masa muscular.
2. El músculo cardíaco no tiene, prácticamente, capacidad de regenerar. Los daños del músculo cardíaco se reparan por proliferación del tejido conjuntivo, produciéndose una cicatriz.
3. El músculo liso tiene también una capacidad de regeneración moderada. Luego de daño muscular, algunas células musculares lisas entran en mitosis y reemplazan el tejido dañado. Si la capacidad de proliferación no es suficiente para reparar el daño, se produce una cicatriz de tejido conjuntivo. Un caso particular de proliferación de células musculares lisas se produce en el útero de animales preñados, donde se observa aumento del número de células (hiperplasia) y del tamaño de ellas (hipertrofia). Durante esta etapa, el miometrio presenta numerosas mitosis. De ahí que se acepte que las células musculares lisas mantienen su capacidad mitótica. Por otra parte, en cualquier etapa de la vida de un individuo, los pericitos que acompañan a los capilares sanguíneos pueden diferenciarse en células musculares.
Tejido nervioso
Características y funciones básicas del tejido nervioso
Se origina desde el neuroectodermo y sus principales componentes son células que están rodeadas de un escaso material intercelular. Las células son de dos clases diferentes: neuronas o células nerviosas y neuroglia o células de sostén (Figura 3-98a).
Es el tejido constitutivo del sistema nervioso, el cual mediante la acción coordinada de redes de células nerviosas:
• recoge información procedente desde receptores sensoriales;
• procesa esta información, proporcionando un sistema de memoria; y
• genera señales apropiadas hacia las células efectoras.
Las células de neuroglia rodean a las neuronas y desempeñan funciones de soporte, defensa, nutrición y regulación de la composición del material extracelular.
El sistema nervioso central (SNC) se origina desde el epitelio del tubo neural y su tejido nervioso contiene solo neuronas, células de neuroglia y capilares sanguíneos en relación a los cuales se forma la barrera hematoencefálica.
El sistema nervioso periférico (SNP), que conecta al sistema nervioso central con los receptores sensoriales y con las células efectoras, se desarrolla a partir de la cresta neural y se asocia a otros tejidos del organismo. Sin embargo, es una extensión del tejido nervioso del sistema nervioso central, ya que zonas de neuronas sensitivas y de neuronas motoras se encuentran en el sistema nervioso central, mientras que los ganglios nerviosos sensitivos y autónomos y los nervios periféricos corresponden al tejido nervioso cuyas células se han diferenciado desde la cresta neural y se asocian a otros tejidos corporales.
Neuronas
Son las células funcionales del tejido nervioso. Se interconectan formando redes de comunicación que transmiten señales por zonas definidas del sistema nervioso. Las funciones complejas del sistema nervioso son consecuencia de la interacción entre redes de neuronas, y no el resultado de solo las características específicas de cada neurona individual.
El tamaño de las células nerviosas es muy variable, pero su cuerpo celular puede llegar a medir hasta 150 um y su axón hasta más de 100 cm.
La forma y estructura de cada neurona se relaciona con la función que ella desempeña, que puede ser:
• recibir señales desde receptores sensoriales (neuronas sensitivas);
• conducir estas señales como impulsos nerviosos, que consisten en cambios en la polaridad eléctrica a nivel de la membrana celular de cada neurona;
• transmitir la señal a otras neuronas (interneuronas) o a células efectoras.
En las células nerviosas, se distinguen cuatro zonas de estructura y función diferentes: el soma, las dendritas, el axón y las uniones celulares especializadas.
• El soma o cuerpo celular donde se ubica el núcleo y el citoplasma o pericarion que lo rodea (Figura 3-99a) y desde el cual nacen dos tipos de prolongaciones.
• Las dendritas que nacen y se ramifican formando el árbol dendrítico (Figuras 3-99a y b), que aumenta el área de superficie disponible para recibir información desde los terminales axónicos de otras neuronas. La membrana plasmática del soma y de las dendritas está especializada en la recepción e integración de la información recibida.
• El axón, que nace único desde el soma a nivel del cono axónico, conduce el impulso nervioso hacia otras células (Figuras 3-99b, flecha). En su extremo, tiene una arborización terminal o telodendron y en el extremo de cada una de estas arborizaciones existe un botón sináptico.
• Uniones celulares especializadas, que reciben el nombre de sinapsis, ubicadas entre los botones terminales de las ramificaciones del axón y la superficie de otras neuronas (Figura 3-99c) o de células efectoras.
Cada zona de las células nerviosas se localiza de preferencia en regiones especializadas del tejido nervioso:
• Los cuerpos celulares, la mayor parte de las dendritas y la arborización terminal de una alta proporción de los axones se ubican de preferencia en la sustancia gris del sistema nervioso central y en los ganglios del sistema nervioso autónomo.
• La mayor parte de los axones que forman la parte funcional de las fibras nerviosas se ubican de preferencia en los cordones de la sustancia blanca del sistema nervioso central y en los nervios del sistema nervioso periférico.
Tipos de neuronas
Según el número y la distribución de sus prolongaciones (Figura 3-100), las neuronas se clasifican en:
• Bipolares: Además del axón, tienen solo una dendrita; se las encuentra asociadas a receptores en la retina y en la mucosa olfatoria.
• Pseudounipolares: Desde las que nace únicamente una prolongación que se bifurca y se comporta funcionalmente cono un axón, salvo en sus extremos ramificados en que la rama periférica recibe señales y funciona como dendritas, y transmite el impulso sin que este pase por el soma neuronal; es el caso de las neuronas sensitivas espinales (Figura 3-101a).
• Multipolares: Desde las que nacen desde 2 a 2.000 o más dendritas, lo que les permite recibir terminales axónicos desde múltiples neuronas distintas (Figura 3-101b). La mayoría de las neuronas son multipolares. Un ejemplo serían las neuronas motoras de la médula espinal y las neuronas pre y postganglionares del sistema nervioso autónomo. Un caso extremo lo constituye la célula de Purkinje de la corteza cerebelosa, que recibe más de 200.000 terminales axónicos en su arborización dendrítica (Figura 3-101c).
Según la longitud del axón en relación con el árbol dendrítico, las neuronas multipolares se pueden dividir en:
• Neuronas tipo Golgi I: En las que la longitud del axón supera los límites del árbol dendrítico; ellas conducen el impulso nervioso hacia otras zonas del tejido nervioso.
• Neuronas tipo Golgi II: En las que el axón termina en la zona próxima al pericarion y no sobrepasa los límites del árbol dendrítico; generalmente funcionan como interneuronas en una zona definida del tejido nervioso.
Estructura celular de la neurona
El volumen total del citoplasma cambia mucho de una neurona a otra. El volumen del cuerpo celular suele ser menor al volumen total de las prolongaciones. Por ejemplo, en las neuronas sensitivas que inervan los dedos de pies o manos, la rama de la prolongación que va hasta los receptores tiene unos 10 um de diámetro y puede medir hasta 1.000.000 um de largo. Las neuronas motoras de la médula espinal tienen un tamaño similar.
Las neuronas son células sintetizadoras de proteínas, con un alto gasto de energía metabólica. Ellas presentan formas complejas y gran área de superficie de membrana celular, a nivel de la cual mantiene un gradiente electroquímico importante entre el intra y el extracelular. Además, las neuronas secretan distintos tipos de productos a nivel de sus terminales axónicos y requieren recambio contante de sus distintos organelos y componentes moleculares, ya que su vida media suele ser muy larga.
En consecuencia, se caracterizan por tener un núcleo grande y rico en eucromatina, y con nucléolo prominente. El retículo endoplásmico rugoso se dispone en agregados de cisternas paralelas, entre las cuales existen numerosos ribosomas y polirribosomas. Estos agregados se observan al microscopio de luz como grumos basófilos, llamados los cuerpos de Nissl, que se encuentran tanto en el pericarion como en las ramas gruesas de las dendritas (Figura 3-102a), pero no en el axón (Figura 3-102b). El aparato de Golgi se dispone en forma perinuclear y da origen a vesículas membranosas, con contenidos diversos, que pueden desplazarse hacia las dendritas o hacia el axón. Las mitocondrias son abundantes y se encuentran en el citoplasma de toda la neurona. Los lisosomas son numerosos y originan cuerpos residuales cargados de lipofucsina que se acumulan de preferencia en el citoplasma del pericarion neuronal (Figura 3-102c).
El citoesqueleto de las neuronas se caracteriza por la presencia de un tipo especial de filamentos intermedios llamados neurofilamentos y de los denominados neurotúbulos, que corresponden al citoesqueleto de microtúbulos. Cada microtúbulo está formado por moléculas globosas de tubulina que, en presencia de GTP, polimerizan creando un largo túbulo de 25 nm de diámetro que tiene una polaridad definida, en el que se distingue el extremo polimerizante (+) y el extremo depolimerizante (–). Los microtúbulos pueden asociarse a proteínas específicas o MAP (proteínas asociadas a microtúbulos), que determinan las propiedades de los microtúbulos a los cuales ellas se asocian:
• Pueden definir compartimentos en el citoplasma neuronal, la MAP-2 se asocia a los microtúbulos del cuerpo celular y de las dendritas; y la proteína tau se asociada a los microtúbulos del axón.
• Pueden dirigir el movimiento de organelos a lo largo de los microtúbulos, como la hacen las moléculas de kinesina, capaz de desplazarse hacia el extremo polimerizante (+) del microtúbulo; y las moléculas de dineína, que se desplaza hacia el extremo depolimerizante (–) del microtúbulo.
Parte de su citoesqueleto se observó al microscopio de luz en preparaciones teñidas con plata como las llamadas neurofibrillas (Figura 3-101b).
Las dendritas nacen generalmente desde el cuerpo celular como prolongaciones numerosas y ramificadas, a lo largo de las cuales pueden presentarse pequeñas prolongaciones citoplasmáticas o espinas dendríticas (Figura 3-101c) que son sitios de sinapsis. El citoplasma de las dendritas contiene grumo de Nissl (Figura 3-102a), neurofilamentos, microtúbulos, mitocondrias y vesículas membranosas.
El axón es de forma cilíndrica, nace generalmente desde una zona llamada cono axónico que carece de ergastoplasma y ribosomas (Figura 3-103a). En el segmento inicial del citoplasma del axón (axoplasma), hay mitocondrias, vesículas, neurofilamentos y microtúbulos paralelos conectados lateralmente por delgados puentes (Figura 3-103b). El axón puede dar origen a ramas colaterales perpendiculares a él y su principal función es la conducción del impulso nervioso.
Se ramifica extensamente solo en su región terminal (telodendron), la que actúa como la porción efectora de la neurona, ya que cada terminal axónico puede relacionarse por medio de sinapsis con numerosas neuronas o con distintas células efectoras.
Estructura y funciones básicas del axón
Sus principales funciones son:
• Transporte de organelos y moléculas por el axoplasma, entre el pericarion y las ramas del telodendron, proceso en que participan los microtúbulos. Este transporte es necesario tanto para la mantención del axón y de las células asociadas a él como para permitir la llegada al pericarion de factores reguladores que modulan su comportamiento.
• Conducción del impulso nervioso, como el desplazamiento del potencial de acción generado por cambios en la permeabilidad a iones a lo largo de la membrana celular axonal (axolema), en las fibras nerviosas en las que el axón está rodeado por su vaina de células de sostén.
Transporte axónico
El transporte de organelos, enzimas, agregados macromoleculares y metabolitos es una función de axoplasma en la cual intervienen directamente los microtúbulos.
Ocurre en dos direcciones: anterógrado, desde el soma neuronal hacia el telodendron, y retrógrado, desde los botones terminales hacia el soma neuronal.
La velocidad del transporte varía entre los siguientes flujos:
• un flujo lento de 0,5 um/min, en el que se desplazan los agregados moleculares como las subunidades proteicas que forman al citoesqueleto axonal;
• el flujo rápido anterógrado, al cual los organelos membranosos se trasladan a velocidades de unos 300 um/min; y
• el flujo rápido retrógrado, en el que las vesículas membranosas provenientes de los botones terminales son transportados hacia el pericarion a unos 200 um/min.
Los transportes axonales rápidos están mediados por la interacción molecular entre los microtúbulos y las dos moléculas son capaces de desplazarse a lo largo de ellos (Figura 3-103c).
En el flujo rápido anterógrado es la molécula de kinesina, unida a un receptor en la membrana del organelo transportado, la que se desplaza interactuando con la tubulina a expensas de ATP, desde el extremo (–) del microtúbulo, ubicado en el pericarion, hacia su extremo (+).
En el flujo rápido retrógrado, es la molécula de dineína citoplasmática, unida a un receptor en la membrana del organelo transportado, la que se desplaza. Interactúa con la tubulina a expensas de ATP, desde el extremo (+) del microtúbulo, ubicado en el terminal axónico, hacia su extremo (–).
Conducción del impulso nervioso por el axón
Los axones están siempre rodeados por células gliales.
En el sistema nervioso central, están rodeados por la mielina formada por los oligodendrocitos (fibras nerviosas mielínicas del SNC), mientras que en el sistema nervioso periférico pueden estar rodeados por prolongaciones citoplasmáticas de las células de Schwann (fibras amielínicas) o por la mielina formada por las células de Schwann (fibras nerviosas mielínicas del SNP).
Los impulsos nerviosos se transmiten como ondas transitorias de inversión de la diferencia de voltaje que existe a nivel de la membrana celular, que avanzan desde el sitio en que se aplica el estímulo. Cada una de estas ondas corresponde a un potencial de acción.
Este proceso es posible porque entre las moléculas que, como proteínas integrales, ocupan todo el espesor del axolema se encuentran:
• la bomba de sodio-potasio, capaz de sacar Na+ del axoplasma e introducir K+, manteniendo la diferencia de potencial propia de la membrana no estimulada, potencial de reposo, de –70 mV hacia el interior de la célula;
• canales para Na+ sensibles a voltaje, los cuales al abrirse y permitir la entrada de Na+ hacia el interior, determinan que esta cara de la membrana se vuelva positiva (+30 mV), generando en parte la inversión del voltaje de la membrana. El período refractario a la estimulación en el sitio recién depolarizado se debe a la etapa de inactivación de los canales de Na+ sensibles a voltaje; y
• canales para K+ sensibles a voltaje, cuya activación contribuye al retorno a la polaridad inicial, por salida de iones K+ desde el interior del axoplasma. Este proceso tarda menos de 1 milisegundo.
Esta depolarización de una zona de la membrana sirve como estímulo para depolarizar las zonas vecinas de la membrana axonal.
En las fibras nerviosas amielínicas el impulso se conduce como una onda continua de inversión de voltaje hasta los botones terminales de los axones, en la forma indicada en el párrafo anterior, a una velocidad que es proporcional al diámetro del axón y que varía entre 0,6 a 6 m/seg.
En las fibras nerviosas mielínicas, el axón está cubierto por una vaina de mielina formada por la aposición de una serie de capas concéntricas de membrana celular, que actúa como un aislante eléctrico del axón.
A lo largo del axón la mielina es formada por células sucesivas, ocupando la mielina dependiente de cada célula entre 0,2 a 1 mm de largo, y en cada límite intercelular existe un anillo sin mielina que corresponde al nodo de Ranvier. Es en este sitio donde puede ocurrir el flujo de iones a través de la membrana axonal.
A nivel de los nodos de Ranvier, la concentración de los canales de Na+ sensibles a voltaje en el axolema llega a 10.000/um2, mientras que son muy escasos en la membrana que enfrenta a la mielina en los internodos. Esta distribución en la membrana axonal es mantenida por su asociación a la ankirina, proteína de unión al citoesqueleto de la actina axonal.
La consecuencia es una conducción saltatoria del potencial de acción, ya que la inversión del voltaje inducido a nivel de un nódulo de Ranvier se continúa por propagación pasiva rápida de la corriente por el interior del axón y por el extracelular hasta el nódulo siguiente donde produce la inversión del voltaje.
La estructura de los axones mielínicos permite la conducción más rápida del impulso nervioso y una disminución en la cantidad de energía requerida para conducir el impulso nervioso a lo largo del axón hacia las células efectoras. De hecho, la velocidad de conducción del impulso nervioso es proporcional al diámetro del axón y a la distancia entre los nodos de Ranvier. Como ejemplo, un axón mielínico de 12 um de diámetro conduce a la misma velocidad que un axón amielínico de invertebrados de 600 um de diámetro.
Estructura de las fibras nerviosas
Durante su desarrollo embrionario, los axones están rodeados por células gliales, que en el sistema nervioso central corresponden a prolongaciones de los oligodendrocitos. En el sistema nervioso periférico, corresponden a las células de Schwann que se originan de la cresta neural y acompañan a los axones durante su crecimiento, formando la vaina que cubre a todos los axones del sistema nervioso periférico desde su segmento inicial hasta sus terminaciones.
Fibras nerviosas amielínicas
Cuando los axones asociados a la célula de Schwann son de pequeño diámetro, cada uno de ellos se aloja en una concavidad de la superficie de la célula de Schwann, rodeado por espacio intercelular y conectado hacia el exterior mediante el mesaxón. Varios axones pueden estar alojados en la misma célula y el conjunto está rodeado por una lámina basal. Todo el axolema de estos axones queda así expuesto al líquido intersticial y los impulsos nerviosos se transmiten a lo largo de los axones en forma continua (Figura 3-104a). Cada una de estas estructuras corresponde a una fibra nerviosa amielínica del sistema nervioso periférico. Ellas corresponden a la mayor parte de los axones postganglionares del sistema nervioso autónomo y a los axones de menor tamaño de las neuronas sensitivas de los ganglios espinales
Fibras nerviosas mielínicas
Los axones de mayor diámetro inducen el proceso de formación de la mielina, ya sea por la célula de Schwann en el sistema nervioso periférico (Figura 3-104b) o por oligodendrocitos en el sistema nervioso central.
En las fibras mielínicas del sistema nervioso periférico, cada célula de Schwann rodea a solo un axón y la vaina de mielina que ha formado se ubica vecina la membrana plasmática adyacente a la membrana axonal, mientras que el resto de su citoplasma y su núcleo se concentran en la zona de la célula de Schwann externa a la vaina de mielina. El conjunto está rodeado por la lámina basal de la célula de Schwann. A esta zona se le suele llamar el neurilema.
El largo de cada célula de Schwann varía entre 200-2000 um. Entre las sucesivas células de Schwann existen zonas sin mielina llamadas los nodos de Ranvier (Figuras 3-105a y b).
La mielina está compuesta por capas de membrana de la célula de Schwann, las cuales se disponen así durante el proceso de mielinización. Este comienza con la invaginación de un axón en la superficie de la célula de Schwann, de manera que el axolema se adosa estrechamente a la membrana plasmática de la célula de Schwann por una parte, mientras que las membranas de la célula de Schwann se enfrentan en el mesaxón (Figura 3-106a).
Luego se produce un crecimiento en espiral del citoplasma de la célula de Schwann, que se traduce en un crecimiento del mesaxón en forma tal, que se enfrentan las membranas plasmáticas de la célula de Schwann tanto por sus caras extracelulares como por sus caras intracelulares. Al fusionarse las caras extracelulares, se genera la llamada línea interperiódica, y al desplazarse el citoplasma y fusionarse las caras intracelulares de las membranas, se originan las líneas periódicas. El citoplasma de la célula de Schwann permanece en la zona vecino al axón, junto a la superficie externa de la célula (Figura 3-106b), en las cisuras de Schmidt-Lantermann, entre las lamelas internodales de la mielina, y a nivel de los nodos de Ranvier, en los extremos celulares de cada vuelta de mielina donde no ocurre la fusión de las membranas plasmáticas (Figura 3-105b). La lengüeta más externa de la célula de Schwann y su lámina basal cubren al axón en esta zona carente de mielina.
En las fibras nerviosas mielínicas del sistema nervioso central, una célula de oligodendroglía puede formar mielina para varios axones, ya que ella presenta diversas prolongaciones celulares y en ellas el proceso de mielinización ocurre de manera similar al de la célula de Schwann. En cada una de ellas se puede formar una concavidad para alojar un axón y el crecimiento del mesaxón induce la formación de la vaina de mielina para cada uno de estos axones (Figuras 3-107a y b).
En los nodos de Ranvier, la vaina de mielina se interrumpe y el axón queda desnudo, sin una lámina basal que lo cubra, aunque él es cubierto por prolongaciones de células de astroglía adyacentes (Figura 3-107c). Los axones amielínicos presentes en el sistema nervioso central están cubiertos por prolongaciones de astroglía.
Es importante destacar que si bien la vaina de mielina tiene una estructura similar en el sistema nervioso central y en el sistema nervioso periférico, la composición molecular de la membrana que la forma no es igual (Figura 3-108). Esto explica por qué hay enfermedades desmielinizantes que afectan en forma diferente al sistema nervioso central y al sistema nervioso periférico.
Uniones intercelulares de las neuronas
Las neuronas se asocian entre sí y con otras células en estructuras especializadas que permiten algunas de las siguientes acciones:
• Inducir la descarga del impulso nervioso de una neurona sensitiva por asociación de la ramificación terminal periférica de su axón con células epiteliales de los receptores sensoriales.
• Estimular la acción de células efectoras de otros tejidos, gracias a la capacidad del terminal axónico de asociarse a estas células. De hecho a este tipo de uniones se les considera un tipo especial de sinapsis química.
• Transmitir el impulso nervioso desde una neurona a otra mediante estructuras especializadas, las sinapsis, que se encuentran en el sitio de contacto de cada terminal axónico con las dendritas o el pericarion de otra neurona.
Sinapsis
Conducen el impulso nervioso solo en una dirección. Desde el terminal presináptico se envían señales que deben ser captadas por el terminal postsináptico. Existen dos tipos de sinapsis, eléctricas y químicas, que difieren en su estructura y en la forma en que transmiten el impulso nervioso.
Sinapsis eléctrica
Corresponden a uniones de comunicación entre las membranas plasmáticas de los terminales presináptico y postsináptico, las que al adoptar la configuración abierta permiten el libre flujo de iones desde el citoplasma del terminal presináptico hacia el citoplasma del terminal postsináptico.
Sinapsis química
Se caracterizan porque las membranas de los terminales presináptico y postsináptico están engrosadas y separadas por la hendidura sináptica, espacio intercelular de 20-30 nm de ancho. El terminal presináptico se caracteriza por contener mitocondrias y abundantes vesículas sinápticas, que son organelos revestidos de membrana que contienen neurotransmisores (Figuras 3-109a, b y c).
Al fusionarse las vesículas sinápticas con la membrana del terminal postsináptico se libera el neurotransmisor, que se une a receptores específicos localizados en la membrana postsináptica, en la cual se concentran los canales para iones activados por ligandos.
Cuando llega el impulso nervioso al terminal presináptico, se induce:
• La apertura de los canales para calcio sensibles a voltaje, al subir el calcio intracelular se activa la exocitosis de las vesículas sinápticas que liberan al neurotransmisor hacia la hendidura sináptica.
• La unión del neurotransmisor con su receptor induce en la membrana postsináptica la apertura de los canales para iones activados por ligandos, determinando cambios en la permeabilidad de la membrana que pueden inducir la depolarización de la membrana postsináptica: sinapsis excitatorias, o hiperpolarizar a la membrana postsináptica: sinapsis inhibitorias.
La sumatoria de los impulsos excitatorios e inhibitorios que llegan por todas las sinapsis que se relacionan con cada neurona (1.000 a 200.000) determina si se produce o no la descarga del potencial de acción por el axón de esa neurona.
Las sinapsis se clasifican en función de la localización en la neurona postsináptica del sitio donde se ubican las terminaciones axónicas (Figura 3-110) y se distinguen los siguientes tipos:
• axo-somáticas: sobre la membrana que rodea al cuerpo neuronal;
• axo-dendríticas: sobre la membrana del eje de las dendritas;
• axo-espinosas: sobre una espina dendrítica; y
• axo-axónicas: sobre la membrana del axón y son las menos frecuentes.
Estructura básica del sistema nervioso periférico
El sistema nervioso periférico, que conecta al sistema nervioso central con los receptores sensoriales y con las células efectoras, se desarrolla a partir de la cresta neural y se asocia a otros tejidos del organismo.
Sin embargo, zonas de las neuronas sensitivas y motoras del sistema nervioso periférico se encuentran en el sistema nervioso central. Mientras que el tejido nervioso propio del sistema nervioso periférico, además de neuronas y células de sostén, se asocia a otros tejidos para constituir los ganglios y los nervios periféricos que se conectan, ya sea con receptores sensoriales o con las células efectoras.
Los ganglios son órganos esféricos protegidos por una cápsula de tejido conjuntivo de características similares al perineuro y al epineuro, que contiene acumulos de cuerpos neuronales y prolongaciones nerviosas asociadas a las células gliales (Figura 3-111a).
Los ganglios sensitivos de las raíces espinales y de los nervios craneales contienen las neuronas sensitivas pseudounipolares, cuyo cuerpo celular está totalmente cubierto por células gliales llamadas células satélites (Figuras 3-111b, c y d).
Las células satélites están rodeadas por una lámina basal que las separa de la matriz extracelular, rica en fibrillas de colágeno III. Desde el pericarion nace solo una prolongación mielinizada que se bifurca en una rama central y otra periférica.
Los ganglios del sistema nervioso autónomo contienen los terminales axónicos de las neuronas pre-ganglionares que hacen sinapsis con el pericarion y las dendritas de las neuronas ganglionares (Figuras 3-112a y b). Todas estas estructuras están rodeadas por las células satélites, cuya lámina basal las rodea y las separa del material extracelular intersticial. Desde estas neuronas ganglionares nacen los axones que formaran las fibras post-ganglionares efectoras (Figura 3-112c), que inervaran el músculo liso visceral y/o epitelios glandulares.
Nervios
La unidad estructural es el fascículo nervioso, que está formado por fibras nerviosas rodeadas por una cubierta especial que es el perineuro, el cual rodea a los haces de fibras nerviosas, mielínicas o amielínicas, cuyos axones pueden pertenecer a neuronas motoras del sistema nervioso central, neuronas sensitivas y neuronas pre o postganglionares del sistema nervioso autónomo.
En los nervios, se distinguen tres cubiertas asociadas a las fibras nerviosas: epineuro, perineuro y endoneuro.
• Epineuro, que rodea al conjunto de los fascículos nerviosos, es una vaina de tejido conectivo corriente, rico en fibroblastos y en fibras colágenas, que tiende a ser más bien laxo entre los distintos fascículos, pero que se hace bastante fibroso en la periferia, estructurando los nervios anatómicos (Figuras 3-113a y b).
• Perineuro, que rodea a las fibras nerviosas y delimita al fascículo nervioso, está formado por células muy aplanadas, las cuales se han diferenciado tomando un aspecto epiteliode (Figura 3-113c), están rodeadas por una lámina basal y se disponen en capas asociándose entre sí mediante complejos de unión. Entre ellas, existe escasa sustancia fundamental con fibrillas de colágeno III y finas fibras elásticas (Figura 3-113d). El perineuro forma una envoltura continua que acompaña a las fibras nerviosas hasta sus terminaciones, ya que juega un rol muy importante en la regulación de la composición del medio que rodea a las fibras nerviosas.
• Endoneuro se ubica al interior del fascículo y rodea a cada fibra nerviosa (Figura 3-113d), contiene fibrillas de colágeno III, orientadas paralelas a las fibras nerviosas y rodeadas de matriz extracelular, rica en proteoglicanos. Contiene vasos sanguíneos y los capilares se han diferenciado, formando parte de la barrera hematoneural.
Estructura básica del sistema nervioso central (SNC)
El tejido del sistema nervioso central contiene una red de aproximadamente 1012 neuronas que se comunican mediante la transmisión de potenciales de acción.
Estas neuronas están rodeadas por un número aún mayor de células de sostén, llamadas células de neuroglia, que constituyen más del 50% del volumen del tejido que forma el encéfalo y la médula espinal.
En las distintas zonas del sistema nervioso central puede distinguirse macroscópicamente áreas de sustancia gris y de sustancia blanca.
En la sustancia gris se concentran los cuerpos celulares y las prolongaciones nerviosas asociadas a ellas mientras que la sustancia blanca está formada por fibras nerviosas con una mayoría de axones mielinizados.
Células de sostén
Se distinguen cuatro tipos de células de neuroglia: oligodendroglía, astroglía, microglía y células ependimarias (Figura 3-114). Salvo la microglía, que es de origen mesodérmico, las demás se originan desde células del tubo neural.
Oligodendroglía
Según su ubicación se distinguen los oligodendrocitos perineuronales, que expresan factores tróficos que crean un ambiente favorable para los cuerpos neuronales y que forman la mielina para los axones que penetran a la sustancia gris, y los oligodendrocitos interfasciculares, que se ubican entre los axones mielinizados de la sustancia blanca. Son células pequeñas y con menos prolongaciones que la astroglía (Figura 3-115a).
Su núcleo es rico en heterocromatina y su citoplasma contiene ergastoplasma, polirribosomas libres, un aparato de Golgi desarrollado y un alto contenido en microtúbulos, tanto en el citoplasma que rodea al núcleo como en sus prolongaciones. Su función más notable es la formación de la mielina, que rodea a los axones del sistema nervioso central (Figura 3-115b).
El proceso de mielinización del axón por el oligodendrocito es parecido al de la célula de Schwann. Sin embargo, cada oligodendrocito puede formar la mielina a varios axones vecinos, ya que cada una de sus prolongaciones puede rodear a un axón y al crecer su mesaxón desde su zona más interna, genera varias vueltas en torno al axón, formando así los internodos mielinizados (Figura 3-115c).
Astroglía
Tienen formas estrelladas y presentan largas prolongaciones llamadas pies terminales, que contienen manojos de filamentos intermedios específicos formados por la proteína gliofibrilar ácida (GFAP).
Los pies terminales cubren:
• la superficie interna de la piamadre, constituyendo la glía limitante (Figura 3-116a);
• todos los capilares sanguíneos del sistema nervioso central (Figura 3-116b);
• las neuronas (cuerpos celulares y dendritas);
• los nodos de Ranvier de los axones mielinizados (Figura 3-107c); y
• los axones no mielinizados.
Se han identificado dos tipos de astroglía:
1. Astrocitos protoplasmáticos: Son propios de la sustancia gris, rodean a las neuronas y a sus prolongaciones, y se ramifican en las áreas sinápticas, se asocian a capilares, y secretan factores de crecimiento para glías y neuronas (Figura 3-116b).
2. Astrocitos fibrosos: Se asocian a las fibras nerviosas de la sustancia blanca y se ubican entre las fibras nerviosas y tiene prolongaciones que pueden rodear los nodos de Ranvier o que se asocian a la lámina basal de los capilares sanguíneos (Figura 3-116c).
Sus principales funciones serían:
• Regular el acceso a las neuronas de las moléculas adecuadas.
• Facilitar el intercambio de metabolitos entre las neuronas y la sangre.
• Remover los neurotransmisores y el exceso de K+ del extracelular.
• Participar en la formación de la barrera remato-encefálica.
Barrera hematoencefálica
La estructura y el funcionamiento de los capilares del sistema nervioso central son diferentes a la de otros capilares continuos del organismo. Ellos forman una barrera fisiológica que restringe el paso de cierta sustancia hacia el tejido nervioso. La interacción de las prolongaciones perivasculares de los astrocitos con la lámina basal de las células endoteliales continuas de los capilares del sistema nervioso central, determina una diferenciación estructural de este endotelio. Las uniones intercelulares presentan bandas de oclusión muy desarrolladas que restringen el paso paracelular de sustancias a través de ellas. Esto determina que las sustancias que son necesarias para el metabolismo del tejido nervioso deben unirse a receptores específicos en la membrana luminal y ser transportadas a través del citoplasma endotelial para ingresar al tejido nervioso (Figuras 3-117a y b).
Permite el libre paso de gases y de moléculas específicas, tales como glucosa, pero impide el paso de toxinas, drogas y otras moléculas de alto peso molecular y baja solubilidad en lípidos. Si bien las prolongaciones de los astrocitos no forman la barrera en sí, su presencia es necesaria para mantener las propiedades del endotelio capilar.
Microglía
Las células de microglía constituyen entre 10% y 20% del total de la población glial en el adulto. Se originan desde monocitos de la sangre que invaden el sistema nervioso central durante el desarrollo y allí pueden proliferar como células de la microglía. Son el principal componente del sistema inmune en el sistema nervioso central y ellas pertenecen al sistema de fagocitos mononucleares. En su citoplasma hay retículo endoplásmico rugoso, aparato de Golgi, lisosomas y cuerpos residuales (Figuras 3-118a y b). Son células redondeadas pequeñas con numerosas prolongaciones ramificadas. Estas prolongaciones están en contacto tanto con el cuerpo neuronales como con los astrocitos y los vasos sanguíneos, y ellas pueden moverse y endocitar materiales tanto del líquido extracelular como estructuras celulares dañadas. Pueden estar en estado de reposo, que es el momento en que presentan las largas prolongaciones, o pueden estar activadas y moverse actuando como células fagocitarias, expresando una gran gama de funciones, removiendo el material dañado del tejido nervioso.
La función básica de estas células es defender y reparar al tejido nervioso de daños causados por restos celulares, microorganismos invasores y daño causado por enfermedades. Expresan en su membrana el complejo de histocompatibilidad de tipo II (MHC-II) y actúan como células presentadoras de antígenos.
Epéndimo
El epéndimo es un epitelio cúbico simple (Figura 3-119a) que reviste la superficie de los ventrículos cerebrales y el conducto central de la médula espinal que actúa como una barrera de protección ubicada entre el tejido nervioso y el líquido cerebroespinal.
En él se reconocen dos tipos celulares (Figura 3-119b):
• Las células ependimarias forman un epitelio cuboidal monoestratificado que reviste las cavidades internas del sistema nervioso central que contienen al líquido cerebroespinal (ventrículos y conducto del epéndimo). Su superficie apical presenta microvellosidades que aumentan el área de membrana luminal y cilios cuyos movimientos participan en determinar el flujo del líquido cerebroespinal. Se unen entre sí por bandas de adhesión intercelulares similares a los epiteliales, pero carecen de zona de oclusión, de modo que el líquido cerebroespinal se comunica con los espacios intercelulares existentes entre las células nerviosas y las glías.
• Los tanicitos son células especializadas presentes en el epitelio del epéndimo, en el tercer ventrículo, que en su superficie apical presenta microvellosidades y cilios, y que en su zona basal presentan además largas prolongaciones que se asocian a las prolongaciones de la astroglía.
Plexo coroideo
El plexo coroideo es una estructura especializada que produce al líquido cerebroespinal que circula en los ventrículos, el canal central de la médula espinal y el espacio subaracnoideo. Durante el desarrollo embrionario, la capa de células ependimarias entra en contacto con las meninges muy vascularizadas que forman la tela coroidea del techo del tercer y del cuarto ventrículo. Estas estructuras dan origen al plexo coroideo, el que está formado por pliegues muy vascularizados de la piamadre, cubiertos por las células ependimarias modificadas (Figuras 3-120a y b) que se han diferenciado como células epiteliales capaces de transportar iones y secretar líquido.
Los capilares sanguíneos que las irrigan son capilares fenestrados y carecen de uniones de oclusión. La presión hidrostática dentro del capilar determina un flujo neto de agua y solutos y proteínas que pasan al tejido conjuntivo laxo circundante y penetran en las células secretoras. Las células están unidas entre sí mediante complejos de unión con bandas de oclusión importantes. Su cara basal tiene profundas invaginaciones de la superficie que se asocia a la membrana basal. Su superficie luminal presenta largas microvellosidades en cuya membrana se localiza la Na/K-ATPasa que bombea Na+ hacia la luz del ventrículo, creando un gradiente osmótico que facilita la difusión de agua hacia el lumen ventricular (Figura 3-120c).
Se puede resumir la estructura histológica del tejido nervioso del sistema nervioso central distinguiendo la citoarquitectura de la sustancia gris en que destaca (Figuras 3-121a, b y c):
• la estrecha vecindad entre las membranas de las células nerviosas y las membranas de las células gliales, quedando siempre un espacio delgado de grosor relativamente constante entre ellas, lleno de material extracelular;
• disposición de prolongaciones gliales protoplasmáticas alrededor de las sinapsis químicas, aislándolas del escaso espacio intercelular;
• concentración de células de astroglía protoplasmática en este tejido;
• dendritas y somas neuronales rodeadas siempre de prolongaciones de oligodendrocitos y astrocitos, y separadas por ellas de otras prolongaciones nerviosas, excepto en los sitios de sinapsis;
• capilares sanguíneos rodeados siempre por prolongaciones gliales;
• ausencia de elementos ajenos al tejido derivado del tubo neural, con la única excepción de las células de microgliamicroglía y de la irrigación.
La citoarquitectura de la sustancia blanca que se caracteriza por contener haces de fibras nerviosas mielínicas, en las cuales los axones están rodeados por una vaina de mielina formada por oligodendrocitos y pies terminales de astrocitos fibrosos rodeando los nodos de Ranvier (Figura 3-121d).
Estructura y función de las meninges
El sistema nervioso central está contenido y protegido en el interior del cráneo y del conducto vertebral y aparece rodeado por tres capas de tejido conjuntivo llamadas meninges, que desde afuera hacia adentro son: la duramadre, la aracnoides y la piamadre (Figura 3-122a).
• La duramadre (duramáter) es la meninge más externa y está formada por un tejido conectivo fibroso denso que se continúa con el endostio de los huesos del cráneo. Sin embargo, la duramadre que rodea la médula espinal está separada del periostio de las vértebras, de manera que entre ambas estructuras se forma el espacio peridural. Este espacio contiene venas de paredes delgadas, tejido conjuntivo laxo y tejido adiposo.
La pared de la duramadre que está en contacto con la aracnoides es una zona de contacto lábil en la que en muchas condiciones patológicas se puede acumular sangre por fuera de la aracnoides en el denominado espacio subdural; este espacio no existe en condiciones normales.
La superficie interna de la duramadre del encéfalo está revestida por un epitelio simple, plano, de origen mesenquimático. Este tipo de epitelio reviste ambas superficies de la duramadre espinal (Figura 3-122a).
• La aracnoides presenta dos partes (Figuras 3-122b y c): una de ellas formada por una capa en contacto con la duramadre y la otra constituida por trabéculas que unen la aracnoides con la piamadre. Las cavidades que quedan entre las trabéculas conjuntivas constituyen el espacio subaracnoideo que contiene líquido cerebroespinal. Este espacio se comunica con los ventrículos cerebrales en tres sitios a nivel del techo del cuarto ventrículo, pero no comunica con el espacio subdural. El espacio subaracnoideo, lleno de líquido, constituye un colchón hidráulico que protege al sistema nervioso contra los traumatismos.
La aracnoides está formada por tejido conjuntivo sin vasos sanguíneos y todas sus superficies aparecen revestidas por capas de fibroblastos aplanados que se asocian entre sí mediante complejos de unión con zonas de oclusión destacadas (neurotelio), entre las cuales hay fibrillas de colágeno III. La aracnoides produce en algunos lugares expansiones que perforan la duramadre y protruyen en senos venosos que terminan en forma de dilataciones cerradas llamadas vellosidades aracnoideas. Su función es la transferencia de líquido cerebroespinal hacia la sangre: el líquido atraviesa la pared de la vellosidad y del seno venoso hasta alcanzar la sangre.
• La piamadre (piamáter) está muy vascularizada y fuertemente adherida al tejido nervioso, aunque no entra en contacto con las células y fibras nerviosas, ya que entre ellos se sitúan las prolongaciones de los astrocitos de la glia limitante cuya lámina basal está en contacto con las células y fibras colágenas de la piamadre. La superficie externa de la piamadre que está en contacto con el espacio aracnoideo está revestida de células aplanadas de origen mesenquimático (Figuras 3-122b y c).
Los vasos sanguíneos penetran en el tejido nervioso por medio de túneles revestidos por la piamadre que son llamados espacios perivasculares (o de Virchow) que se adosan a la pared de los vasos y los cuales desaparecen a medida que los vasos se ramifican; al llegar a los capilares, ellos solo están rodeados por células de astroglía. En estos espacios perivasculares se ubican las vénulas postcapilares, que es el sitio por donde las células de la defensa inmune pueden pasar desde la sangre hacia el tejido nervioso.
Anexo Figuras
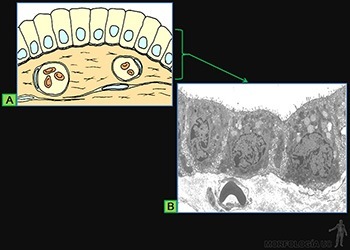
Figura 3-1
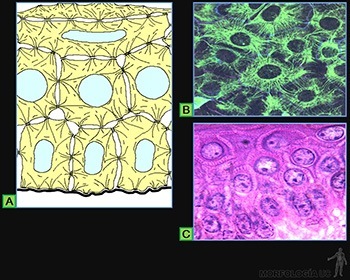
Figura 3-2
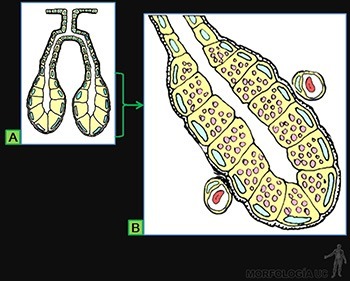
Figura 3-3
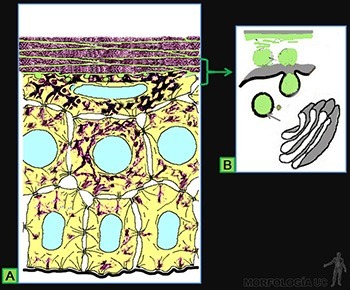
Figura 3-4
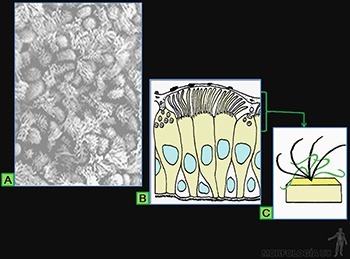
Figura 3-5
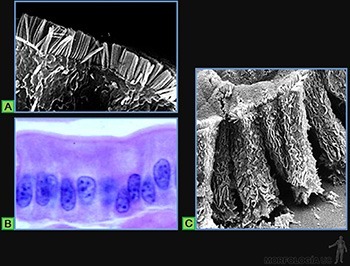
Figura 3-6
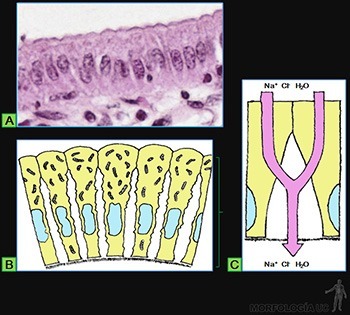
Figura 3-7
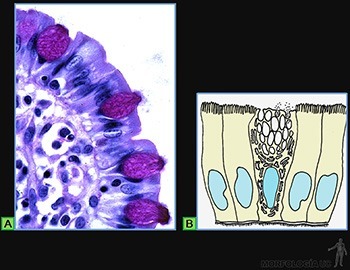
Figura 3-8
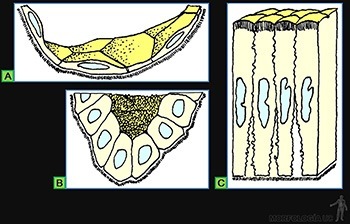
Figura 3-9
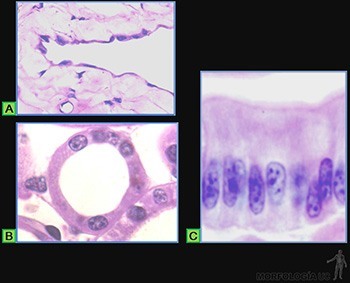
Figura 3-10
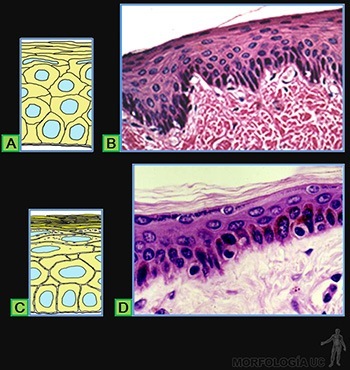
Figura 3-11
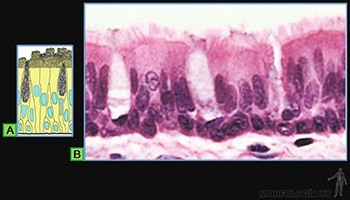
Figura 3-12
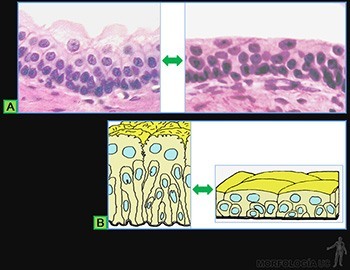
Figura 3-13
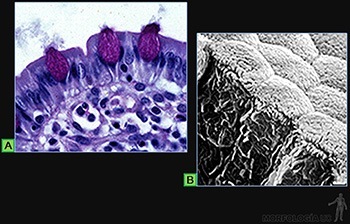
Figura 3-14
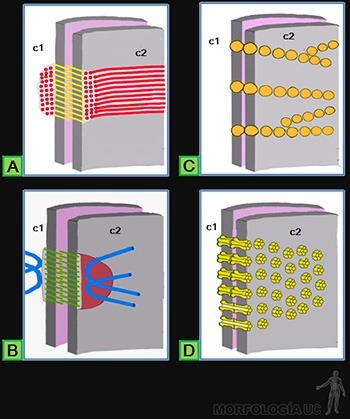
Figura 3-15
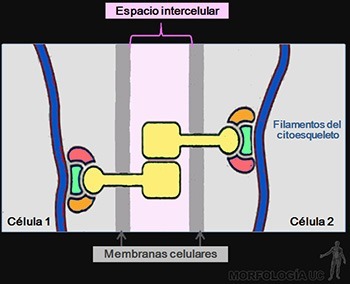
Figura 3-16
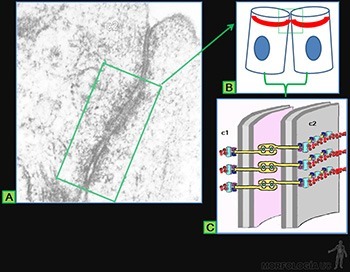
Figura 3-17
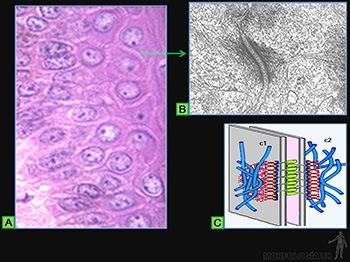
Figura 3-18
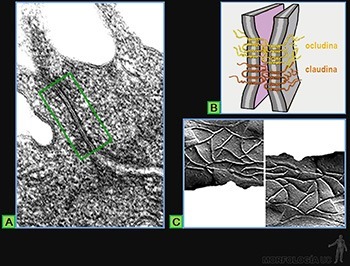
Figura 3-19

Figura 3-20
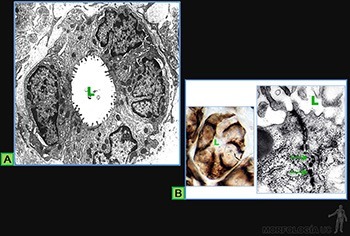
Figura 3-21
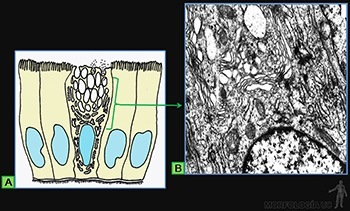
Figura 3-22
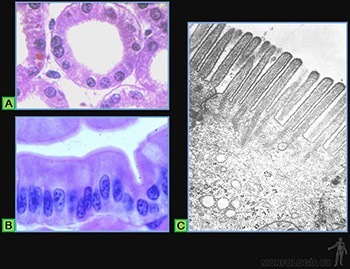
Figura 3-23
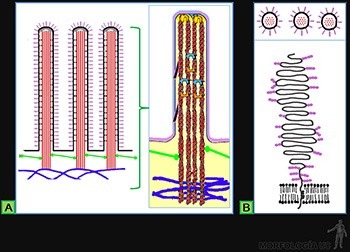
Figura 3-24
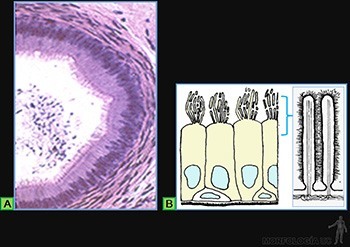
Figura 3-25
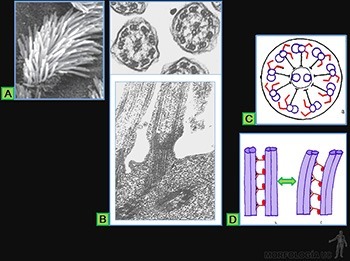
Figura 3-26
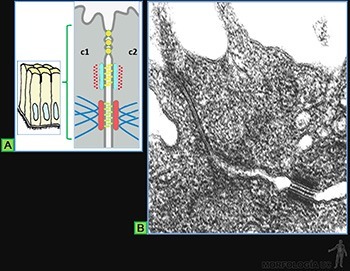
Figura 3-27
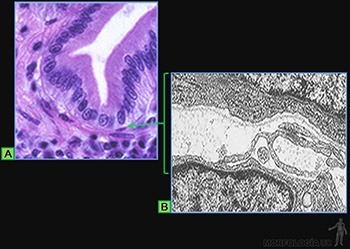
Figura 3-28
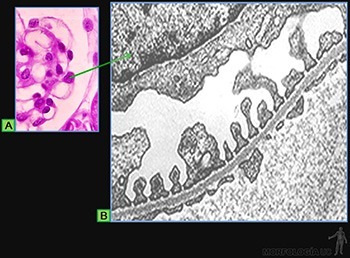
Figura 3-29
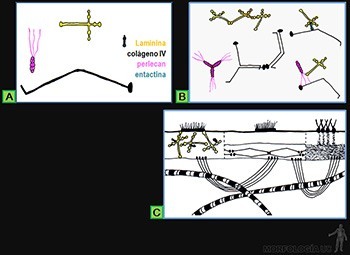
Figura 3-30
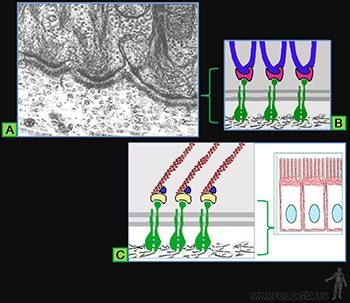
Figura 3-31
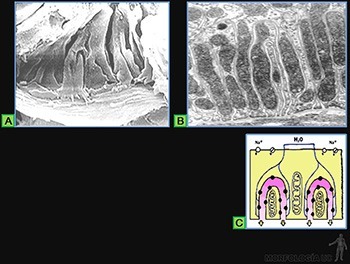
Figura 3-32
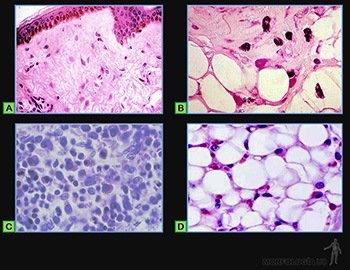
Figura 3-33
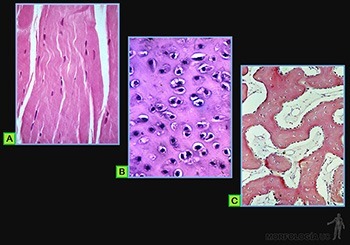
Figura 3-34
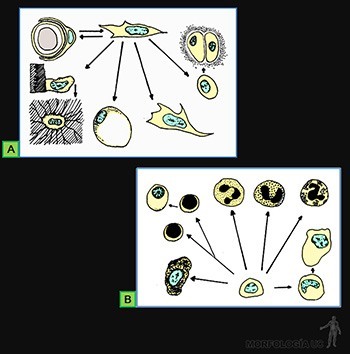
Figura 3-35
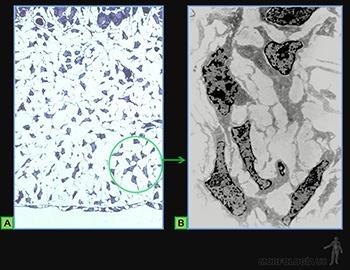
Figura 3-36
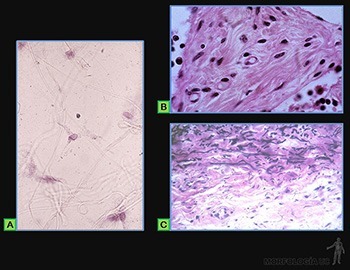
Figura 3-37
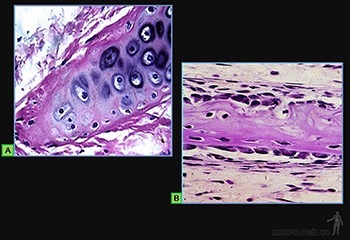
Figura 3-38
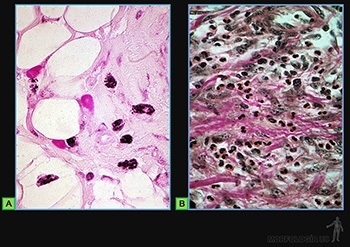
Figura 3-39
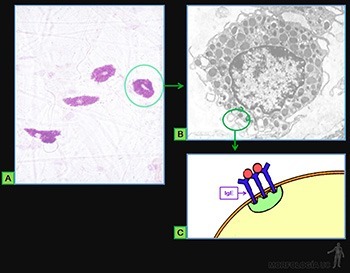
Figura 3-40
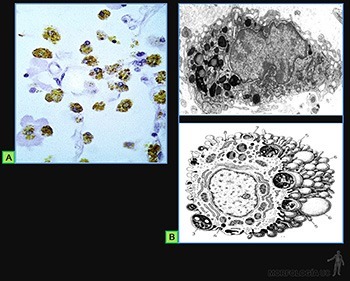
Figura 3-41
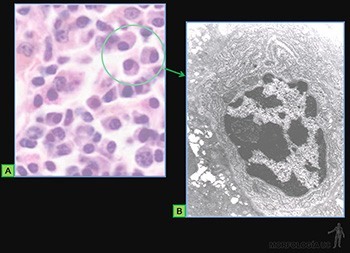
Figura 3-42
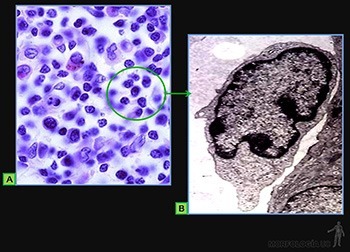
Figura 3-43
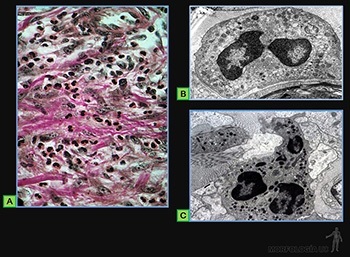
Figura 3-44
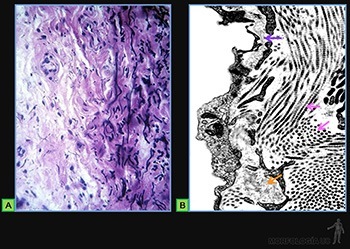
Figura 3-45
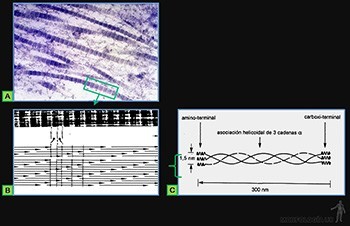
Figura 3-46
Figura 3-47
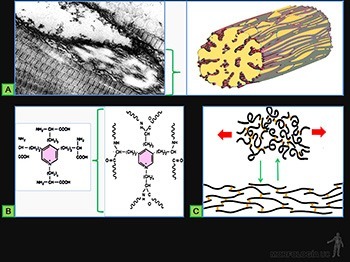
Figura 3-48
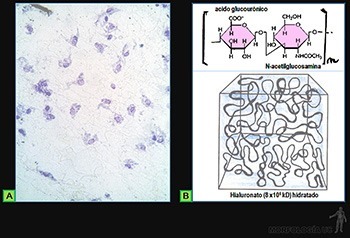
Figura 3-49
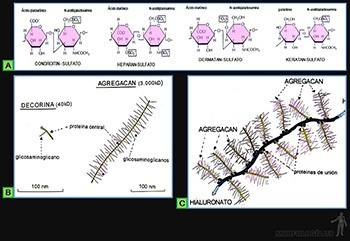
Figura 3-50
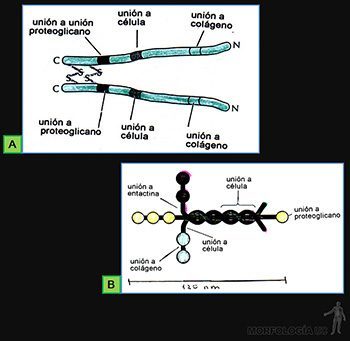
Figura 3-51
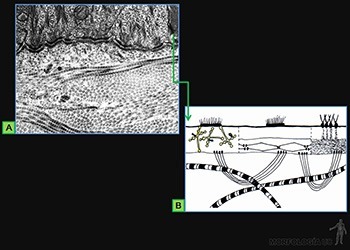
Figura 3-52
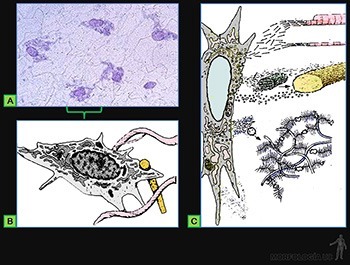
Figura 3-53
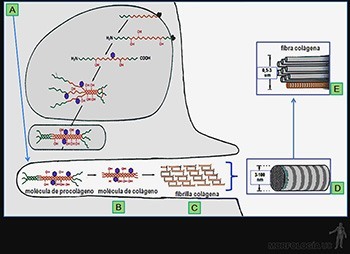
Figura 3-54
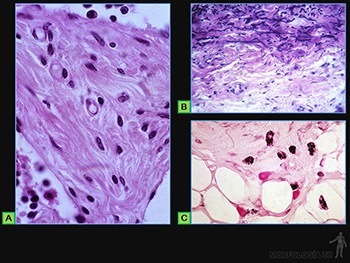
Figura 3-55
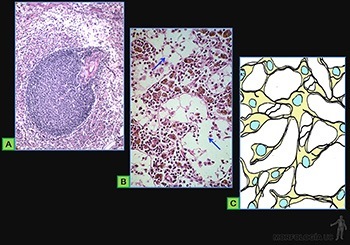
Figura 3-56
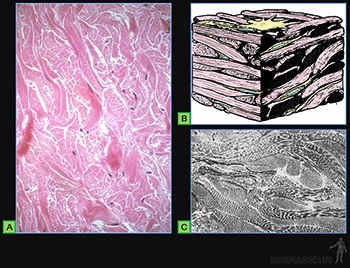
Figura 3-57
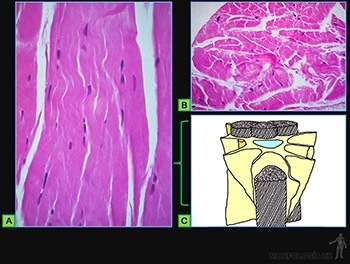
Figura 3-58
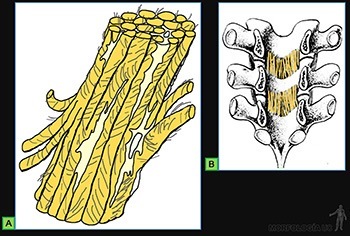
Figura 3-59
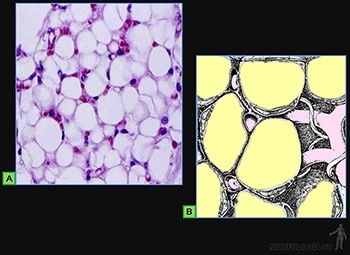
Figura 3-60
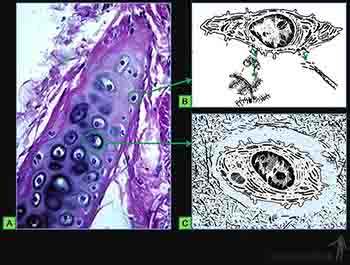
Figura 3-61
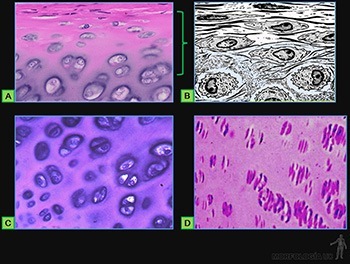
Figura 3-62
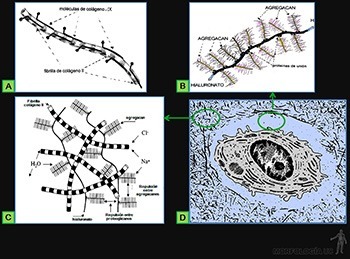
Figura 3-63
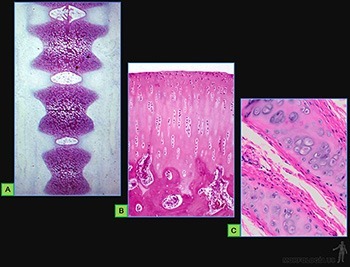
Figura 3-64
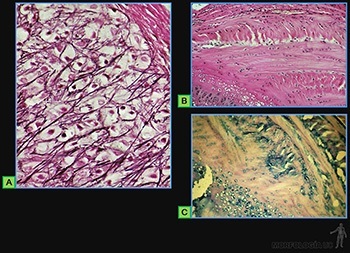
Figura 3-65
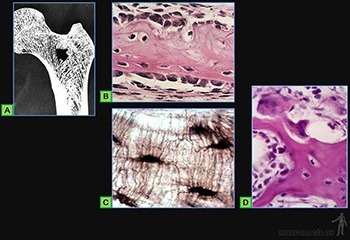
Figura 3-66
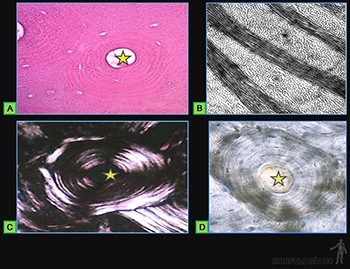
Figura 3-67
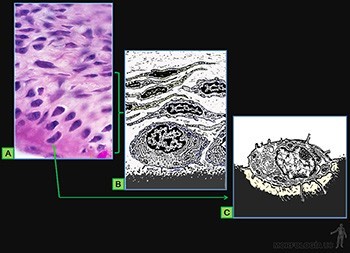
Figura 3-68
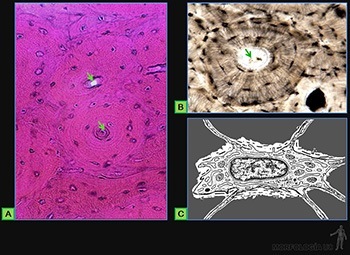
Figura 3-69
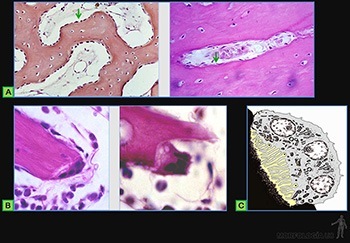
Figura 3-70
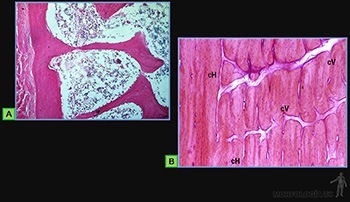
Figura 3-71
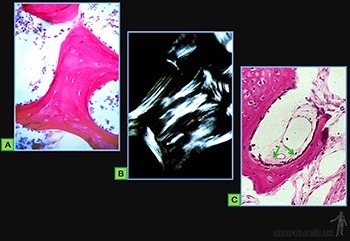
Figura 3-72
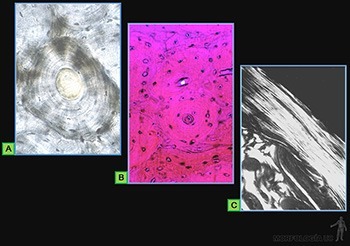
Figura 3-73
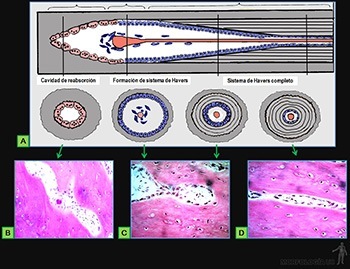
Figura 3-74
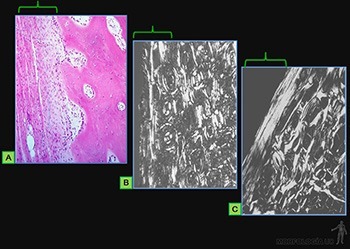
Figura 3-75
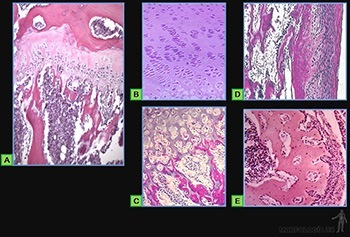
Figura 3-76
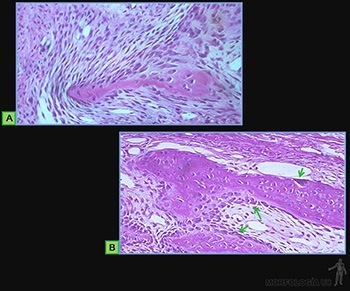
Figura 3-77
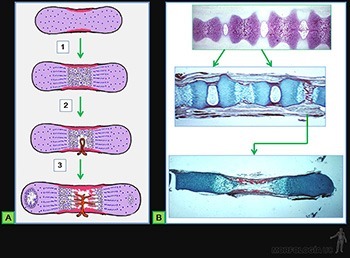
Figura 3-78
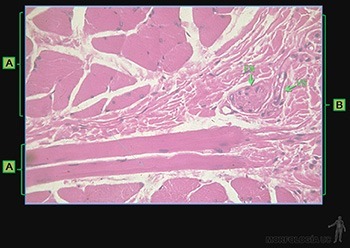
Figura 3-79
Figura 3-80
Figura 3-81
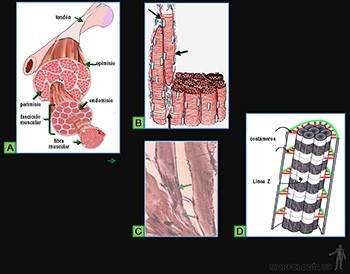
Figura 3-82

Figura 3-83
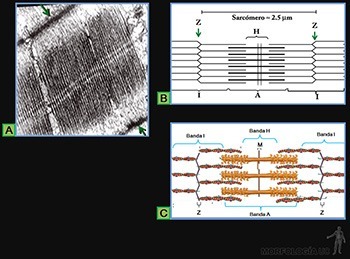
Figura 3-84
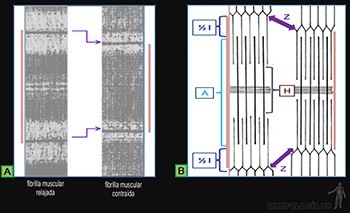
Figura 3-85
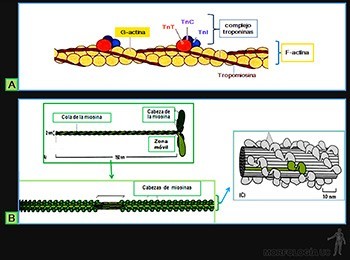
Figura 3-86
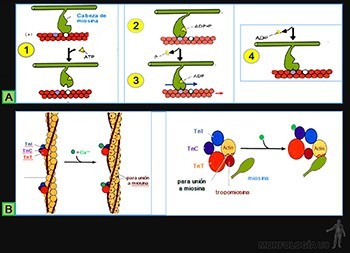
Figura 3-87
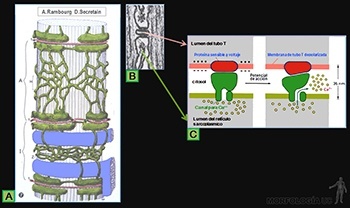
Figura 3-88

Figura 3-89
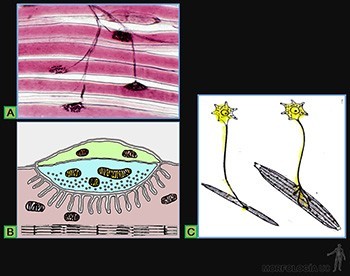
Figura 3-90
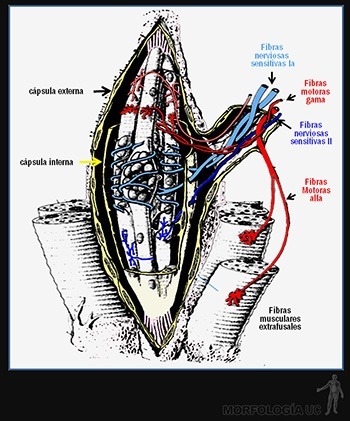
Figura 3-91
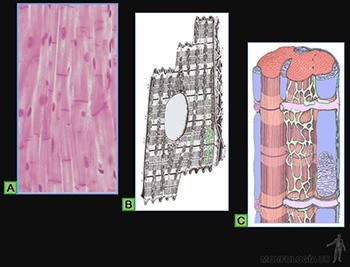
Figura 3-92
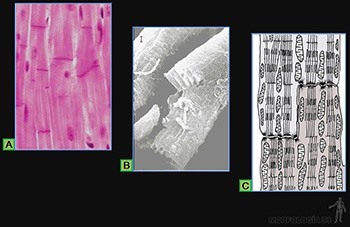
Figura 3-93
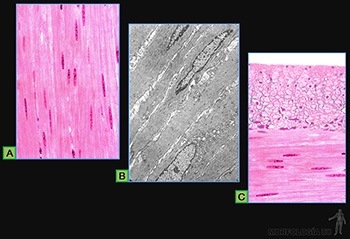
Figura 3-94
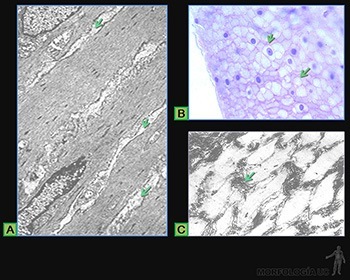
Figura 3-95
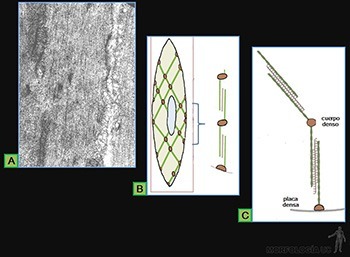
Figura 3-96
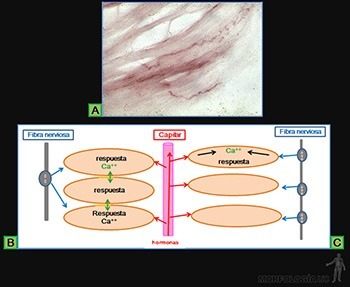
Figura 3-97
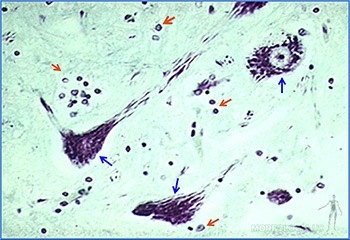
Figura 3-98
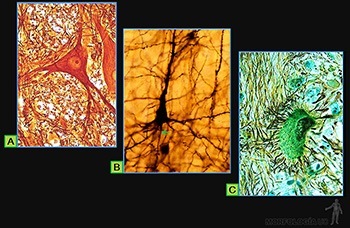
Figura 3-99

Figura 3-100
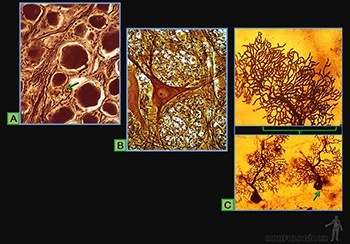
Figura 3-101
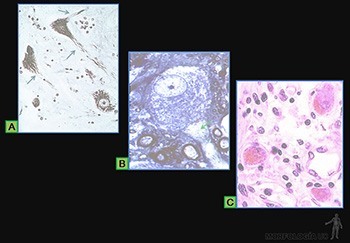
Figura 3-102

Figura 3-103
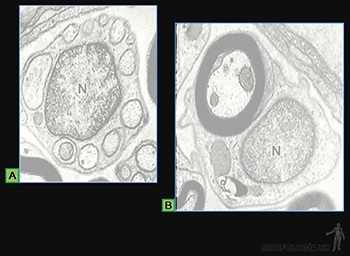
Figura 3-104
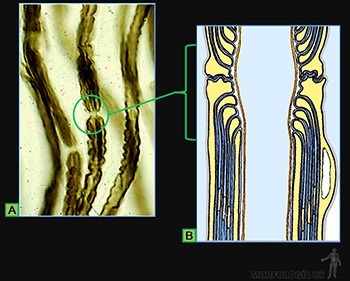
Figura 3-105
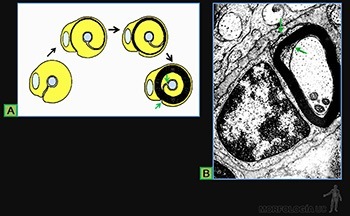
Figura 3-106
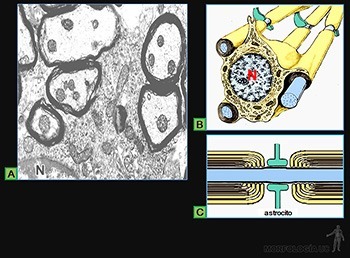
Figura 3-107
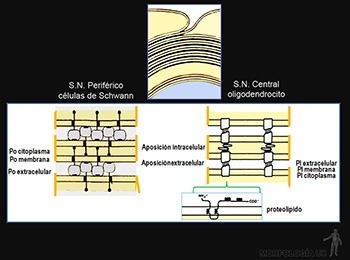
Figura 3-108
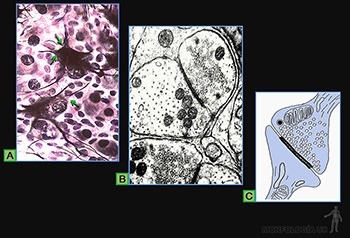
Figura 3-109
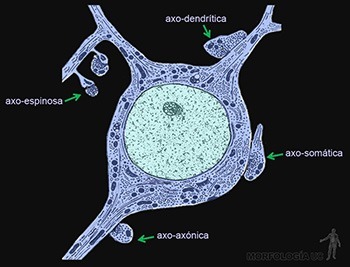
Figura 3-110
Figura 3-111
Figura 3-112
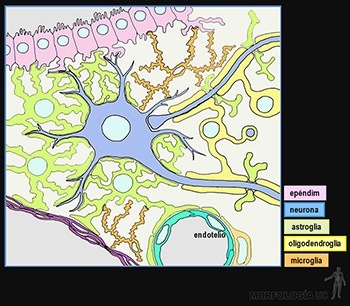
Figura 3-113
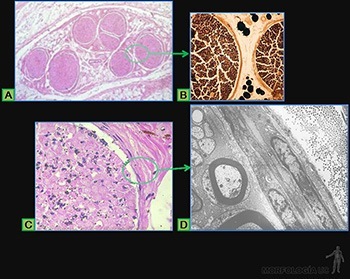
Figura 3-114
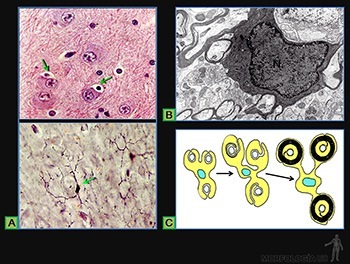
Figura 3-115
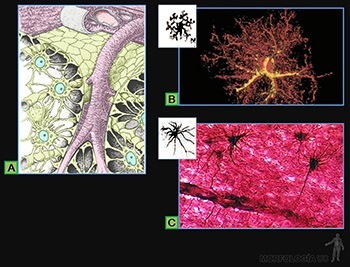
Figura 3-116
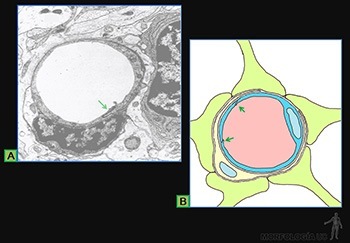
Figura 3-117
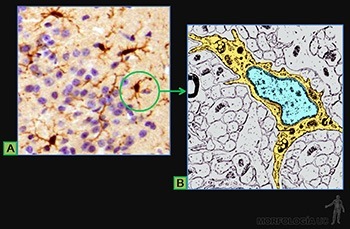
Figura 3-118
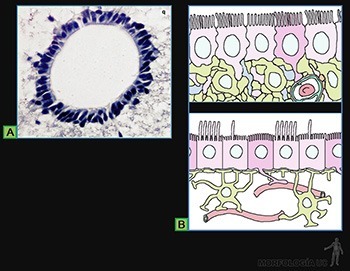
Figura 3-119
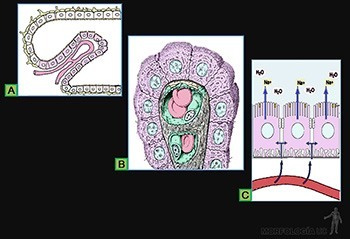
Figura 3-120
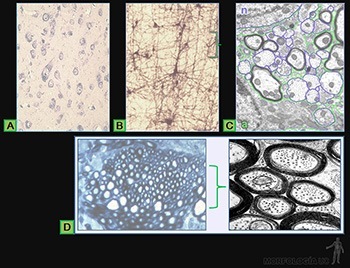
Figura 3-121
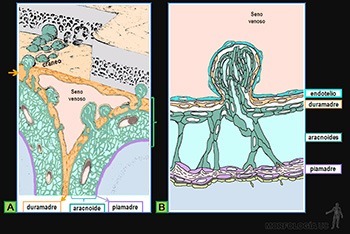
Figura 3-122