
Para desempañar operaciones con máquinas e instalaciones, ya sean de preparación, acondicionamiento, mantenimiento o reparación en una planta química, se deben adquirir al menos unos conocimientos mínimos sobre calor, temperatura, fluidos y electricidad que son la base del funcionamiento de estas máquinas e instalaciones.
Para ello es importante entender todo lo relativo a los conceptos de calor, temperatura y transferencia de calor, además de todas las características, propiedades y procesos relacionados con ellos.
Para los fluidos es conveniente conocer su naturaleza, sus propiedades y aspectos concretos como estática de fluidos, ecuación de estados de los gases o problemas relativos al manejo de estos.
Y por último, para la electricidad es necesario adquirir conceptos relacionados con la corriente eléctrica, tipos de corriente, propiedades, características y representación gráfica de sus instalaciones y máquinas.
En todas las plantas químicas se producen multitud de procesos donde el calor y la temperatura están relacionados o son variables fundamentales de estos. Por ello es necesario conocer qué es el calor y la temperatura y cómo se lleva a cabo el proceso de transferencia de calor.
2.1. Naturaleza del calor
En la actualidad se sabe que los átomos y las moléculas (que son grupos de átomos) que forman la materia están en constante movimiento vibrando, rotando sobre sí mismos o chocando entre ellos, aunque el cuerpo que los constituye esté quieto.

Definición
Calor
Es la energía que posee un cuerpo debido al movimiento constante de sus átomos y moléculas.
El calor es la energía asociada a este movimiento y por tanto la suma de las energías de las partículas que componen un cuerpo.
El calor está presente en todo tipo de materia independientemente de su estado y condiciones en las que se encuentre y, por tanto, todos los cuerpos tienen calor aunque estén a muy baja temperatura.
Además, también se sabe que los cuerpos pueden calentarse haciendo que se incremente la velocidad de sus átomos o moléculas y, por tanto, su calor, o enfriarse, es decir, disminuir la velocidad y, por tanto, su calor.
Si se introduce energía en un sistema, este se calienta y si elimina energía, se enfría. Por ejemplo, si una persona está fría se puede poner a correr para entrar en calor, o si bota una pelota, la energía de su movimiento se convierte en energía térmica o calor, que hace que cada vez rebote menos.
2.2. Diferencia entre calor y temperatura
La temperatura a la que se encuentra un cuerpo está, por tanto, relacionada con el calor, ya que mientras el calor es la energía total del movimiento de átomos y moléculas en una sustancia, la temperatura es una medida de la energía molecular media.

Definición
Temperatura
Es el valor medio de la energía de los átomos y moléculas de una sustancia, debido a su constante movimiento.
Además, el calor hace que la temperatura aumente o disminuya, ya que si se añade calor a una sustancia, la temperatura aumenta, y si se quita calor, la temperatura disminuye. Por todo ello, las temperaturas más altas tienen lugar cuando las moléculas se están moviendo, vibrando y rotando con mayor energía.
La temperatura se puede medir con los termómetros, y con este valor se podrá conocer la cantidad de calor que contiene un cuerpo.

Termómetro
Además, mientras el calor depende de la velocidad de las partículas, su número, su tamaño y su tipo, la temperatura no depende del tamaño, ni del número, ni del tipo de partículas. Por ejemplo, la temperatura de una botella de agua puede ser la misma que la temperatura de un depósito de agua, pero el depósito tiene más calor porque tiene más agua y, por lo tanto, más energía térmica total.
Por todo ello, se puede llegar a la conclusión de que calor y temperatura no son lo mismo, pero sí están íntimamente relacionados, y matemáticamente mediante la siguiente ecuación:
Q = c · M · t
Donde, en unidades del S.I.:

Recuerde
No es lo mismo calor que temperatura.
El calor es la energía total del movimiento de átomos y moléculas en una sustancia y la temperatura es una medida de la energía molecular media.
El calor hace que la temperatura aumente o disminuya, ya que si se añade calor a una sustancia, la temperatura aumenta y viceversa.
2.3. Unidades de medida de calor y temperatura. Conversión de unidades
La unidad de energía y, por tanto, de calor en el Sistema Internacional de Unidades (S.I.U.) es el joule, que en castellano es el julio (J) y equivale a un newton por metro (N×m). En el Sistema Anglosajón de Unidades (S.A.U.) es la unidad térmica británica BTU (British Termal Unit), que es la cantidad de calor que se debe agregar a una libra de agua para aumentar su temperatura en un grado Fahrenheit. La relación entre ambos es:
1 BTU = 1.055,056 julios

Recuerde
Las unidades de calor son el julio, la caloría y el BTU.
Otra unidad de energía muy utilizada es la caloría (cal), que es la cantidad de energía que hay que suministrar a un gramo de agua para elevar su temperatura un grado Celsius, y cuya relación con el julio y con el BTU es:
1 cal = 4,187 J
252 cal = 1 BTU
Las escalas de medición de la temperatura se dividen en dos tipos, las absolutas y las relativas.

Recuerde
Las unidades de temperatura más usuales son el grado Kelvin y el grado Rankine como temperaturas absolutas, y el grado Celsius y el grado Fahrenheit como temperatura relativa.
Las escalas relativas tienen temperaturas negativas y las absolutas no, y la temperatura absoluta es igual a la temperatura relativa más la temperatura absoluta del cero elegido en la escala de la temperatura relativa. Por ejemplo, ºK = °C + 273,15, ya que 0 ºC son 273,15 ºK.
En el S.I. se utiliza como escala absoluta el grado Kelvin y como escala relativa el grado Celsius:
En el S.A. se tiene como escala absoluta el grado Rankine y como escala relativa el grado Fahrenheit:
La relación entre las distintas unidades respecto a los grados Celsius es:
| ºC = ºK – 273,15 | ºK = °C + 273,15 |
| ºC = (°F - 32) · 5/9 | ºF = ºC · 9/5 + 32 |
| ºC = (ºR - 491,67) · 5/9 | ºR = (ºC + 273,15) · 9/5 |
2.4. Transferencia de calor. Principios. Aplicaciones en la planta química
En multitud de operaciones en las plantas químicas se producen emisiones o absorciones de energía en forma de calor. Por ello, el estudio de la transferencia de calor y de sus aplicaciones tiene tanta importancia para esta actividad.
El calor como forma de transmisión de la energía
Se sabe que si se ponen en contacto dos objetos que tienen diferente temperatura se produce un flujo o transferencia de energía desde el más caliente al más frío hasta que ambos objetos alcancen la misma temperatura.
Esta energía transferida, debido a una diferencia de temperaturas de un cuerpo a otro se hace en forma de calor y se denomina transmisión o transferencia de calor.
Esto se debe a que la diferencia de temperaturas actúa como fuerza impulsora de la energía de un objeto de mayor temperatura a uno de menor.

Nota
Sin embargo, si se ponen en contacto dos objetos con la misma temperatura no habrá transferencia de energía porque la energía media de las partículas en cada objeto es la misma, y, por tanto, no hay fuerza impulsora.
Siempre que exista una diferencia de temperaturas en un cuerpo o entre cuerpos se dará una transferencia de calor y el cuerpo más caliente reducirá su temperatura y el más frío la aumentará hasta que ambos tengan la misma temperatura y se encuentren en lo que se denomina equilibrio térmico.
Además, a mayor gradiente de temperaturas o diferencia de temperaturas, mayor será la velocidad de transferencia de calor.
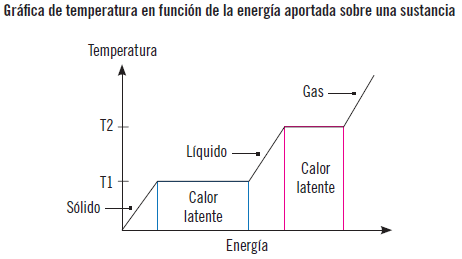
Estados de la materia (cambios de estado)
La materia se presenta en la naturaleza en forma de tres fases o estados diferentes según sea la energía intermolecular o el calor que posea: sólido, líquido y gaseoso. Hay un cuarto estado que es el plasma, pero tiene poca incidencia para esta actividad.
En el estado sólido las fuerzas de atracción intermolecular o de cohesión son muy fuertes, y mantiene su volumen y su forma definida. Sus partículas se ordenan en redes cristalinas y están dotadas de movimiento de vibración. Ejemplo: el hielo.

En el estado líquido las fuerzas de atracción intermolecular no son tan grandes y mantienen su volumen, pero adoptan la forma del recipiente que lo contiene mostrando una superficie libre. Sus partículas tienen libertad de movimiento pero están muy juntas. Ejemplo: el agua.
En el estado gaseoso las fuerzas de cohesión son tan débiles que el gas no tiene ni forma ni volumen propio, adoptan la forma del recipiente que los contiene y ocupan todo su volumen. Sus partículas tienen libertad de movimiento y están muy separadas debido a la fuerza de cohesión tan débil. Ejemplo: el vapor de agua.

Sabía que...
Se denominan vapores a aquellos gases que en condiciones normales de presión y temperatura, es decir, 1 atm y temperatura ambiente respectivamente, tienen como estado normal el estado líquido. Por ejemplo, el vapor de agua.
Si a un cuerpo en estado sólido se le aporta calor, aumentará su energía interna, logrando que sus moléculas puedan vencer determinadas fuerzas de cohesión, obteniéndose el estado líquido. Si se continúa aportando calor se llega a un punto en que la energía molecular es superior a las fuerzas de cohesión, rompiéndose totalmente estas y alcanzándose el estado gaseoso de la materia.
Por tanto, aportando calor a un cuerpo, este puede pasar de sólido a líquido y a gas, y de forma inversa, al enfriarlo se recorrerá el camino en sentido contrario. Estos son los cambios de estado más usuales, aunque se puede cambiar de estado de sólido a gas y de gas a sólido, aportando calor y enfriando respectivamente.

Importante
Se debe tener en cuenta que en estos cambios de fase no se producen transformaciones de estas sustancias en otras, son las mismas sustancias pero en otro estado.
Las diferentes transformaciones o cambios de fase en la materia son los que aparecen en la siguiente tabla.
| Fusión | Proceso físico por el que una sustancia en estado sólido pasa a estado líquido mediante aporte de calor. La temperatura a la que el sólido se funde se denomina punto de fusión y es un valor particular para cada sustancia. |
|---|---|
| Solidificación | Proceso físico por el que una sustancia en estado líquido pasa a estado sólido mediante un enfriamiento. |
| Vaporización | Proceso físico por el que una sustancia en estado líquido pasa a estado gaseoso. La temperatura a la que el líquido se vaporiza se denomina punto de ebullición y es un valor particular para cada sustancia y depende de la presión a la que se encuentre esta. |
| Condensación | Proceso físico por el que una sustancia en estado gaseoso pasa a estado líquido. |
| Sublimación | Proceso físico por el que una sustancia en estado sólido pasa a estado gaseoso sin pasar por el estado líquido. |
| Cristalización | Proceso físico por el que una sustancia en estado gaseoso pasa a estado sólido, sin pasar por el estado líquido. |

Nota
Son procesos exotérmicos aquellos que desprenden energía o calor como la condensación, la solidificación o la cristalización. Son procesos endotérmicos aquellos que necesitan energía o calor para producirse como la fusión, la vaporización o la sublimación.
Propiedades térmicas de los productos (calor de fusión, calor de vaporización, calor específico)
Las propiedades térmicas que tiene cualquier sustancia son: calor de fusión, calor de vaporización y calor específico.
Calor de fusión y calor de vaporización
Como ya se sabe, una sustancia experimenta un cambio de temperatura cuando se calienta o se enfría, es decir, cuando absorbe o cede calor al ambiente que le rodea. A este calor se le denomina calor sensible.
Sin embargo, en el momento de cambio de fase, una sustancia absorbe o cede calor sin que se produzca un cambio de su temperatura. El calor que es necesario aportar o quitar para que una sustancia cambie de estado se denomina calor de cambio de estado o calor latente de la sustancia, y depende del tipo de cambio de fase.
La suma del calor sensible y calor latente se llama calor total o entalpía.
Los valores de calor de cambio de estados se establecen en las unidades de medida de kilojulios por kilogramo (KJ×Kg-1) o kilocalorías por kilogramos (Kcal×Kg-1) en el S.I., o en BTU por libra en el S.A. (BTU×lb-1).

Ejemplo
Cuando se aplica calor (calor sensible) a un bloque de hielo a -25 ºC, va aumentando su temperatura hasta llegar a 0 ºC que es su temperatura de cambio de fase. A partir de entonces, aunque se le siga aplicando calor (calor de cambio de fase), la temperatura no cambia hasta que se haya fundido todo el hielo. Esto se debe a que el calor se emplea en la fusión del hielo. Una vez fundido el hielo, el calor (calor sensible) aplicado volverá a subir la temperatura hasta llegar a 100 °C. En ese momento, si se aplica calor (calor de cambio de fase) se mantendrá la temperatura invariable hasta que se evapore toda el agua. A partir de ese momento, si se aplica calor (calor sensible) seguirá aumentando la temperatura del vapor de agua.
El calor de cambio de estado, si se utiliza para cambiar el estado de sólido a líquido, se denomina calor de fusión, y si es para cambiarlo de líquido a gaseoso, calor de vaporización. Al cambiar de estado gaseoso a líquido y de líquido a sólido se libera la misma cantidad de energía que el calor de vaporización y fusión respectivamente. En esos casos se denominan calor de condensación y de solidificación, pero no son tan conocidos como los anteriores.

Recuerde
Calor de fusión es el calor de cambio de estado para pasar del estado sólido al líquido.
Calor de vaporización es el calor de cambio de estado para pasar del estado líquido al gaseoso.
Calor específico
Como se sabe, cuando una cuchara metálica se deja en un plato de sopa caliente su temperatura sube rápidamente, lo que no ocurriría si la cuchara fuese de madera. Por tanto, no todas las sustancias aumentan su temperatura de igual manera cuando se les aporta la misma cantidad de calor.
Esto ha llevado a definir dos magnitudes, la capacidad calorífica y el calor específico.

Definición
Capacidad calorífica
Es la cantidad de energía que hay que aportar a una sustancia para aumentar su temperatura en una unidad, es decir, en un grado.
La capacidad calorífica indica la mayor o menor dificultad que tiene toda la masa de una sustancia para experimentar cambios de temperatura cuando se le suministra calor. Depende no solo de la sustancia a la que se aporta calor sino también de la cantidad de masa de la sustancia, es decir, es característico de un cuerpo concreto.

Ejemplo
La capacidad calorífica de un tanque de almacenamiento de agua es mayor que la de una botella de agua, ya que al primero hay que aportarle mucha más energía para aumentar su temperatura un grado.
Su unidad de medida en el S.I. es el julio por grado Celsius (J · ºC-1), aunque también se utiliza calorías por grado Celsius (Cal · ºC-1). En el S.A. su unidad de medida es el BTU por gado Fahrenheit (BTU · ºF-1).
El calor específico es una propiedad que tienen las sustancias, independientemente de su tamaño, que indica la mayor o menor dificultad para experimentar cambios de temperatura cuando se le suministra calor. Depende solo de la sustancia a la que se aporta calor y, por ello, es característica de una sustancia concreta.

Definición
Calor específico
Es la energía necesaria que hay que aportar a una unidad de masa de una sustancia para aumentar su temperatura en una unidad, es decir, en un grado.
Cuanto mayor sea el calor específico de una sustancia, más calor se necesita para aumentar la temperatura.
Con anterioridad se llegó a relacionar el calor (Q) de una sustancia con su temperatura (t), su masa (M) y su calor específico (c) por medio de la ecuación:
Q = c · M · t
Por tanto, si se quiere calcular el calor absorbido o emitido por una sustancia, se deberá utilizar la ecuación anterior teniendo en cuenta la temperatura final (tf) e inicial (ti) de la sustancia, mediante:
Q = c · M · (tf - ti )
Si el calor se absorbe, la temperatura final es mayor que la inicial, por lo que el valor del calor es positivo, y si se emite, será negativo.

Nota
Como ya se sabe, la unidad de medida del calor específico en el S.I. es el julio por kilogramo y por grado Celsius (Kcal · gr · K-1), pero como en la práctica esta unidad es relativamente pequeña se utiliza kilocalorías por gramo y por grado kelvin (Kcal · gr-1 · ºK-1). Su unidad de medida en el S.A. es el BTU por libra y por grados Fahrenheit (BTU · lb-1 · ºF-1).
Para medir el calor específico y las cantidades de calor que absorben y liberan los cuerpos se utiliza el calorímetro.
Mecanismos de transferencia de calor (conducción, convección, radiación)
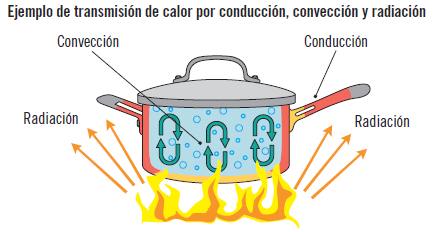
La transmisión de calor siempre se produce desde el cuerpo más caliente al más frío hasta que ambos alcanzan la misma temperatura. Este proceso se puede llevar a cabo mediante tres mecanismos diferentes, aunque con frecuencia aparecen simultáneamente:
Conducción
El calor se transmite por conducción cuando se produce en un sólido la transferencia de energía desde las partículas más energéticas como resultado de interacciones entre estas partículas y sin que se produzca transferencia de masa.

Nota
Las sustancias tienen distinta conductividad térmica, es decir, capacidad para conducir calor, existiendo materiales conductores térmicos y aislantes térmicos.
Los conductores térmicos son aquellas sustancias que transmiten rápidamente la energía térmica de un punto a otro, como, por ejemplo, los metales.
Los aislantes térmicos son aquellas sustancias que transmiten lentamente la energía térmica de un punto a otro, como, por ejemplo, el vidrio, la madera o el corcho.
Estas interacciones en los sólidos se producen porque los átomos y moléculas de la zona que se calienta empiezan a vibrar más rápido y chocan con las partículas vecinas transmitiendo esa energía térmica. En los líquidos y gases es debido a las colisiones de las moléculas de mayor energía con las de menor energía mientras están en movimiento continuo.

Ejemplo
Cuando se calienta un extremo de una varilla metálica, el calor llega al otro extremo sin que haya movimiento alguno de la masa que constituye la varilla.
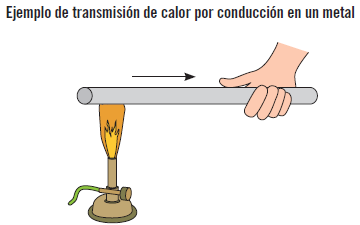
La velocidad de transferencia de calor o rapidez con que el calor se transmite a través de un medio en conducción depende del material del que esté hecho, de su espesor, de su configuración geométrica y de la diferencia de temperaturas a través de él.

Ejemplo
Si en una planta hay un depósito de agua caliente, si este está recubierto de fibra de vidrio que es un buen material aislante, tardará más tiempo en disiparse el calor acumulado que si no tiene ningún aislante. Cuanto más grueso sea el material aislante, menos rápida será la pérdida de calor. Además, cuanto más grande sea o mayor área superficial tenga por su configuración geométrica (para un mismo volumen un depósito con forma de cilindro tiene más superficie que uno esférico), más rápida será la pérdida de calor. Y por último, cuanto menor sea la temperatura en el lugar donde se encuentre el depósito, antes se producirá la pérdida de calor.
Convección
El calor se transmite por convección cuando este se transfiere de un punto a otro de un fluido, líquido o gas por el movimiento macroscópico de la masa del propio fluido, es decir, se transfiere calor mediante el transporte de materia.
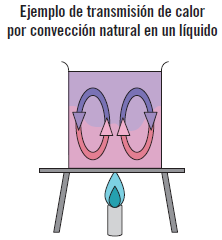
Si el movimiento del fluido es forzado mediante medios externos como un agitador, un ventilador o una bomba, la convección se denomina convección forzada, y si el movimiento del fluido es causado por la diferencia de densidades creadas por la diferencia de temperatura existente en la masa del fluido se le denomina convección natural. Claramente, la convección forzada favorece mejor la transferencia de calor que la convección natural.

Ejemplo
Convección natural: si se calienta agua en un recipiente, el agua que está en el fondo se calentará antes, disminuyendo su densidad (la densidad disminuye con el aumento de la temperatura) y ascendiendo, y el agua de la superficie que se encuentra más fría y tiene mayor densidad, desciende, dando lugar a un proceso cíclico. Convección forzada: si se agrega al recipiente un agitador eléctrico que aumente el movimiento del agua favorecerá más la transferencia de calor, y se llevará a cabo antes.
Radiación
La radiación térmica es la energía emitida en forma de ondas electromagnéticas por la superficie de un cuerpo que ha sido excitado térmicamente.
Esta radiación térmica se emite en todas las direcciones, se propaga con la velocidad de la luz y si choca contra otro cuerpo, puede ser reflejada, transmitida o absorbida por este. No exige medio de transporte propagándose incluso a través del vacío.

Ejemplo
El sol transmite su calor por radiación, ya que las ondas electromagnéticas se propagan en el aire e incluso en el vacío.

Todos los cuerpos radian energía en función de su temperatura. Cuanto mayor sea la temperatura, mayor será la energía de la radiación que emiten.
Aplicaciones de la transferencia de calor en la planta química
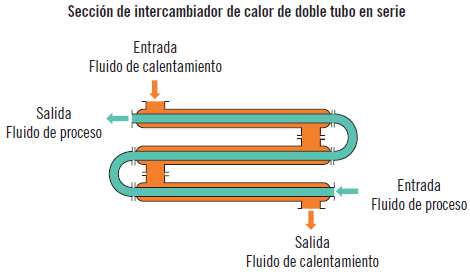
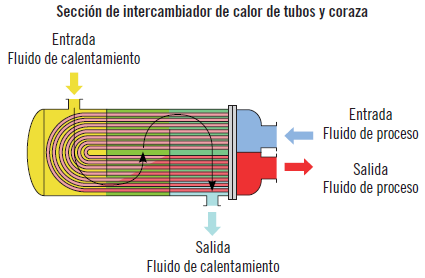
En las plantas químicas el calor se transfiere por medio de una variedad de equipos diseñados con el propósito de analizar la transferencia de calor. Entre estos se encuentran los intercambiadores de calor, las calderas, los condensadores, los hornos, los calentadores de resistencia eléctrica o los secadores de calor radiante. En este apartado se va a estudiar el intercambiador de calor que es el equipo que presenta mayor interés en relación con la transferencia de calor por su uso habitual en cualquier planta química.
Intercambiadores de calor
La transferencia de calor entre dos fluido casi siempre se produce en los intercambiadores de calor. Son equipos que facilitan el intercambio de este entre dos fluidos que están a diferente temperatura y al mismo tiempo evitan que se mezclen entre sí. La transferencia de calor se produce por convección en el fluido y por conducción a través de la pared que los separa. Fundamentalmente existen tres tipos de intercambiadores de calor:
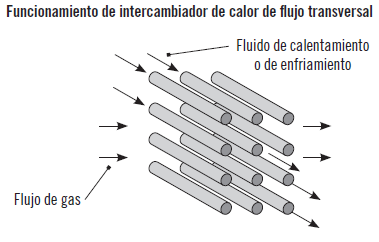

Aplicación práctica
Calcule el calor en BTU necesario para elevar la temperatura de 5 l de agua de 25 ºC a 75 ºC, siendo el calor específico del agua 1 cal · g-1 · ºK-1 y la densidad del agua 1.000 g/l.
SOLUCIÓN
Teniendo en cuenta que la densidad del agua es 1.000 g/l, 5 l de agua son M = 5 · 1.000 = 5.000 g de agua.
Por otro lado, tf = 75 ºC son 273,15 + 75 = 348,15 ºK y ti = 25 ºC son 273,15 + 25 = 298,15 ºK.
La ecuación que relaciona el calor que necesita una sustancia con el calor específico de la misma, su masa y la diferencia de temperaturas es:
Q = c · M · (tf - ti ) = 1 5.000 · (348,15 – 298,15) = 250.000 cal = 250 Kcal
Mediante una simple regla de tres se puede calcular los BTU:
Si 252 cal son 1 BTU, entonces 250.000 cal serán X BTU
Por tanto X que será el calor en BTU será:
Q = 250.000 · 1 / 252 = 992 BTU

Aplicación práctica
¿Qué tipos de mecanismos de transferencia de calor se producen en un intercambiador de calor? ¿Cómo se llevan a cabo?
SOLUCIÓN
Intercambiador de calor:
En cualquier planta química, los procesos se llevan a cabo mediante la manipulación o manejo de fluidos a través de tuberías, bombas, etc., de ahí la importancia de estos, y su obligado estudio. La ciencia que estudia el comportamiento de los fluidos es la mecánica de fluidos, independientemente de que estén en reposo (estática de fluidos) o en movimiento (dinámica de fluidos).
3.1. Introducción. Naturaleza de los fluidos. Estados de agregación de la materia
Como se sabe, la materia se presenta esencialmente bajo tres formas o estados de agregación diferentes: el estado sólido, el estado líquido y el estado gaseoso. Los fluidos son las sustancias que están en fase líquida o en fase gaseosa.

Definición
Fluido
Es toda sustancia que no sea sólida y que pueda fluir, es decir, los líquidos y los gases.
Cada uno de estos estados presenta unas condiciones o naturaleza directamente observables que les son características.
Una distinción entre los sólidos y los fluidos es la diferente respuesta frente a la acción de un esfuerzo cortante (fuerza por unidad de área), es decir, la fuerza tangencial que actúa sobre una superficie. Los sólidos inicialmente se deforman mientras persiste el esfuerzo, ya que oponen una fuerza igual y de sentido contrario a la aplicada, y tienden a recuperar su forma primitiva total o parcialmente cuando cesa el esfuerzo. Sin embargo, los fluidos se deforman o cambian de forma de manera continua, mientras persista dicho esfuerzo, ya que no presentan una fuerza que se oponga a la aplicada, lo que indica que no hay tendencia a recuperar la forma primitiva al cesar el esfuerzo aplicado.

Ejemplo
Si se coge con las dos manos una goma de borrar y se dobla, se deforma inicialmente, y si se deja de doblar vuelve a su forma inicial. Por el contrario, si se coge una bolsa llena de agua con las dos manos y se hace lo mismo, cuando se deje de doblar no vuelve a la forma original.
Respecto a los fluidos, los líquidos poseen un volumen propio que se mantiene prácticamente constante aunque adopten la forma del recipiente que los contiene, los gases en cambio, adoptan la forma del recipiente y además ocupan todo su volumen interior.
Si un líquido se almacena en un contenedor tiende a adoptar la forma de este, y cubre el fondo y las paredes laterales. En la superficie, en contacto con la atmósfera, mantiene un nivel uniforme. Cuando el contendor se inclina, el líquido tiende a derramarse.
Si se mantiene un gas a presión en un recipiente cerrado, tiende a expandirse y llenarse por completo. Si el contenedor se abriera, el gas tendería a expandirse aún más y a escapar de él.
Cuando un fluido fluye a través de un canal cerrado, como por ejemplo una tubería, pueden existir dos tipos de flujo en función de su velocidad. A velocidades bajas se produce el flujo laminar, caracterizado por fluir sin mezclado lateral, ni corrientes cruzadas perpendiculares al flujo o remolinos. Mientras que a altas velocidades se produce el flujo turbulento, es decir, se forman remolinos lo que provoca un mezclado lateral.
3.2. Propiedades de los fluidos: descripción, propiedades, clases, unidades, ecuaciones matemáticas
Para tener un adecuado conocimiento sobre fluidos es necesario aprender todo lo relativo a las propiedades de estos. Estas características se estudian a continuación.
Masa, peso específico y densidad. Viscosidad. Tensión superficial
Estas propiedades son esenciales para el estudio de los fluidos, por este motivo se detalla detenidamente cada una de ellas.
Masa, peso, densidad y peso específico
Para conocer estas propiedades, el primer paso es saber diferenciar el peso de la masa.

Definición
Masa
Es la medida de la cantidad de un fluido.
Peso
Es la cantidad que pesa un fluido, es decir, la fuerza con la que el fluido es atraído hacia la Tierra por la acción de la gravedad.
El peso es una fuerza y la masa es la cantidad de una sustancia. Ambos términos se relacionan por medio de la aplicación de la Ley de la Gravitación de Newton, en la que la fuerza (F) es igual a la masa (m) multiplicada por la aceleración (a), es decir:
F = m · a
Hablar del peso (P) implica que la aceleración es igual a la aceleración de la gravedad (g), y entonces la ecuación de Newton se transforma en:
P = m · g
Donde:
g = 9,81 m · s-2 en el S.I. y g = 32,17 pies · s-2 en el S.A.
La unidad de masa en el S.I. es el Kilogramo (Kg), y en el S.A. es la libra (lb). La unidad de peso en el S.I. es el newton (N) que equivale a un kilogramo metro por segundo al cuadrado (Kg · m · s-2), y la unidad en el S.A. es la libra fuerza (lbf) que equivale a una libra pie por segundo al cuadrado (lb · pie · s-2).
Puesto que se habla de fluidos, líquidos y gases, es conveniente relacionar la masa y el peso del fluido con su volumen. Para ello se definen las propiedades de la densidad y del peso específico.

Definición
Densidad
Es la cantidad de masa por unidad de volumen de una sustancia.
Peso específico
Es la cantidad de peso por unidad de volumen de una sustancia.
Si se denota la densidad con la letra griega ρ, se tiene:
ρ = m / V
Donde:
V es el volumen de la sustancia que tiene la masa m.
La unidad de la densidad en el S.I. es el kilogramo por metro cúbico (Kg · m-3), y en el S.A. es la libra por pie al cubo (lb · pie-3).
Si se denota el peso específico con la letra griega γ, entonces:
γ = P / V
Donde:
V es el volumen de una sustancia que tiene peso P.
La unidad del peso específico en el S.I. es el newton por metro cúbico (N · m-3), y en el S.A. es la libra fuerza por pie al cubo (lbf · pie-3).
La relación entre el peso específico y la densidad de una sustancia se lleva a cabo mediante la siguiente ecuación:
γ = r · g
Donde: g es la aceleración de la gravedad.
Esta ecuación se justifica teniendo en cuenta las definiciones de la densidad y el peso específico, junto con la ecuación que relaciona la masa y el peso.
Las propiedades de los fluidos varían con la temperatura. En general, la densidad y el peso específico disminuyen con el aumento de la temperatura.
Viscosidad
Cuando un fluido se mueve con respecto a un sólido o con respecto a otro fluido se produce una fricción o rozamiento en la dirección opuesta al movimiento del fluido, parecida a la que se produce sobre el suelo cuando se pretende mover una mesa de un lugar a otro. Por ello es necesario aplicar una fuerza suficiente en el sentido del flujo para poder vencer esta fricción.

Definición
Viscosidad
Es la propiedad que representa la resistencia interna de un fluido al movimiento o al fluir.

Ejemplo
Si se mueve un líquido encerrado entre dos placas paralelas muy largas y muy anchas, y se hace desplazar, por ejemplo, la placa superior paralelamente a la inferior por la aplicación de una fuerza (F) a una velocidad constante (v), el líquido en contacto con la placa superior se pega a la superficie de esta y se mueve con ella a la misma velocidad. Sin embargo, el líquido en contacto con la placa inferior toma la velocidad de esa placa que como no se desplaza, es cero. De esta manera se produce un perfil de velocidades desde la placa superior donde estaría la velocidad máxima (v) hasta la placa inferior con velocidad cero, es decir, la velocidad del líquido varía entre 0 y v de forma lineal
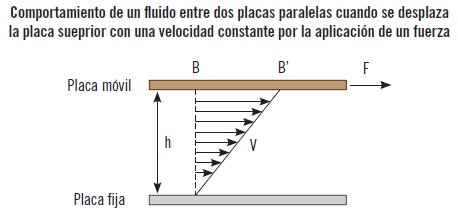
Esto se debe a la fuerza de fricción interna que se desarrolla en las diferentes capas del fluido a medida que se obligan a moverse una con relación a las otras. Esta medida de resistencia a la deformación del fluido o de rozamiento entre las capas del fluido por la fuerza que se aplica para moverlo es la viscosidad. Por tanto, la viscosidad sólo se produce con fluidos en movimiento y no con fluidos en reposo.
En los líquidos, la viscosidad se debe a las fuerzas de cohesión entre las moléculas que hace que aparezca esta fricción entre las capas, y en los gases por las colisiones que se producen entre las moléculas cuando se produce el movimiento del gas. Los líquidos son mucho más viscosos que los gases.

Nota
El aceite fluye más despacio que el agua porque tiene mayor viscosidad.
En general, la viscosidad de los líquidos decrece con la temperatura y en los gases aumenta gracias a ella. La dependencia respecto a la presión del fluido es baja.
La viscosidad se puede medir con un parámetro llamado coeficiente de viscosidad. Existen dos:
1 p = 100 cp = 0,1 Pa·s = 0,1 kg · m-1 · s-1 = 6,7197 · 10-2 lb · pie-1 · s-1
1 St = 0,0001 m · s-1 = 3,28 · 10-2 pie · s-1
Tensión superficial
Se ha observado que en la interfase entre un gas y un líquido o entre dos líquidos inmiscibles se crean fuerzas en la superficie del líquido que hacen que su superficie se comporte como una película, membrana o piel aunque esta no existe realmente.

Definición
Tensión superficial
Es la fuerza de atracción molecular por unidad de longitud unitaria a lo largo de cualquier línea de la superficie.
Por ejemplo, si se ponen gotas de mercurio en una superficie o si se aprecian las gotas de agua que caen de un grifo o una gota de sangre sobre un vidrio, estas tienen forma esférica casi perfecta debido a que las fuerzas de cohesión de las moléculas en su superficie tienden a mantenerlas juntas en una configuración compacta.
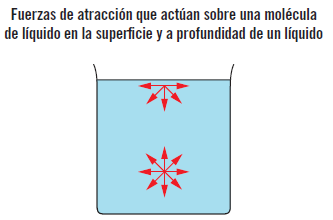
Es decir, las moléculas en el interior del líquido están rodeadas de moléculas que son atraídas entre sí de igual manera, de tal forma que en promedio se anulan. Pero las moléculas a lo largo de toda la superficie están sometidas a esa misma fuerza neta hacia el interior del líquido, ya que la fuerza que puede aplicar una molécula de gas hacia el exterior sobre las moléculas líquidas de la superficie es despreciable. Esa fuerza de tracción hacia el interior del líquido tiene como consecuencia física la creación de la hipotética membrana y que tiendan a aglutinarse reduciendo el número de moléculas en la superficie, y reduciendo al máximo el área o superficie del fluido, dando lugar a la forma esférica.
El valor de la tensión superficial depende de los fluidos en contacto y de la temperatura. En general, la tensión superficial de un líquido disminuye cuando aumenta la temperatura. El efecto de la presión sobre la tensión superficial es despreciable.
Los efectos de la tensión superficial solo son apreciables en fenómenos de pequeñas dimensiones, como en el caso de tubos capilares, burbujas, gotas y situaciones similares.
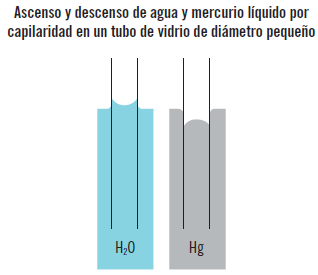

Sabía que...
El efecto de capilaridad es el ascenso o descenso de un líquido en un tubo de diámetro pequeño insertado en un líquido. La superficie libre curva de un líquido en un tubo capilar se llama menisco.
La tensión superficial de una sustancia puede cambiar de forma importante con la presencia de impurezas. Por tanto, a un líquido se le puede añadir algunos productos químicos, denominados surfactantes, para disminuir su tensión superficial.
La tensión superficial se denota por la letra griega s, y sus unidades son de fuerza por longitud, es decir, en el S.I. de newton por metro (N · m-1) y en el S.A. de libras-fuerza por pies (lbf · pie-1).
Presión. Concepto de presión
La presión (P) ejercida por un fluido vendrá expresada por la relación entre una fuerza (F) y la superficie (S) sobre la que dicha fuerza actúa:
P = F / S

Definición
Presión
Es la fuerza que ejerce un fluido por unidad de superficie.
Si se adopta como unidad de fuerza, por ejemplo, el newton (N), y como unidad de superficie el metro cuadrado (m2), todo ello según el S.I. se tiene como unidad de presión el pascal (Pa), es decir:
1 Pa = 1 N · m-2
La unidad de presión pascal es muy pequeña para las presiones con las que se trabaja en la práctica, por lo que se utilizan normalmente sus múltiplos, el kilopascal (kPa) o el megapascal (MPa) que equivalen a 103 y 106 Pa respectivamente.
También se utilizan otras unidades de presión como:
| El bar | 1 bar = 105 N · m-2 = 105 Pa = 100 kPa |
|---|---|
| La atmósfera | 1 atm = 101.325 N · m-2 = 101.325 Pa = 101,325 kPa = 1,01325 bar |
| El kilogramo-fuerza (o kilopondio) por centímetro cuadrado | 1 Kgf/cm-2 = 98.000 N · m-2 = 98.000 Pa = 98 kPa = 0,9807 bar = 0,9679 atm |
Como se puede apreciar, las unidades de presión bar, atm y Kgf/cm-2, son prácticamente equivalentes entre sí.
En el S.A., la unidad de presión es la libra-fuerza por pulgada cuadrada (lbf · pulg-2) o también denominada psi, siendo la relación con la atm de:
1 atm = 14,233 psi
Las unidades de presión Kgf · cm-2 y lbf · pulg-2, también se denominan Kg · cm-2 y lb · pulg-2 respectivamente.

Definición
Presión absoluta
Es la presión real de un fluido, y se mide en relación con el vacío absoluto.
Presión relativa
Es la presión comparada con otra presión con la que está estrechamente relacionada. Si se compara con la atmosférica se denomina presión manométrica.
Al indicar la presión se debe mencionar si esta es absoluta o relativa. El valor absoluto de la presión es el que esta tiene en sí, y el valor relativo es el que posee cuando se la compara con alguna otra presión con la que esté íntimamente relacionada. Si se compara con la atmosférica (que depende de la altura respecto el nivel del mar) se denomina manométrica, aunque también es relativa.
Por tanto:
Presión absoluta = presión relativa o manométrica + presión atmosférica

Ejemplo
Si un manómetro, equipo de medición de presiones relativas, marca una presión de 5 bar en un equipo a presión, se sabe que es relativa, y que la absoluta es de 6 bar (suponiendo que la presión atmosférica sea de 1 bar a nivel del mar). Si el manómetro marca en el mismo equipo una presión de 0 bar, este está a presión atmosférica, ya que todos los instrumentos de medida de presión se calibran para que den una la lectura cero en la presión atmosférica.
La presión atmosférica es la presión ejercida sobre todos los cuerpos que hay sobre la Tierra por la atmósfera. Los instrumentos destinados a medir la presión atmosférica se llaman barómetros.
Las presiones por debajo de la atmosférica se conocen como presiones de vacío y se miden con instrumentos de vacío.
Los fluidos están sometidos a variaciones grandes de presión en función del sistema en que se utilizan.

Ejemplo
El agua en las tuberías domésticas, está a una presión superior a la atmosférica para que salga con rapidez del grifo.
Existen dos principios importantes acerca de la presión en fluidos:
Por tanto, si se conoce la cantidad de fuerza que se ejerce sobre un área dada, es posible calcular la magnitud de la presión en un fluido.
Compresibilidad de los gases. Incompresibilidad de los líquidos
Si se tiene aire u otro gas dentro de un cilindro equipado con un émbolo móvil y muy ajustado, es posible comprimirlo con mucha facilidad si se empuja. Por ejemplo, cuando se infla un balón o una llanta de una bicicleta con una bomba de mano. Conforme se oprime el émbolo, el volumen del gas de reduce de manera apreciable, al tiempo que la presión se incrementa. Pero si el cilindro tuviese agua en vez de aire habría que aplicar una fuerza enorme, lo que aumentaría la presión del agua, pero su volumen cambiaría muy poco.
Estas observaciones conducen a las siguientes descripciones generales de líquidos y gases:
La compresibilidad se refiere al cambio de volumen (V) y por tanto de densidad que sufre la masa de un fluido, es decir, los gases, cuando está sujeta a un cambio de presión. Cada gas tiene un factor de compresibilidad diferente, es decir, que para igual masa, temperatura y presión en un mismo cilindro de compresión se tienen diferentes volúmenes para distintos gases.

Definición
Compresibilidad
Es la propiedad que presentan los gases de poder ser comprimidos.
Una propiedad usada normalmente para caracterizar este fenómeno es el módulo de elasticidad volumétrico o módulo volumétrico (Ev):
Ev = [-Dp] / [(DV)/V]
Donde:
El signo negativo de la ecuación es debido a que un aumento de presión produce una disminución de volumen.
Valores altos del módulo volumétrico indican que el fluido es relativamente incompresible, y por tanto, se necesita un cambio muy grande en la presión para producir un cambio pequeño en el volumen.
Los valores del módulo volumétrico para líquidos son muy grandes, por lo que se puede afirmar que los líquidos en general se pueden considerar como incompresibles para cualquier aplicación práctica en ingeniería. Esto quiere decir que los líquidos tienen volúmenes o densidades prácticamente constantes.
Presión de vapor
En un recipiente cerrado con un líquido en su interior, como por ejemplo la gasolina, se hace el vacío porque este líquido tiene tendencia a vaporizarse y sus moléculas son continuamente expulsadas hacia la superficie. Cuando tiene lugar el equilibro y el número de moléculas que salen del líquido es igual que las que entran se dice que el vapor está saturado. La presión ejercida por el vapor sobre la superficie del líquido se denomina presión de vapor del líquido, y se denota como pv.

Definición
Presión de vapor
Es la presión ejercida por el vapor de una sustancia cuando se encuentra en equilibro de fases con su líquido a una temperatura determinada.
La presión de vapor varía de un líquido a otro y aumenta notablemente al elevarse la temperatura. Cuando la presión absoluta de un líquido alcanza la presión de vapor a una temperatura dada se produce la ebullición. Por tanto, es posible la ebullición de un fluido si a una presión dada se aumenta la temperatura o si a una temperatura dada se aumenta la presión.
Un fenómeno negativo que resulta de la presión de vapor es la cavitación. Cuando un flujo líquido alcanza localmente la presión de vapor, porque disminuye su presión en zonas estrechas de una tubería o bomba, se forman microburbujas de vapor de agua. Estas son arrastradas por el flujo y, una vez que alcanzan zonas de mayor presión, implosionan, pudiendo generar importantes daños en los mecanismos hidráulicos y tuberías. Para evitar la cavitación no se debe permitir que la presión en cualquier punto sea inferior a la presión de vapor.

Recuerde
La cavitación puede provocar importante daños en las tuberías y en los mecanismos hidráulicos, y se debe evitar que la presión en algún punto de la conducción sea inferior a la presión de vapor.
Ecuación de estado de los gases
Se llama ecuación de estado a cualquier ecuación que relacione la presión, la temperatura y el volumen o la densidad de una sustancia. Esta variará por tanto de una sustancia a otra.
Para los gases ideales o perfectos se puede obtener esta ecuación de estado:
P · V = n · R · T
Donde:
La ecuación anterior, denominada ecuación de estado para un gas ideal, también se puede obtener en función de la densidad del gas, de tal forma que la densidad del gas está relacionada con la presión y la temperatura:
P = ρ · R · T
Donde:
ρ = la densidad molar en gramos-mol por litros (gmol · l-1).
Para comparar diferentes cantidades de gases se definen las condiciones estándares de temperatura y presión (1 atmósfera y 273,15 ºK). En estas condiciones el volumen que ocupa un gramo-mol de un gas es:
1 gmol = 22,414 l
Se ha observado en forma experimental que los gases reales se aproximan con bastante exactitud al cumplimiento de esta ecuación cuando tienen densidades bajas, y esto se consigue a presiones bajas y temperaturas altas. Por ejemplo, gases como el aire, el oxígeno, el nitrógeno, el hidrógeno y los gases nobles se pueden tratar como gases ideales.

Recuerde
La ecuación de estado de los gases ideales es P · V = n · R · T
Teniendo en cuenta este problema, se han propuesto muchas ecuaciones de estado para gases reales, pero ninguna se ha generalizado. Se comenta, por ejemplo, la ecuación de Van der Waals:
(P + a/v2) · (v – b) = R · T
Donde:
Problemas relativos al manejo de gases
Los problemas relativos al manejo de gases se pueden distinguir desde tres puntos de vistas, el operacional, la seguridad industrial y el medioambiental, aunque los tres están estrechamente relacionados.
Desde el punto de vista operacional, el primer problema se origina porque tanto el almacenamiento como el transporte de gases se producen a altas presiones. Para ello, es necesaria una cantidad de energía muy grande mediante compresores para aumentar la presión de los gases, pero esto es caro, y además, el almacenamiento de los gases debe estar en las inmediaciones de los compresores.
Esto tiene riesgos importantes por el peligro que supone trabajar a presiones elevadas y se necesitan instalaciones mucho más caras, complejas y sobre todo seguras que si se almacenan o transportan líquidos. Por ejemplo, para el almacenamiento se utilizan recipientes dilatables con características y dimensiones muy específicas y seguras.
Otro problema es el volumen que ocupan y el peso que tienen en comparación con su estado líquido. Por ejemplo, el gas natural se convierte a fase líquida dando lugar a gas natural licuado a una temperatura de -160 ºC. En este estado el volumen es 600 veces menor, lo que hace más fácil su transporte y almacenamiento.
Por otro lado, los gases deben estabilizarse para su transporte, es decir, hay que eliminar componentes que puedan llegar a condensar posteriormente como el agua o hidrocarburos. Estos pueden ocasionar problemas de corrosión, represionamiento en las líneas e instalaciones, formación de hidratos, incrustaciones de sales o disminución en la capacidad de transporte.
Al comprimirse un gas, aumenta su temperatura, y en ocasiones son excesivas y ocasionan problemas con los materiales con los que están construidas las instalaciones.

Nota
Por todo ello, en ocasiones, se tiende a la licuefacción o licuación que es el cambio de estado gaseoso a líquido consistente en aumentar suficientemente la presión y reducir la temperatura para que un gas pase a estado líquido, como ocurre, por ejemplo, con el gas licuado del petróleo.
Con respecto a los problemas de seguridad industrial y medioambiental, estos gases tienen riesgos químicos y físicos potenciales definidos en la siguiente tabla.
| La inflamabilidad | Los gases inflamables pueden inflamarse en una cierta proporción en combinación con el aire u otras sustancias oxidantes. |
|---|---|
| La toxicidad | Los gases tóxicos pueden dañar seriamente e incluso matar seres humanos si los inhalan o absorben a través de la piel. |
| La asfixia | Un gas asfixiante puede provocar la muerte en un ser humano por falta de oxígeno. |
| La presión | Cuanto mayor sea la presión, mayor será la energía acumulada en la instalación, y por tanto, mayor puede ser en impacto en caso de ruptura o explosión de esta. |
| La corrosión | Los gases corrosivos atacan la piel y las mucosas del cuerpo humano. |
| Contaminación | Los gases pueden dañar la capa de ozono, agravar el calentamiento global o contaminar el agua. |
Por todo ello, es extremadamente importante que no existan fugas ni fallos en las instalaciones, y que las condiciones de trabajo y de las instalaciones, y su mantenimiento, revisiones e inspecciones sean las correctas y reglamentarias.
Estática de fluidos
En la estática de fluidos, la propiedad más importante es la presión del fluido. La presión en un fluido estático se considera como la fuerza superficial que ejerce este perpendicular a las paredes del recipiente que lo contiene.

Definición
Estática de fluidos
Estudia el comportamiento de los fluidos cuando estos están en reposo.
Como se sabe, en un fluido contenido en un recipiente existe presión en cualquier punto de este. En los gases es igual en todo su volumen, y en los líquidos la presión es la misma en cualquier punto en la misma dirección horizontal, es decir, a la misma altura o profundidad, y sin embargo, cambia en la dirección vertical por el efecto de la gravedad.
La presión en cualquier punto del líquido es directamente proporcional al peso de la columna vertical de dicho líquido situada sobre ese punto. La presión es a su vez proporcional a la profundidad del punto con respecto a la superficie, y es independiente del tamaño o forma del recipiente. La presión en un líquido aumenta con la profundidad, ya que descansa sobre él más líquido, y por tanto, en las capas más profundas hay más presión que en las proximidades a la superficie.
La presión en el fondo de una tubería vertical llena de agua de 3 cm de diámetro y 10 m de altura es la misma que en el fondo de un lago de 10 m de profundidad. De igual forma, si una tubería de 25 m de longitud se llena de agua y se inclina de modo que la parte superior esté solo a 10 m en vertical por encima del fondo, el agua ejercerá la misma presión sobre el fondo que en los casos anteriores, aunque la distancia a lo largo de la tubería sea mucho mayor que la altura vertical de esta. Pero la presión en el fondo de una columna de mercurio de la misma altura será 13,6 veces superior, ya que el mercurio tiene una densidad 13,6 veces mayor a la del agua.
Para calcular la presión de un líquido en un recipiente a cualquier profundidad del mismo se utiliza la siguiente expresión matemática:
P = Patm + h · r · g
Donde en unidades del S.I.:
Además, a partir de la ecuación anterior, se puede calcular la diferencia de presión de un líquido entre dos puntos en un recipiente. Esta será:
P2 – P1 = (h2 – h1) · ρ · g
Por tanto se puede concluir que la forma del recipiente no afecta a la presión de un líquido, ya que lo que determina la presión es la altura vertical de este.
En las plantas químicas es importante medir y controlar la presión en un recipiente o la diferencia de presiones en un proceso. Para ello se utiliza el manómetro de tubo en U.
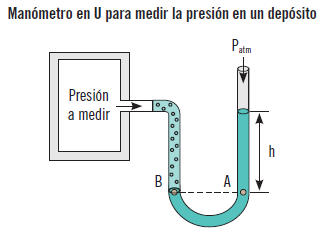
Por ejemplo, sirve para calcular la presión de un depósito de gas donde la presión es la misma en todo su volumen, ya que los efectos de la gravedad sobre los gases son despreciables. Además, la presión en el fluido del manómetro no varía en dirección horizontal, por lo que PA = PB. La columna diferencial de fluido de altura h está en equilibrio estático y abierta a la atmósfera, entonces, con la ecuación del cálculo de la presión a una profundidad dada se obtiene que la presión en el depósito (P2) es:
P2 = Patm + h · ρa · g
Donde:
ρa = densidad del líquido en el tubo.
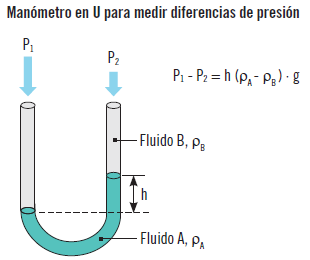
Otro caso es el cálculo de la diferencia de presiones entre dos puntos en un proceso, por ejemplo, antes y después de un equipo con cambio de presión. La presión P2 se ejerce sobre un brazo del tubo y P1 sobre el otro. Una de ellas puede ser incluso la presión atmosférica. La parte superior del manómetro está llena del líquido B con una densidad ρB y la parte inferior con el líquido A con una densidad ρA. El líquido A es más denso que B y ambos son inmiscibles. La diferencia de presiones entre los fluidos A y B será:
P1 – P2 = h (ρA - ρB) · g

Aplicación práctica
Un manómetro en U se utiliza para calcular la caída de presión del agua entre dos puntos en un proceso industrial químico. El fluido más pesado, el mercurio, tiene una densidad de 13.600 Kg · m-3 y el menos pesado, el agua, tiene una densidad de 1.000 Kg · m-3. Si la lectura del manómetro es de 0,25 m. ¿Cuál es la diferencia de presiones en kilopascales?
SOLUCIÓN
Para resolver esta práctica se debe utilizar la ecuación:
PA – PB = h (ρA – ρB) · g
De tal manera que sustituyendo los datos se tendrá que la diferencia de presiones es:
PA – PB = 0,25 (13.600 – 1.000) · 9.81 = 30.901,5 Pa = 30,9 KPa

Aplicación práctica
Un manómetro en U se utiliza para calcular la presión en un tanque de gas, siendo la presión ejercida sobre el otro brazo del manómetro la atmosférica (96 KPa). El fluido del manómetro es el agua, con densidad de 1000 Kg · m-3 y la lectura del manómetro de 0,25 m. ¿Cuál será la presión en el tanque?
SOLUCIÓN
Para resolver esta práctica se debe utilizar la ecuación:
P = Patm + h · ρ · g
De tal manera que sustituyendo los datos se tendrá que la presión absoluta en el tanque es:
P = 96.000 + 0,25 ·1.000 · 9,81 = 98.452,5 Pa = 98,5 KPa
Esta es la presión absoluta, pero si se quisiera saber la presión relativa en el tanque, habría que restarle la presión atmosférica, y por tanto sería:
98,5 – 96 = 2,5 KPa
La electricidad es una manifestación física relacionada con los electrones de los átomos. Se trata de una de las formas de energía que más ventajas está aportando en la actualidad a lo seres humanos y es imprescindible en cualquier planta química.
4.1. Corriente eléctrica
La corriente eléctrica es el desplazamiento de carga eléctrica en forma de electrones libres por un conductor eléctrico. Este desplazamiento se produce siempre desde el polo negativo al positivo, ya que el sentido lo establecen los electrones desde el punto donde hay exceso de estos hasta el punto donde hay defecto de ellos.
Intensidad de corriente. Voltaje. Resistencia eléctrica. Ley de Ohm
Las tres magnitudes fundamentales en electricidad son la intensidad de corriente, el voltaje y la resistencia eléctrica. Las tres se relacionan mediante la ley de Ohm.
Intensidad de corriente
La intensidad de corriente (I) es una medida de la cantidad de corriente eléctrica o cantidad de electricidad, y se expresa matemáticamente como:
I = Q / t

Definición
Intensidad de corriente eléctrica
Es la cantidad de carga eléctrica que circula por un conductor por unidad de tiempo.
Donde:
Por tanto, cuando en un circuito se mueve una carga de un culombio en un tiempo de un segundo, se puede decir que la corriente tiene una intensidad de un amperio.
Con un símil hidráulico, la intensidad de corriente es parecida al caudal, es decir, a la cantidad de agua que pasa por una tubería por unidad de tiempo, por ejemplo, litros por segundo.
Para medir la intensidad de corriente se utiliza el amperímetro.
Voltaje
El voltaje, la tensión eléctrica o diferencia de cargas es el que produce todo generador de electricidad como pila, alternador, etc., y para ello, toma electrones del polo positivo y los deposita en el polo negativo. Para llevar a cabo esto, en el interior del generador se necesita desarrollar una energía, y esto se realizará mediante la fuerza electromotriz (f.e.m.).

Definición
Voltaje, tensión eléctrica o diferencia de potencial
Es la diferencia de cargas entre dos puntos cargados eléctricamente que da lugar a que los electrones se muevan ordenadamente a través de un conductor, produciéndose así una corriente eléctrica.
Fuerza electromotriz
Es la fuerza necesaria para desplazar los electrones desde el polo positivo al negativo, para así poder crear la diferencia de cargas en el conductor.
La fuerza electromotriz es la que permite la circulación de los electrones. Por ejemplo, en una pila la fuerza electromotriz es el proceso químico interno que da lugar a la energía que pone en movimiento a los electrones.
La unidad de medida de la tensión eléctrica, diferencia de potencial o voltaje es el voltio (V). La unidad de medida de la fuerza electromotriz también es el voltio.
Siguiendo con el símil hidráulico, la tensión eléctrica equivale a la fuerza de presión que ha generado una bomba para hacer que el agua circule por una tubería, y el generador eléctrico equivale a la bomba.
Para medir el voltaje se utiliza el voltímetro.
Resistencia eléctrica
La explicación física de la resistencia eléctrica es que los electrones circulan a través de los átomos de los conductores, produciendo un rozamiento que se transforma en calor. Este rozamiento que es la resistencia al movimiento de los electrones es lo que se conoce como resistencia.
La resistencia eléctrica será mayor o menor dependiendo del tipo de material del conductor, por lo que puede ayudar a elegir los mejores o peores conductores eléctricos. Si la resistencia eléctrica es muy alta el conductor será peor y viceversa.

Definición
Resistencia eléctrica
La dificultad que presentan los conductores al paso de la corriente eléctrica.
La unidad de medida de la resistencia eléctrica (R) es el ohmio (Ω).
En la práctica, muchas resistencias son aparatos que transforman la energía eléctrica en otra diferente. Ejemplos: lavadoras, planchas, etc.
La resistencia se mide con el óhmetro o también llamado ohmímetro.
La resistencia de una sustancia depende de la naturaleza del material con el que está hecha, y según esta, existen materiales conductores y aislantes eléctricos. Mientras los materiales conductores permiten el paso de corriente con relativa facilidad, los aislantes la impiden.

Recuerde
El paso de la corriente eléctrica depende de la diferencia de potencial o voltaje y de la resistencia eléctrica que presenta el conductor.
Son buenos materiales conductores prácticamente todos los metales como por ejemplo, hierro, plata o platino. Unos son mejores que otros, pero el más utilizado es el cobre.
Son buenos materiales aislantes, entre otros, las cámaras de vacío, el vidrio, los plásticos, la porcelana o el aceite mineral. Gracias a ellos se puede aislar la electricidad.
Ley de Ohm
La ley de Ohm relaciona las tres magnitudes comentadas anteriormente y establece que “la intensidad de la corriente eléctrica que circula por un conductor eléctrico es directamente proporcional al voltaje o diferencia de potencial aplicada e inversamente proporcional a la resistencia del mismo”.
Y por tanto se puede expresar matemáticamente en la siguiente ecuación:
I = V / R
Donde:
En la práctica, si se conocen dos de las tres magnitudes eléctricas, se puede calcular la tercera.
De la ecuación anterior puede despejarse la tensión si se conoce el valor de la intensidad y la resistencia, o la resistencia, si se conoce el valor de la intensidad y la tensión, tal y como se puede observar a continuación:
V = I · R
R = V / I
La explicación física es la siguiente: cuanto mayor sea la diferencia de potencial de un conductor, mayor fuerza atraerá al polo positivo los electrones desde el polo negativo que atravesarán la resistencia del circuito y, por tanto, será mayor la intensidad de la corriente. Cuanto mayor sea el valor de la resistencia que se opone al paso de la corriente, menor será la intensidad de esta.
Corriente continua y corriente alterna
Hay dos clases de corriente, la corriente continua y la corriente alterna.
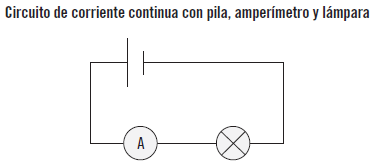
La corriente continua es una corriente eléctrica que circula con una intensidad constante y en el mismo sentido a través de un conductor, y cuyo símbolo de representación es “-”.
Si se dibuja en una gráfica la corriente eléctrica (I) en función del tiempo (t) se obtiene una línea recta paralela al eje del tiempo.


Ejemplo
Un circuito muy simple es una pila que proporciona corriente continua a una lámpara, y con un amperímetro se señala una corriente constante en el tiempo.
Este tipo de corriente se utiliza en cubas o baños electrolíticos y para alimentación de equipos o aparatos electrónicos.
La corriente alterna es una corriente eléctrica que circula con una intensidad y sentido que varía constantemente a través del conductor, y cuyo símbolo de representación es “~”.
El generador produce en intervalos de tiempo iguales cambios en la polaridad de sus terminales de salida. Estos cambios de polaridad y por tanto de sentido e intensidad de corriente, por ejemplo, en una lámpara, deberían hacer que esta se encendiese y apagase constantemente, pero estos cambios de polaridad son tan rápidos que no pueden ser percibidos por el ojo humano.
Si se dibuja en una gráfica la corriente en función del tiempo se obtiene una línea ondulada que se va repitiendo constantemente en el tiempo. Si, por ejemplo, fuese una lámpara, en la zona positiva, es decir, por encima del eje del tiempo, estaría encendida, y en la negativa apagada.
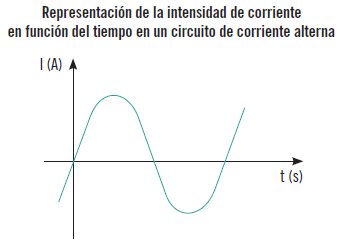

Ejemplo
Un circuito muy simple es conectar una bombilla en un circuito con un amperímetro (con el cero de la escala en el centro) y una dinamo de una bicicleta que actuará como generador. Cuando se mueve el rotor de la dinamo lentamente, la aguja indicadora del amperímetro señala hacia la derecha e izquierda variando constantemente su intensidad de corriente.
Su campo de aplicación es mucho más amplio debido a que es más fácil de generar y de transportar, por lo que se producen en las centrales eléctricas y se utiliza en las viviendas y en la industria en general.
Resistencia de un conductor filiforme. Resistividad
Como ya se sabe, la resistencia eléctrica (R) es la dificultad al paso que encuentra la corriente eléctrica para circular a través de un conductor.
Atendiendo a esto se puede entender que cuanto mayor longitud tenga un conductor, mayor será su resistencia debido a que la corriente eléctrica y, por tanto sus electrones, tendrán más dificultad en atravesarlo.
Por otro lado, si aumenta la sección del conductor, los electrones tendrán más libertad para moverse y la resistencia será menor.

Recuerde
La resistencia de un conductor aumenta con su longitud y disminuye con su sección.
Un conductor filiforme es aquel conductor con forma de hilo largo y sección circular pequeña.

Para calcular la resistencia de un conductor filiforme de sección constante, la fórmula general es:
R = ρ · (L / S)
Siendo:
La resistividad, que se designa por la letra griega r y se mide en ohmios milímetros cuadrados por metro (W · mm2 · m-1), describe el comportamiento de un material frente al paso de corriente eléctrica, por lo que da una idea de lo buen o mal conductor que es ese material.

Definición
Resistividad
Es la resistencia eléctrica específica de un material.
A partir de la resistividad se puede calcular la conductividad eléctrica de una sustancia, es decir, la capacidad que tiene un material para conducir la corriente.
La conductividad se calcula como la inversa de la resistividad. Se designa por la letra griega s y se mide en siemens por metro (S · m-1) o (Ω-1 · m-1):
σ = 1 / r
Un valor de resistividad alto y por tanto de conductividad bajo indica que el material es un mal conductor, mientras que un valor de resistividad bajo y conductividad alto señala un buen conductor.
Efecto joule. Potencia eléctrica
Es bastante interesante conocer para esta actividad qué es el efecto joule en un conductor y qué es la potencia eléctrica de un dispositivo.
Efecto joule
Para un conductor por el que circula corriente eléctrica, parte de la energía cinética del movimiento de los electrones se transforma en calor debido a los choques que sufren con los átomos del material conductor por el que circulan. El movimiento de los electrones en un cable es desordenado, lo que provoca continuos choques entre ellos y como consecuencia un aumento de la temperatura en el propio cable.
El efecto fue definido de la siguiente manera: “el calor generado por una corriente eléctrica es directamente proporcional al cuadrado de la intensidad de corriente eléctrica, al tiempo que esta circula por el conductor y a la resistencia que opone el mismo al paso de la corriente”. Matemáticamente se expresa como:
Q = I2 · t · R

Definición
Efecto Joule
Es el fenómeno por el cual se calienta un material cualquiera cuando es recorrido por una corriente eléctrica.
Donde:
Si el conductor es muy fino, este se calienta hasta ponerse incandescente. La resistencia es el componente que transforma la energía eléctrica en calor, como, por ejemplo, en estufas eléctricas, hornos eléctricos, etc. Para estos y otros aparatos eléctricos, este es el efecto deseado: el calor desprendido por el paso de la corriente eléctrica.
Sin embargo, en la mayoría de las aplicaciones es un efecto indeseado y es la razón por la que los aparatos eléctricos necesitan un ventilador que evite el calentamiento excesivo de los diferentes dispositivos eléctricos o electrónicos.
Potencia eléctrica
La potencia es la tensión que impulsa a moverse a los electrones por un conducto multiplicado por la intensidad de corriente eléctrica, que es la cantidad de electrones que se mueven en un circuito en el tiempo.
P = V · I

Definición
Potencia eléctrica
Es la energía eléctrica consumida por un dispositivo conectado a un circuito eléctrico por unidad de tiempo o la que necesita cualquier aparato eléctrico para que pueda funcionar.
Pero, matemáticamente se puede calcular también mediante otras dos ecuaciones, relacionadas la tres por la Ley de Ohm:
P = I2 · R o P = V2/R
Donde:
El aparato que mide la potencia eléctrica es el vatímetro.
A partir de la potencia se puede calcular la energía eléctrica consumida por un receptor o aparato eléctrico conectado a la instalación. Este cálculo es muy importante, ya que sobre él facturan el consumo eléctrico las compañías eléctricas. La ecuación que los relaciona es:
E = P · t
Donde:
El julio es la unidad de medida perteneciente al S.I. de medidas, pero al ser esta una unidad muy pequeña se suele utilizar para la potencia eléctrica el Kilovatio que son 1.000 vatios y el tiempo en horas, lo que da lugar a que la unidad de energía eléctrica consumida sea el kilovatio-hora (KWh).
El aparato de medida de la energía eléctrica es el contador, que funciona igual que un vatímetro.
Unidades de medida de magnitudes eléctricas. Diagramas unifilares
Es importante hacer un repaso de las unidades de medida de las magnitudes eléctricas estudiadas y saber cómo interpretar un diagrama unifilar de una instalación eléctrica.
Unidades de medida
Las unidades de medida de las magnitudes eléctricas que se han comentado a lo largo de este capítulo son los que aparecen en la siguiente tabla.
|
Amperio
(A)
|
Es la unidad de intensidad de corriente eléctrica. |
|---|---|
|
Culombio
(C)
|
Es la unidad de carga eléctrica y equivale a 6,3 · 1018 electrones. |
|
Voltio
(V)
|
Es la unidad del voltaje, tensión o diferencia de potencial eléctrico y de la fuerza electromotriz. |
|
Ohmio
(W)
|
Es la unidad de resistencia eléctrica. La inversa de la resistencia, es decir, W-1, es el siemens (S). |
|
Julio
(J)
|
Es la unidad de calor generado en un conductor eléctrico. También se utiliza como unidad de medida la caloría (cal), que equivale a 4,187 J. El julio también se utiliza como unidad de la energía consumida, aunque, al ser esta una unidad muy pequeña en relación con los valores con lo que se trabaja, se utiliza normalmente el kilovatio-hora (KWh). |
|
Vatio
(W)
|
Es la unidad de potencia eléctrica, aunque normalmente se utiliza el kilovatio (kW), que son 1.000 W. |
Diagramas unifilares
Todos los dispositivos eléctricos de una instalación, y a veces, el conjunto de estos dispositivos, que llevan a cabo una determinada función, se representan por un símbolo.
Estos símbolos son dibujos muy simplificados de elementos o aparatos al que representan y forman parte de un esquema eléctrico.

Importante
Las dimensiones de los símbolos no guardan proporción con el tamaño real del elemento o aparato representado, ya que no son dibujos a escala sino una representación simbólica.
El esquema es la forma más sencilla de representar las instalaciones eléctricas, y con él se puede comprender el funcionamiento de un equipo o aparato, por lo que deben ser claros y concisos.
Existen diversos tipos de esquemas eléctricos, pero el esquema unifilar o de un solo hilo es el más importante para el desarrollo de esta actividad, ya que proporcionan la visión más simplificada de una instalación y normalmente los esquemas eléctricos suelen tener este tipo de representación.
En este tipo de esquema se simplifica mucho las instalaciones con varios conductores y varios aparatos que funcionan simultáneamente.

Definición
Esquema o diagrama unifilar
Es una representación gráfica de una instalación eléctrica o parte de ella cuyo conjunto de conductores se representa mediante una única línea independientemente de la cantidad de dichos conductores.
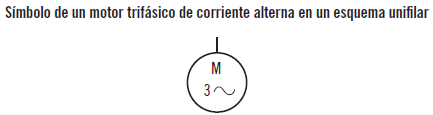
Se representa mediante un único conductor o aparato, cruzado por pequeños trazos oblicuos o indicando sobre la línea principal el numero de conductores. La cantidad de trazos oblicuos que cruzan al conductor o al dispositivo indican el número de conductores o dispositivos que representa. Por ejemplo, un único conductor cruzado por tres trazos oblicuos o un trazo con un tres indica que se trata de una línea trifásica, si son cuatro los trazos que lo cruzan se trata entonces de una línea trifásica con neutro.

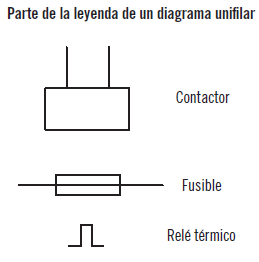
Los elementos típicos de un esquema unifilar son:

Aplicación práctica
Se conecta un equipo eléctrico de 1.000 W a la corriente, con una resistencia de 62,5 Ω. ¿A qué tensión habrá que conectarlo? ¿Cuál es la intensidad de corriente eléctrica? Si se utiliza durante 5 días, ¿cuál será la energía eléctrica consumida en kilovatios-hora?
SOLUCIÓN
Una de las ecuaciones de la potencia eléctrica es P = V2 / R. Como se conoce la potencia del equipo eléctrico (P) y la resistencia (R), solo hay que despejar la tensión (V) de la ecuación para obtener su resultado, es decir, la raíz cuadrada de P por R. → V = (P · R)1/2 = (62.500)1/2 = 250 V. Se conectará a una tensión de 250 V.
Para calcular la intensidad de la corriente eléctrica se puede hacer por la ecuación de la ley de Ohm: I = V / R = 250 / 62,5 = 4 A. La intensidad de corriente es de 4 A.
El consumo de energía eléctrica se calcula mediante la siguiente ecuación: E = P · t = 1 · 120 = 120 KWh. La energía eléctrica consumida es de 120 KWh. Se debe tener en cuenta que en el cálculo de la energía eléctrica se debe poner la potencia en kilovatios, en este caso 1.000 W = 1 KW, y el tiempo en horas, en este caso 5 días = 120 horas.

Aplicación práctica
Comente los elementos que tiene el siguiente tramo de esquema unifilar, ayudado por los símbolos que se han visto en este capítulo.
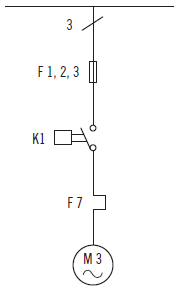
SOLUCIÓN
Se trata de una parte de un esquema unifilar de tres fases porque aparece un tres con un trazo oblicuo al inicio de la línea (en la zona de arriba). Está formado por un motor trifásico de corriente alterna (M3~) y un contactor (K1). Además, para cada fase hay un fusible (F1, 2, 3) y un relé térmico (F7).
Para realizar operaciones de preparación, acondicionamiento, mantenimiento o reparación con máquinas e instalaciones en una planta química se deben tener unos conocimientos básicos sobre calor y temperatura, fluidos y electricidad.
El calor, que es la energía que posee un cuerpo debido al movimiento de sus partículas, hace que la temperatura, que es el valor medio de dicha energía, aumente o disminuya en una sustancia.
Los tres estados de la materia más conocidos son: sólido, líquido y gaseoso, y las transformaciones entre ellos son: fusión, solidificación, vaporización, condensación, sublimación y cristalización.
Un fluido es toda sustancia que no sea sólida y que pueda fluir, es decir, los líquidos y los gases. Para su conocimiento es necesario comprender los conceptos de masa, peso, densidad, peso específico, viscosidad, tensión superficial, y presión de vapor.
La ecuación de estado de los gases ideales es P · V = n · R · T, y se puede aplicar a los gases reales cuando estos tienen bajas densidades.
La estática de fluidos estudia el comportamiento de estos cuando están en reposo, y la propiedad más importante es la presión que tienen, por lo que es necesario saber cómo calcularla.
La electricidad, que es el desplazamiento de electrones por un conductor, tiene tres magnitudes fundamentales que son la intensidad de corriente (I), el voltaje (V) y la resistencia (R). Estas tres magnitudes se relacionan mediante la Ley de Ohm.
Hay dos tipos de corriente, continua y alterna. Mientras la primera tiene una intensidad y sentido constante a través del conductor, la segunda varía.
Un aspecto muy importante en la elección de un buen conductor eléctrico es su resistencia y resistividad.

1. Indique cuáles de las siguientes son unidades de calor.
2. El proceso físico por el cual una sustancia en estado líquido pasa a estado gaseoso se denomina...
3. El calor específico es:
4. El mecanismo de transferencia de calor debido al movimiento macroscópico de la masa de un fluido se denomina...
5. En mecánica de fluidos...
6. La viscosidad es:
7. Una propiedad de los fluidos es que...
8. Respecto a la corriente eléctrica...
9. La resistividad es:
10. El diagrama unifilar...