
Capítulo 1
Operaciones básicas sencillas en el laboratorio
Para llevar a cabo de forma correcta operaciones elementales en un laboratorio y en procesos de la industria química y afines es necesario tener conocimientos sobre aspectos básicos como son las materias primas, productos químicos, envases, material de acondicionamiento, etiquetado, etc.
También es muy importante saber cuáles son los aparatos y materiales, los reactivos químicos de uso habitual y sus características, y las dependencias de un laboratorio y su mobiliario.
Es imprescindible entender cómo se realizan las operaciones básicas de molienda, tamizado, precipitación, filtración, decantación, evaporación y secado.
Y finalmente es preciso adquirir conocimientos sobre técnicas de muestreo, toma de muestra para análisis microbiológico y fisicoquímico, equipos, materiales, identificación, manipulación, conservación y transporte de muestras.
En la industria química se producen una multitud de procesos químicos en los que tienen lugar una serie de operaciones físicas y/o químicas de forma ordenada para transformar materias primas en productos químicos finales totalmente diferentes a estas. Estos productos químicos son los utilizados tanto en los laboratorios como en la industria en general.
Las materias primas son materiales o sustancias tomadas de la naturaleza que se transforman en otras que se convertirán en productos de consumo.
Estas materias primas se encuentran en el medio y se caracterizan por ser muy abundantes: el carbón, el petróleo y el gas natural (que son combustibles fósiles), los minerales, el aire o el agua.

Ejemplo
A partir de los minerales se obtienen los productos químicos inorgánicos.
A partir del petróleo y el gas natural, los productos químicos orgánicos como son los combustibles, carburantes o lubricantes.
A partir del agua del mar se pueden obtener sus sales disueltas como, por ejemplo, el cloruro sódico (NaCl).
A partir del aire se consiguen sus componentes mayoritarios: nitrógeno (N2), oxígeno (O2) o argón (Ar).
Productos químicos
Un producto químico es una sustancia formada por la unión de dos o más elementos químicos como hidrógeno (H), azufre (S), cobre (Cu), oxígeno (O), sodio (Na), potasio (K), etc., o una mezcla de sustancias que tienen una función concreta.
A la sustancia o sustancias que componen los productos químicos también se las denomina compuesto químico y, por tanto, un producto químico se puede decir que está formado por uno o varios compuestos químicos.
Normalmente, la función que tienen los productos químicos la desempeña una sola sustancia o componente aunque en el mismo existan varias. A esa sustancia se la denomina componente activo. El resto de elementos que acompañan al componente activo se utilizan para darle mejor aspecto, mejor olor, o modificar las propiedades del componente activo, como puede ser, por ejemplo, su densidad.

Nota
La densidad es una magnitud física definida como la cantidad de masa existente en el volumen de una sustancia.
Es importante tener en cuenta que un producto químico es diferente de otro cuando tienen componentes diferentes, cuando son iguales pero la cantidad presente de cada uno de ellos es distinta, o cuando tienen condiciones o estados diversos.

Ejemplo
El cloro en estado gaseoso es un producto totalmente diferente al cloro líquido envasado a alta presión.

Actividades
1. Identificar algunos ejemplos de materias primas y de productos químicos.
2. Indicar si el cloruro sódico (NaCl) y el azufre (S) son productos químicos. Razonar la respuesta.
Los productos químicos pueden estar formados por compuestos orgánicos e inorgánicos dando lugar a productos químicos orgánicos o inorgánicos:
Compuesto orgánico de metano

Además, los productos químicos en la industria química pueden clasificarse en cuatro grupos según su uso:

Actividades
3. Indicar si el ácido nítrico (HNO3) y el acetileno (C2H2) son compuestos químicos orgánicos o inorgánicos.
4. Señalar las diferencias que existen entre los productos químicos básicos y los productos químicos finales.
Para comercializar estos productos químicos es necesario que puedan ser almacenados, manipulados y/o transportados de forma segura, y por tanto, la principal medida a adoptar después de su fabricación es la selección de un envase adecuado.

Definición
Envase
Uno o varios recipientes o cualquier otro material, cuya función es la de contención o hacer seguro su contenido.
Los tipos de envases más utilizados para contener productos químicos se muestran a continuación.
Bidón
Es un recipiente que usualmente tiene forma cilíndrica y fondo plano.
Normalmente está fabricado en metal o plástico.
Puede tener la tapa móvil para contener sólidos, o inmóvil para contener líquidos.
Tiene una capacidad máxima de 450 l.

Bidón de plástico
Jerricán o cuñete
Es un envase fabricado en plástico o en metal, con sección rectangular y con uno o varios orificios.
Normalmente se utiliza para contener líquidos.
Tiene una capacidad máxima de 60 l.

Jerricán o cuñete
Saco
Es un recipiente fabricado en papel o plástico que se suele cerrar mediante un encolado, cosido o incluso termosellado.
Se utiliza para contener sustancias en polvo.

Sacos
Envase compuesto
Está formado por un recipiente de plástico y una protección que normalmente es metálica alrededor del mismo como resguardo de este, formando ambos un envase integral.
Se utiliza para almacenar líquidos y es de grandes dimensiones.

Envase de 1.000 l de plástico con una jaula de acero
Bote
Es un envase normalmente fabricado en plástico, de sección circular y abertura superior igual o algo menor que el diámetro del cuerpo.
Se utiliza para contener sustancias sólidas o en polvo.
Su cierre normalmente es de rosca.

Bote
Frasco
Es un recipiente fabricado en cristal, con cuello estrecho y que se utiliza generalmente para contener líquidos.
En algunos casos puede estar fabricado en plástico para contener polvos, pero no es lo habitual y son envases pequeños.
Su cierre suele ser de rosca, y a veces, si son pequeños y contienen líquidos, puede llevar un gotero.

Frasco

Recuerde
Los envases de productos químicos más utilizados son: bidón, jerricán, saco, envase compuesto, bote y frasco. Cada uno está específicamente recomendado para transportar elementos líquidos, sólidos, gaseosos, o en polvo. También se utilizarán unos u otros dependiendo de las cantidades de productos que se quieran contener, ya que hay grandes diferencias de capacidades entre ellos.

Actividades
5. Señalar para qué se utiliza el bidón y qué características tiene.
6. Indicar para qué se utiliza el bote y qué características tiene.
7. Señalar para qué se utiliza el frasco y qué características tiene.
El material de acondicionamiento es cualquier material del que esté fabricado el envase.
La elección del material de acondicionamiento de un producto químico es básica ya que si este no es el correcto puede tener una importante influencia en la estabilidad del producto químico, es decir, en que puedan reaccionar de una u otra manera las sustancias presentes en él.
Por ello, en el transvase de productos químicos, se debe tener especial precaución con esto, es decir, al pasar de envases de tamaño grande a envases de tamaño más pequeño.
El tipo de material de acondicionamiento más utilizado para los productos químicos y sus características se muestran a continuación.
Plástico
Resistentes a multitud de sustancias químicas y soporta bastante bien los pequeños golpes. Tiene el inconveniente de que el paso del tiempo y la exposición solar los deteriora, por ello no deben utilizarse durante un espacio superior a 5 años.
Normalmente están fabricados en polietileno, polipropileno o cloruro de polivinilo, y no son adecuados para contener productos inflamables.
Tienen formas simples, generalmente circulares, con superficies rígidas o zonas estriadas para facilitar la sujeción del envase. Los recipientes con capacidad entre 1 y 10 l deben contener un asa de sujeción, y los de mayor volumen deben tener dos de ellas para mayor seguridad y comodidad en su transporte y manipulación.
Para el cierre de los envases, lo más seguro es utilizar un cierre con tapa roscada.

Consejo
Cuando la sustancia sea líquida se debe dejar un margen de llenado para evitar que se produzcan pérdidas de la misma debido a la dilatación del plástico por un posible cambio de temperatura.
Metálico
Son los más seguros y usados en la industria química, fundamentalmente utilizados en el transporte de productos químicos mediante bidones de acero inoxidable o aluminio, de variadas dimensiones, y muy resistentes.
Para su manejo deben utilizarse carretillas elevadoras u otro elemento mecánico de transporte, y nunca realizarlo manualmente.
Se ubicarán o almacenarán en lugares muy bien ventilados, donde no incidan ni los rayos solares ni las inclemencias del tiempo, y se deben mantener a una temperatura entre –10 °C y 60 °C.
Se tienen que revisar cada cierto tiempo para comprobar su estado de conservación, ya que se tienen que cambiar al menor desperfecto, como por ejemplo, por corrosión o melladuras en los bordes.
Para el almacenamiento de líquidos inflamables se utilizarán recipientes metálicos de seguridad, de pequeño tamaño, cierre hermético y válvula de seguridad.

Definición
Válvula de seguridad
Son válvulas que están diseñadas para liberar o dejar salir un líquido o un gas cuando la presión del lugar donde se encuentren estos sea superior a una presión umbral fijada.
Cristal
Es resistente a la mayor parte de sustancias, pero tiene el importante inconveniente de que es demasiado frágil.
Se suelen utilizar solo para pequeñas cantidades, y se debe tener mucho cuidado en su transporte y manipulación, empleando habitualmente contenedores especiales para su protección.
Estos recipientes, si contuviesen productos químicos peligrosos, no deberán tener más de dos litros de capacidad, y si tuviesen más, deberán tener algún sistema de sujeción para ambas manos.

Actividades
8. Indicar cuáles son los inconvenientes de los materiales de los envases de plástico, metal y cristal.
9. Identificar cuáles son las características que deben tener los envases para líquidos inflamables.
Los productos químicos peligrosos pueden generar riesgos físicos y de salud para los trabajadores, y también riesgos para el medioambiente.
Por ello, todos los productos químicos, sean sustancias o mezcla de sustancias clasificados como peligrosos y contenidos en un envase, deben tener una etiqueta bien visible sobre este con unas características definidas reglamentariamente para que puedan ser comercializados.
Pero, además, a estos productos químicos y sus envases le acompañará un documento que se denomina ficha de datos de seguridad.

Definición
Ficha de datos de seguridad
Es un documento que complementa al etiquetado y que recoge aspectos sobre los riesgos, medidas preventivas y actuaciones de emergencias a tener en cuenta sobre los productos químicos.
La empresa comercializadora de un producto químico debe entregar las fichas de datos de seguridad de forma gratuita con el primer suministro de productos químicos al destinatario final de estos. Si se producen modificaciones de estas fichas de datos de seguridad se entregarán también al destinatario final.
Las fichas de datos de seguridad deben estar redactadas en castellano e incluirán los siguientes epígrafes:

Importante
Solicitar la ficha de seguridad siempre que se adquiera un nuevo producto químico peligroso.
Leer la ficha de seguridad antes de manipular por primera vez un producto químico peligroso.

Actividades
10. Buscar en internet la ficha de datos de seguridad de un producto químico, comprobar los epígrafes que debe tener y que se han estudiado y leer atentamente la información relativa a cada uno de ellos.
Como se ha comentado anteriormente, todos los productos químicos, sean sustancias o mezcla de sustancias clasificados como peligrosos y contenidos en un envase, deben tener una etiqueta bien visible sobre este para ser comercializados.
Esta etiqueta, redactada en castellano, debe informar de manera sencilla a quien vaya a utilizar estos productos químicos sobre los peligros inherentes de estos y las precauciones que hay que tomar para su manipulación.
Esta etiqueta se redacta conforme a la normativa vigente en el momento de envasado de los productos químicos, sin embargo, esta normativa cambió en 2010. Por tanto, en un laboratorio pueden aparecer dos tipos de etiquetas, las etiquetas antiguas y las etiquetas nuevas.

Nota
Hasta el 30 de noviembre de 2010 se etiquetaban los productos químicos que no contenían mezcla de sustancia con unas características determinadas. A partir de esa fecha se ha empezado a etiquetar con otras características. Para los productos químicos formados por mezcla de sustancias, la obligación de cambio de las características del etiquetado se producirá el 1 de junio de 2015.
La etiqueta antigua contiene la siguiente información:
Pictogramas de peligro del etiquetado antiguo


Definición
Pictograma de peligro
Composición gráfica con un símbolo y otros elementos descriptivos como un contorno, un motivo, o un color de fondo, y que se utiliza para generar una información específica sobre un peligro concreto.
Los pictogramas de peligro normalizado se pueden dividir en tres categorías, si hacen referencia a propiedades fisicoquímicas, si tienen efectos sobre la salud, o si provocan efectos sobre el medio ambiente.
El significado de cada pictograma de peligro normalizado para un producto químico, y para cada una de estas categorías es el siguiente:
| Pictograma de peligro | Significado |
| Propiedades fisicoquímicas | |
| Explosivo | Pueden reaccionar generando mucho calor y/o energía, pueden detonar o deflagrar rápidamente, y bajo el efecto del calor, en caso de confinamiento parcial, explosionan. |
| Comburente | En contacto con otras sustancias, especialmente con sustanciasinflamables, dan lugar a una reacción con desprendimiento demucho calor y/o energía. |
| Extremadamente inflamable | Líquidos que tienen una temperatura de ignición extremadamente baja y una temperatura de ebullición baja. Gases que, a temperatura y presión normales, son inflamables en contacto con el aire. |
| Fácilmente inflamable | Pueden calentarse e inflamarse en el aire a temperatura ambiente sin aporte de energía. Sólidos que pueden inflamarse fácilmente tras un breve contacto con una fuente de inflamación. Los líquidos cuyo punto de ignición es muy bajo. En contacto con el agua o con el aire húmedo desprenden gases extremadamente inflamables en cantidades peligrosas. |
| Efectos sobre la salud | |
| Corrosivo | Pueden ejercer una acción destructiva sobre los tejidos en contacto con ellos. |
| Muy tóxicos | La inhalación, ingestión o penetración cutánea en muy pequeña cantidad puede provocar efectos agudos o crónicos, e incluso la muerte. |
| Tóxico | La inhalación, ingestión o penetración cutánea en pequeña cantidad puede provocar efectos agudos o crónicos, e incluso la muerte. |
| Nocivo | La inhalación, ingestión o penetración cutánea puede provocar efectos agudos o crónicos, e incluso la muerte. |
| Irritantes | En contacto repetido con la piel o las mucosas pueden provocar una reacción inflamatoria. |
| Efectos sobre el medio ambiente | |
| Peligroso para el medio ambiente | Presentan o puedan presentar un peligro inmediato o futuro para uno o más componentes del medio ambiente. |

Definición
Temperatura de ignición
Es la temperatura mínima a la que un vapor generado por una sustancia inflamable o combustible empieza a arder.
Temperatura de ebullición
Es la temperatura a la que la materia cambia de estado líquido a gaseoso.

Actividades
11. Señalar qué es un pictograma.
12. Indicar qué características tienen los pictogramas de peligro de los etiquetados antiguos de productos químicos.
13. Señalar cuáles son los diferentes pictogramas de peligro de los etiquetados antiguos de productos químicos.
| R5 | Peligro de explosión en caso de calentamiento. |
| R14 | Reacciona violentamente con el agua. |
| R24 | Tóxico en contacto con la piel. |
| R26 | Muy tóxico por inhalación. |
| R34 | Provoca quemaduras. |
| S1 | Consérvese bajo llave. |
| S2 | Manténgase fuera del alcance de los niños. |
| S3 | Consérvese en lugar fresco. |
| S7 | Manténgase el recipiente bien cerrado. |
| S15 | Conservar alejado del calor. |

Nota
También puede aparecer la frase “Etiqueta CE” con algunas sustancias.

Actividades
14. Buscar en Internet algún etiquetado antiguo de productos químicos y comprobar que la información que contiene es la correcta.
15. Indicar la diferencia que existe entre las frases R y las frases S.
Las nuevas etiquetas contienen la siguiente información:
Los pictogramas de peligro normalizado se pueden dividir en tres clases, si hacen referencia a peligros físicos, para la salud humana, o para el medio ambiente.
Pictogramas de peligro del nuevo etiquetado

El significado de cada pictograma de peligro normalizado para un producto químico, y para cada una de estas clases, es el siguiente:
| Pictograma de peligro | Significado |
| Peligros físicos | |
| Explosivo | Pueden explotar al contacto con una llama, chispa, electricidad estática, calor, etc. |
| Inflamable | Pueden inflamarse al contacto con una llama, chispa, electricidad estática, calor, aire, agua, etc. |
| Comburente | Pueden agravar o provocar un incendio o una explosión en presencia de sustancias combustibles. |
| Gases comprimidos | Gases comprimidos en un recipiente que pueden explotar con el calor, o provocar quemaduras o heridas relacionadas con el frío. |
| Corrosivo para los metales | Pueden atacar o destruir metales. |
| Peligros para la salud humana | |
| Toxicidad aguda | Pueden provocar efectos adversos sobre la salud, incluso en pequeñas dosis. Pueden ocasionar dolores de cabeza, vómitos, pérdidas de conciencia e incluso la muerte. |
| Corrosión cutánea | Pueden generar por contacto o proyección daños irreversibles a la piel o los ojos. |
| Irritante | Pueden producir efectos adversos para la salud en dosis altas. También provocan irritaciones en ojos, nariz, garganta y piel, alergias en la piel, vértigo o falta de sueño. |
| Nocivo | Pueden ser productos cancerígenos, mutágenos (modifican el ADN de las células), tóxicos para la reproducción, provocar alergias respiratorias, modificar el funcionamiento de órganos como el hígado o el sistema nervioso, o originar graves efectos sobre los pulmones. |
| Riesgos para el medio ambiente | |
| Peligroso para el medio ambiente | Pueden provocar efectos nefastos para los seres vivos del medio acuático, es decir, peces, algas, etc. |
| H204 | Peligro de incendio o de proyección. |
| H225 | Líquidos y vapores muy inflamables. |
| H300 | Mortal en caso de ingestión. |
| H312 | Nocivo en contacto con la piel. |
| H400 | Muy tóxico para los organismos acuáticos. |
| P102 | Mantener fuera del alcance de los niños. |
| P222 | No dejar que entre en contacto con el aire. |
| P270 | No comer, beber, ni fumar durante su utilización. |
| P372 | Riesgo de explosión en caso de incendio. |
| P405 | Guardar bajo llave. |
| EUH014 | Reacciona violentamente con el agua. |
| EUH044 | Riesgo de explosión al calentarlo en ambiente confinado. |
| EUH029 | En contacto con agua libera gases tóxicos. |
| EUH070 | Tóxico en contacto con los ojos. |
| EUH014 | Guardar bajo llave. |

Actividades
16. Buscar en Internet un etiquetado nuevo de productos químicos y comprobar que los pictogramas que aparecen en el mismo son algunos de los estudiados.
17. Buscar en Internet un etiquetado nuevo de productos químicos y comprobar que la información que contiene es la correcta.
Todo laboratorio debe tener unas dependencias típicas y necesarias, y un mobiliario adecuado y acorde a la actividad que se va a llevar a cabo para mayor comodidad y para mejorar las condiciones laborales del personal que allí trabaje.
Cualquier laboratorio tiene una serie de dependencias o zonas típicas para evitar interacciones entre los diferentes trabajos u ocupaciones que se desempeñan en el mismo.

Nota
Estas zonas, en función de las dimensiones del laboratorio, pueden encontrarse en una misma estancia, en caso de ser un laboratorio pequeño, o en varias estancias, en caso de ser un laboratorio de grandes dimensiones.
Se pueden destacar cuatro dependencias o zonas típicas en un laboratorio. Estas se describen a continuación.
Recepción y almacenamiento de muestras
Esta zona es la vía de entrada de las muestras que van a ser analizadas en el laboratorio. Se debe tener en esta dependencia un sistema que identifique y registre todas las muestras que llegan al laboratorio, y de esa manera tenerlas totalmente controladas.
Además, en esta dependencia o en otra aledaña, se tendrá una zona de almacenamiento de muestras que asegure su correcto estado de conservación.
Esta zona de almacenamiento puede ser, por ejemplo, un espacio donde existan estanterías montadas, y donde se colocarán las muestras, pero con la obligación de ser un lugar donde no existan temperaturas altas, ni bajas, ni que sufra variaciones importantes de temperatura, y donde no incidan directamente los rayos solares.
Si algunas de las muestras requieren enfriamiento o congelación se tendrá en la zona de almacenamiento un refrigerador o una nevera para almacenarlas.
Cuando sea necesaria la distribución de una única muestra por diferentes secciones del laboratorio, la división de esta se llevará a cabo en la recepción.
Las muestras que hayan sido analizadas se almacenarán también en una zona de muestras ya analizadas, por si es necesario hacer sobre estas muestras algún nuevo análisis.

Sabía que...
Una muestra es una parte o una porción de material tomada y seleccionada para ser analizada o estudiada en el laboratorio.
Análisis
La zona de análisis es la más importante y la de mayor dimensión del laboratorio, ya que es la zona de trabajo analítico, es decir, la actividad principal del laboratorio.
En función de la dimensión del laboratorio y del tipo de análisis que se realice se debe distribuir esta zona en base al tipo de muestras a analizar o de las técnicas de análisis a realizar.

Ejemplo
Si se realizan analíticas de muestras de aguas residuales y residuos se separarán en dos zonas de análisis diferentes.
Si se realizan analíticas solo de aguas residuales se pueden separar las zonas por técnicas de análisis, por ejemplo, en una zona el análisis de microorganismos y, en otra, el análisis fisicoquímico.
También debe estar distanciada la zona de tratamiento de las muestras de las zonas donde se encuentran los instrumentos que realizan las mediciones. Esto es debido a que las condiciones ambientales, como vapores orgánicos, ataque con ácidos, etc. generadas en las operaciones que se realizan en el tratamiento de la muestra, no son adecuadas para estos instrumentos, y puede provocar su deterioro o mal funcionamiento.
En esta zona de análisis puede existir algún despacho, por ejemplo, del jefe del laboratorio, una sala para la limpieza de los materiales, y también, puede haber una sala de balanzas para realizar las pesadas. Si es un laboratorio pequeño, todo esto puede estar en la sala de análisis, las balanzas en alguna mesa con las características y las condiciones correspondientes a las balanzas, la limpieza en alguna pileta, o en vez de despachos, mesas de escritorio.
Las características de la dependencia de análisis son:

Importante
Los productos inflamables o corrosivos es conveniente guardarlos en armarios especiales de seguridad.
Almacenamiento de materiales, productos químicos y residuos
Es razonable que en las zonas de trabajo del laboratorio, es decir, en la zona de análisis, solo se tengan las cantidades de materiales y productos químicos necesarios para su uso.
Por tanto se dispondrá de una zona de almacenamiento de materiales y productos químicos que estará separada de las zonas de trabajo y a la cual se debe tener un fácil acceso desde el exterior para su reposición.
Esta zona de almacenamiento es también idónea, si no se posee ninguna otra zona, para el almacenamiento de los residuos generados en el laboratorio por su fácil acceso hacia el exterior.
Su estructura, paredes, y techos deben ser resistentes al fuego, y el suelo debe tener una pendiente adecuada hacia una zona de drenaje, por si se produce el derrame de algún producto químico.
Para realizar una adecuada organización de un almacenamiento de productos químicos se tendrá en cuenta lo siguiente:

Ejemplo
No almacenar ácidos y bases juntos, como por ejemplo, ácido sulfúrico (H2SO4) con hidróxido sódico (NaOH).
No almacenar sustancias inflamables con oxidantes, por ejemplo, éter etílico (C4H10O) con el hipoclorito sódico (NaClO).
El almacén no debe tener temperaturas muy altas, ni muy bajas ni cambios importantes de esta. Para ello, y dependiendo de los productos almacenados, debe existir una ventilación natural o forzada (mediante equipos o máquinas de ventilación), y además una instalación eléctrica antideflagrante, es decir, adecuada para evitar explosiones.

Importante
La manipulación de estos productos químicos, como transvasar líquidos a recipientes de menor volumen, se debe realizar en un lugar separado del almacén, por ejemplo, en una estancia designada para dicha función. Esto se debe a que existe un riesgo importante en la ejecución de estas operaciones que puede hacer que el producto químico que se manipule entre en contacto con otros almacenados.
Administrativa
Se trata de una zona administrativa que en función de las dimensiones del laboratorio podrá estar formada por despachos o salas de trabajo, salas de reuniones, aseos, archivos, biblioteca y/o sala de descanso.
En los despachos o salas de trabajo estarán todos los trabajadores que no realicen tareas en el laboratorio, o que realizándolas también efectúen trabajos de gestión administrativa (como puede ser el gerente, los administrativos, el responsable de mantenimiento, etc.).
Estas zonas estarán totalmente aisladas del laboratorio por motivos de seguridad y salud.

Actividades
18. Dibujar un croquis en un papel con las diferentes dependencias que puede tener un laboratorio de grandes dimensiones.
19. Indicar si cree que en un laboratorio el almacén de productos químicos debería estar en la zona de análisis. Razonar la respuesta.
El mobiliario de cualquier laboratorio debe ser cómodo y funcional, y estará formado por al menos los siguientes elementos:

Armario especial de seguridad
Campana extractora


Consejo
Es importante que todo el personal que realice trabajos en un laboratorio tenga un cuaderno de laboratorio donde se anoten todas las indicaciones necesarias y/o resultados obtenidos en las operaciones y análisis.

Actividades
20. Situar el mobiliario típico del laboratorio en el croquis con las diferentes dependencias que ha dibujado anteriormente.
21. Razonar sobre la necesidad de tener en un laboratorio una vitrina de gases o campana extractora.
Existen diversos tipos de aparatos en un laboratorio químico, pero destacan por su uso habitual las balanzas y el material volumétrico, y de este último, las pipetas.
Puede definirse el material volumétrico como aquel que se utiliza para medir o tomar volúmenes de líquidos.
El material volumétrico, atendiendo a su definición, debe poseer marcas grabadas en el mismo para que se pueda medir el volumen del líquido que se encuentra en su interior.
Existen diversos tipos de materiales volumétricos como las pipetas, probetas, buretas y matraz aforado, siendo todos ellos de vidrio o plástico transparente, para permitir la visualización del líquido que se quiere medir sobre las marcas grabadas en el material.
Pipetas
Cuando en un laboratorio se quiere tomar un volumen conocido para pasar de un recipiente a otro, y hacerlo con gran precisión, se utiliza como material volumétrico las pipetas. Existen pipetas con diferentes capacidades, por ejemplo, de 1, 2, 5, 10, 25 ml.

Definición
Pipetas
Son recipientes de vidrio con forma alargada y con una punta inferior por donde entra y sale el líquido, y que se utilizan para medir volúmenes pequeños con gran precisión.
Tipos de pipetas
Los tipos más comunes de pipetas en un laboratorio se muestran a continuación.
Pipeta volumétrica o de enrase
Es un tubo largo y estrecho con un ensanchamiento en la zona central. Su zona superior está abierta al exterior, y además, tiene una línea de medida, aforo o enrase que sirve para indicar hasta donde se debe llenar, y por tanto, el volumen que debe alcanzar la pipeta.
Este tipo de pipeta se utiliza solamente para medir exactamente el volumen indicado en la misma, es decir, se utiliza para un único volumen, y por tanto, para una única medida.
Son más precisas que las pipetas graduadas.
Existen pipetas que miden desde 0,5 hasta 200 ml.
Este tipo de pipeta se divide en dos grupos, pipeta volumétrica simple y pipeta volumétrica doble:
Pipeta volumétrica o de enrase simple

Pipeta volumétrica o de enrase doble

Pipeta graduada
Es un tubo largo y estrecho abierto en la zona superior y con una graduación o valores grabados en su pared.
Se utiliza para medir cualquier volumen igual o inferior al de su capacidad máxima, pero si este es inferior al de su capacidad máxima, siempre se debe utilizar la pipeta graduada más pequeña con la que se pueda tomar ese volumen, ya que de esa forma la medida será más precisa.
Su volumen máximo oscila entre 0,1 y 25 ml.
Su capacidad se indica en el valor grabado en su pared en la señal donde el líquido se encuentre a más altura.

Pipeta graduadas
Pipeta pasteur
Existen otros tipos de pipetas menos utilizadas como son las pipetas pasteur.
Estas son de plástico, alargadas, con una punta en la zona inferior por donde entra y sale el líquido, y en la zona superior existe un ensanchamiento quedando este cerrado al exterior.

Nota
Están graduadas en sus paredes estrechas.
Su uso es similar a un gotero. Se aprieta la zona superior antes de introducirla en un líquido para quitarle aire. A continuación se introduce la punta en el interior de un líquido, de tal forma que al dejar de apretar, automáticamente succiona este. Para soltar líquido gota a gota se vuelve a apretar en su zona superior y este sale por su punta.
Se utilizan para transvasar cantidades de líquidos muy pequeñas, gotas, de un recipiente a otro.

Pipetas pasteur

Actividades
22. Razonar la respuesta sobre la conveniencia de usar tanto pipetas volumétricas como pipetas graduadas en un laboratorio.
Manipulación de una pipeta
Para succionar un líquido con una pipeta, el primer paso es colocar la pipeta verticalmente introduciendo la punta de esta en el interior líquido y manteniéndola sumergida durante todo el llenado.
Con un aspirador de líquido o aparato de succión, como puede ser una pera de goma o un aspirador con forma de jeringa colocado en su abertura superior, se puede succionar a través de su punta el líquido con suavidad, ascendiendo este a lo largo de la pipeta.

Pera de goma y succionadores con forma de jeringa para pipetas
Cuando el líquido supere un par de centímetros la línea de medida del volumen a tomar se quitará el aparato de succión y rápidamente se colocará el dedo índice en la parte superior de la pipeta (zona abierta de la pipeta) para evitar que el líquido descienda.
Manera de colocar el dedo índice sobre una pipeta

A continuación se debe levantar un poco el dedo índice de manera que se deje salir parte del líquido hasta que la zona inferior del menisco que forma el líquido con la pipeta coincida con la línea o nivel de lectura, entonces se vuelve a colocar el dedo índice en su parte superior para evitar que siga descendiendo líquido. El nivel de lectura se tomará con la pipeta en posición vertical y el ojo de quien realiza la medida a la misma altura que el nivel de lectura.
Nivel de lectura o enrase del menisco de un líquido en un tubo capilar


Definición
Menisco
Es la superficie libre curva de un líquido en un tubo capilar, por ejemplo, la que se produce en una pipeta.
Después se vierte el volumen de líquido medido en el lugar asignado de forma lenta para evitar que el líquido pueda quedar pegado en las paredes de la pipeta. Para verter el líquido, la pipeta debe estar en posición vertical con el recipiente al que se va a transvasar un poco inclinado y la punta de la pipeta tocando la zona alta de la cara interior del recipiente pero sin rozar el líquido del recipiente.

Sabía que...
Cuando se vierte el líquido de una pipeta queda un pequeño volumen de líquido en la punta de la misma. Cuando se fabrican las pipetas se tiene en cuenta este aspecto, por lo que no se debe intentar sacar esta pequeña cantidad de volumen ni soplando ni de ninguna otra forma.

Actividades
22. Tomar un lápiz o un bolígrafo e imaginar que es una pipeta. Intentar manipularla.
23. Imaginar que se rompe la punta de una pipeta mientras está vertiendo el contenido de la misma en un vaso de precipitados. ¿Sería correcto dejar en el vaso de precipitados el volumen tomado si se trata de una pipeta de enrase simple? ¿Y si se trata de una pipeta de enrase doble? Razonar la respuesta.
Material volumétrico
En los laboratorios, además de las pipetas, existe otro material volumétrico como la probeta, la bureta o el matraz aforado.
Probeta
La probeta es un tubo normalmente transparente, de vidrio o plástico, y graduado con pequeñas subdivisiones que se utiliza para medir volúmenes con poca exactitud.
Su zona inferior se encuentra cerrada y tiene una base que se utiliza de apoyo, mientras que su zona superior se encuentra abierta y es por donde se introduce el líquido.
Normalmente se utilizan para medir volúmenes de 25 o 50 ml, aunque existen probetas de diferentes tamaños, incluso de 2.000 ml.

Probetas
Bureta
La bureta es un tubo de vidrio graduado con pequeñas subdivisiones y que en su zona inferior, que tiene forma aguda, tiene una llave de paso para controlar la salida del líquido. Con esta llave se puede controlar el volumen del líquido gota a gota, por lo que se trata de un material volumétrico muy preciso.
El líquido se introduce por la zona superior que se encuentra abierta.
Su utilización principal se produce en volumetrías, y su tamaño habitual es de 25 o 50 ml y graduadas cada 0,1 ml.

Sabía que...
La volumetría es la determinación de la cantidad de sustancia presente en una disolución mediante la utilización de un volumen exacto de otra sustancia en cantidad conocida y que reacciona con la primera. De esa forma, conociendo el volumen de la sustancia en cantidad conocida que reacciona, se puede saber la cantidad de sustancia presente en esa disolución y que se pretende determinar.
Sus medidas van desde el valor cero ml que se encuentra en la zona inferior hasta el valor máximo que se encuentra en la zona superior.

Bureta
Matraz aforado
El matraz aforado es un matraz de fondo plano y cuello muy alargado y estrecho. En el cuello tiene una marca para que, cuando el matraz esté lleno hasta esa marca, se conozca el volumen que contiene.
En los laboratorios existen matraces aforados desde 10 hasta 2.000 ml, y los más comunes son de 20, 50, 100, 250, 500 y 1.000 ml.
Su uso principal es la preparación de disoluciones con una concentración exacta y conocida.

Definición
Concentración
Es la proporción o porcentaje que hay en una disolución entre la cantidad de soluto y la cantidad de disolución.
Los tapones se deben ajustar muy bien y pueden ser de cristal, plástico o caucho.

Matraces aforados
Tipos de material volumétrico
Al igual que se ha estudiado con las pipetas, el material volumétrico se puede clasificar también en función del formato que presentan sus marcas grabadas. Existen varios grupos:

Recuerde
El material volumétrico está formado por pipetas, probetas, buretas y matraces aforados.
Pero también, tanto el material graduado como el aforado se pueden dividir en dos grupos, en función de si tienen simple o doble enrase:

Recuerde
El material volumétrico puede ser graduado o aforado, aunque también puede ser de simple enrase o de doble enrase.

Actividades
25. Indicar para cada material volumétrico si es graduado o aforado, o si tienen simple o doble enrase.

Aplicación práctica
Imagine que trabaja en un laboratorio químico y le piden que tome 50 y 17 ml de ácido clorhídrico (HCl) para mezclarlo con agua (H2O) y así preparar dos disoluciones de HCl con H2O. Indique qué material volumétrico debe utilizar para tomar el HCl. Razone la respuesta.
SOLUCIÓN
Para tomar 50 ml se debe hacer con una pipeta volumétrica o de enrase de 50 ml. Es necesario utilizar una pipeta porque es el material volumétrico más preciso para tomar volúmenes de líquidos. Se utiliza el tipo volumétrico o de enrase porque son más exactas que las graduadas, y para 50 ml existen pipetas volumétricas. Se puede emplear tanto la de simple enrase como la de doble enrase.
La toma de 17 ml se realizará con una pipeta graduada. Se utiliza el tipo graduado y no el volumétrico porque no existe ninguna pipeta volumétrica de 17 ml. Se debe coger una pipeta graduada de 20 ml (que es la pipeta graduada más pequeña) con la que se tomarán 17 ml.
Mantenimiento
La principal actuación de mantenimiento sobre las pipetas y el material volumétrico es la adecuada limpieza después de su uso, debido a que un material sucio puede generar que en una analítica se obtenga un resultado erróneo.
Por tanto, después de ser utilizado o terminar la sesión de trabajo diaria en el laboratorio, se deben limpiar las pipetas y el material volumétrico antes de guardarlo.
Aunque se puede llevar a cabo en una máquina, la limpieza normalmente se realiza a mano.
La forma de realizar el lavado manual del material es la siguiente:

Escobilla de limpieza
Después del lavado y secado del material es muy importante colocarlo en su vitrina dejándolo todo correctamente almacenado y ordenado.
Cuando sea necesario material volumétrico seco después de ser limpiado, se debe enjuagar, por ejemplo, con acetona ya que así el proceso de secado del material es mucho más rápido.

Importante
Nunca se debe poner a secar dentro de una estufa ningún material volumétrico.

Actividades
26. Considerar si es solo suficiente la limpieza del material volumétrico con agua y jabón. Razonar la respuesta.

Aplicación práctica
Imagine que trabaja en un laboratorio químico y le piden que limpie una probeta y una pipeta, siendo ambas necesarias con carácter urgente. ¿Cómo debe llevarse a cabo la limpieza?
SOLUCIÓN
La probeta debe seguir los siguientes pasos para su limpieza:
La pipeta debe seguir los siguientes pasos para su limpieza:
En un laboratorio, una de las operaciones que más se realizan es pesar una sustancia. Para medir o pesar la masa de una sustancia o un cuerpo se utiliza la balanza.

Definición
Balanza
Es un instrumento utilizado para medir la masa de un cuerpo o una sustancia comparándolo con otros cuerpos con masas definidas.
Tipos de balanzas
En un laboratorio pueden existir dos grandes tipos de balanzas en función del sistema de funcionamiento y de su diseño. Estos son las balanzas electrónicas y las mecánicas.
Balanzas electrónicas
Son las más utilizadas con mucha diferencia debido a su mayor precisión y fiabilidad.
La pesada se puede realizar de manera cómoda y rápida.
Tienen un microprocesador que recibe una señal que se genera en el platillo cuando se pesa una sustancia y que transforma en dígitos numéricos que se pueden leer en su pantalla digital.
Pueden comunicarse y enviar datos a ordenadores o impresoras.
Las balanzas electrónicas se dividen en función del objeto de la pesada en balanza granataria y balanza analítica.
Balanzas granatarias
Se utilizan cuando se necesita un peso aproximado proporcionando pesadas con valores de uno o dos decimales de gramo, según el modelo.
Son poco precisas.

Balanza electrónica granataria
Balanzas analíticas
Son balanzas muy precisas y se utilizan cuando se necesita un peso muy aproximado proporcionando pesadas con valores de cuatro o cinco decimales de gramo, según el modelo, aunque normalmente son cuatro.
Son las más habituales en un laboratorio, y se emplean para cualquier pesada que no requiera una masa grande.

Balanza electrónica analítica

Recuerde
Las balanzas granatarias pueden proporcionar valores de pesado de uno o dos decimales de gramo, mientras que las balanzas analíticas lo hacen de cuatro o cinco decimales de gramo.
Balanzas mecánicas
Son aquellas que tienen un mecanismo mecánico y no electrónico.
Aunque son sencillas de manejar, solo se utilizan para pesadas de precisión baja y prácticamente han desaparecido de los laboratorios.
Las balanzas mecánicas, en función del número de platos, se clasifican en balanzas monoplato y en balanzas de dos platos.
Balanza monoplato
Son las que utilizan un solo plato, como, por ejemplo la balanza de pesa deslizante.
En la balanza de pesa deslizante se coloca la sustancia en el platillo y a continuación se deslizan por la escala graduada las pesas que tiene incorporada la balanza. La situación de las pesas en la escala indicará la medida cuando se obtenga la posición de equilibrio.

Balanza mecánica monoplato de pesa deslizabte
Balanzas de dos platos
En estas balanzas se coloca en uno de los platillos la sustancia a pesar, y en el otro se van colocando pequeñas pesas hasta que queden nivelados los dos platillos. De esa manera se consigue obtener la masa de la sustancia.

Balanza mecánica de dos platos

Actividades
27. Investigar en internet en diferentes empresas proveedoras de balanzas de laboratorio cuáles son los tipos de balanzas más comercializadas y cuáles son sus características.

Aplicación práctica
Imagine que trabaja en un laboratorio químico y le piden que pese en la balanza electrónica 5,57 g de cloruro sódico (NaCl) para añadir al agua, ya que es necesario preparar una disolución de NaCl en agua (H2O). La pesada debe ser muy precisa porque esta disolución se va a utilizar para realizar un análisis muy importante y que requiere de mucha exactitud. Si utiliza una balanza granataria, ¿estará realizando la operación de pesado correctamente? ¿Es mejor utilizar otro tipo de balanza? Razone la respuesta. Si se utiliza una balanza con valores de cuatro decimales de gramo, ¿cuál será el peso que debe marcar en la balanza electrónica?
SOLUCIÓN
No, no se estará realizando la pesada correctamente debido a que para realizar pesadas de precisión es necesario utilizar balanzas analíticas.
Sí, es mejor utilizar una balanza analítica con valores de cuatro o cinco decimales de gramos, ya que las granatarias solo tienen uno o dos decimales, y por tanto, son menos precisas.
Si se utiliza una balanza analítica con cuatro decimales de gramos el peso que debe marcar la balanza electrónica es 5,5700. Si no indica este peso la pesada no será correcta.
Mantenimiento
A las balanzas se les debe realizar un mantenimiento periódico por parte del usuario, y que consiste en:

Definición
Calibración
Determinar el valor correcto de la lectura de un instrumento comparándolo con un estándar o un patrón.
Verificación
Determinar mediante pruebas que el instrumento cumple con las especificaciones establecidas.
Condiciones para efectuar una pesada
Las condiciones para realizar una pesada en una balanza son las siguientes:

Mesa antivibratoria para balanzas

Vidrio de reloj con una sustancia sólida

Actividades
28. Indicar qué condiciones o situaciones pueden ser perjudiciales para el pesado en una balanza de laboratorio.
En los laboratorios existe una amplia variedad de materiales y reactivos con diferentes utilidades que se deben conocer para desempeñar adecuadamente la actividad.
En un laboratorio se pueden clasificar los materiales dependiendo de su función. Los distintos tipos se muestran a continuación.
Materiales para medir volúmenes
Son los materiales volumétricos ya conocidos, es decir, la pipeta, la probeta, la bureta y el matraz aforado.
Se utilizan para medir volúmenes.
Son de vidrio o plástico transparente, y están graduados o aforados.
Materiales en los que se combinan sustancias
Se utilizan para mezclar sustancias y están fabricados normalmente en vidrio resistente debido a los cambios bruscos de temperatura y/o la acción de los reactivos químicos.
Estos materiales son los tubo de ensayo, el matraz y el vaso de precipitado, entre otros.
Tubo de ensayo
Es un tubo de vidrio o plástico de diferentes tamaños, con un lado abierto (aunque se puede tapar con un tapón) y el otro lado cerrado y con forma redondeada.
Se utiliza para disolver, calentar e incluso hacer reaccionar todo tipo de sustancias en pequeñas cantidades, ya que tiene un tamaño relativamente pequeño.

Tubos de ensayo tapados con tapones
Matraz
Es un recipiente de vidrio con forma esférica, fondo plano o redondeado y con cuello estrecho.
Se utiliza para contener y mezclar todo tipo de sustancias.

Matraz de fondo plano
Matraz erlenmeyer
Es un matraz de vidrio con forma de cono, fondo plano, cuello corto y su boca puede ser ancha o estrecha.
Se utiliza para calentar líquidos o para preparar soluciones.
Existen diversos tamaños y pueden tener graduación o no.

Matraz erlenmeyer

Definición
Disolución
Es la mezcla de dos o más sustancias que no reaccionan entre sí.
Soluto
Es la sustancia que está presente en menor proporción en una disolución.
Disolvente
Es la sustancia que está presente en mayor proporción en una disolución y en la que está disuelta el soluto. El disolvente más importante es el agua.
Vaso de precipitado
Es un recipiente normalmente de vidrio o plástico con forma cilíndrica y diversos tamaños.
Se utiliza para preparar, disolver e incluso calentar todo tipo de sustancias.

Vaso de precipitado
Balón de destilación
Es un matraz con otra conducción de salida de menor diámetro en su cuello.
Se utiliza para destilar líquidos, es decir, separar líquidos mediante un calentamiento.
Se hacen salir los vapores generados por el calentamiento a través de la salida lateral en dirección hacia el refrigerante.

Balón de destilación

Actividades
29. Identificar cuáles son los materiales en los que se combinan sustancias.
30. Dibujar la forma de cada uno de estos materiales.
Materiales de soporte y sujeción
Son los materiales que se emplean para soportar o sujetar otro material necesario para realizar análisis y/o pruebas en un laboratorio.
Los materiales más utilizados son:

Gradilla
Material de laboratorio de soporte y sujeción


Pinza de madera

Actividades
31. Identificar cinco materiales de soporte y sujeción.
32. Dibujar la forma de cada uno de estos materiales.
Otros materiales del laboratorio
Son materiales encontrados también con frecuencia en el trabajo de un laboratorio. Los materiales más utilizados son:

Frasco lavador

Mechero bunsen

Matraz kitasato
Material de laboratorio variado
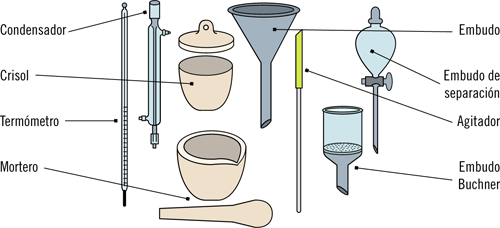

Papel de filtro

Papel de pH

Actividades
33. Investigar si los proveedores de materiales de laboratorio comercializan los materiales que se han estudiado. Revisar las características que tienen.
34. Dibujar la forma que tiene un embudo, un embudo buchner y un embudo de separación.
En cualquier laboratorio deben estar clasificados y ordenados todos los materiales y reactivos.
Clasificación y ordenación de materiales
Los materiales se pueden clasificar y ordenar en función de la sustancia de la que estén fabricados.
Materiales de vidrio
Son aquellos que tienen una elevada resistencia química frente al agua, a los ácidos y a las bases.
En los laboratorios solo se utilizan aquellos que tienen una elevada resistencia mecánica y son capaces de soportar temperaturas relativamente altas y cambios de temperatura (aunque no siempre son aptos para soportar cambios muy bruscos de presión ni de temperatura).

Nota
Es el material más abundante, y para evitar roturas suele ubicarse sobre superficies de madera.
Se ordenan por su forma y capacidad, es decir, se colocan juntos todos los vasos de precipitados, matraces, probetas, etc., y para cada uno de estos materiales se sitúan más próximos, normalmente en filas, los que tienen el mismo tamaño.
En los cajones o vitrinas donde se pueden encontrar se colocan etiquetas con el nombre de los materiales que hay en su interior por orden alfabético y con sus capacidades.
Existen diversos materiales de vidrio como las pipetas, matraces, vasos de precipitado, erlenmeyer, cristalizador, etc.

Cristalizador
Materiales de plástico
Son aquellos que tienen una elevada resistencia a la rotura, pero por el contrario, se pueden deteriorar por el ataque de ácidos o bases fuertes, e incluso por disolventes orgánicos.
Su clasificación y ordenación es igual que para los materiales de cristal, según el criterio de forma y capacidad.
Existen diversos materiales de plástico como las probetas, frascos lavadores, pipetas pasteur, etc.
Materiales de porcelana
Son aquellos que se utilizan para soportar muy altas temperaturas. No son tan utilizados como el cristal o el plástico.
Su clasificación y ordenación es igual que para los materiales de cristal, según el criterio de forma y capacidad.
Existen diversos materiales de porcelana como crisoles, embudos buchner, cápsulas, etc.

Cápsula de porcelana
Materiales metálicos
Los materiales metálicos son normalmente de hierro, acero o sus aleaciones.
Deben almacenarse separados del vidrio y la porcelana debido a que su mayor resistencia puede provocar la rotura de estos.
También se clasifican y ordenan por material de laboratorio correspondiente, es decir, las pinzas con las pinzas y las espátulas con las espátulas.
Existen diversos materiales de metales como los soportes, trípodes, pinzas, cucharillas, espátulas, etc.

Cucharilla espátula
Otros
Se encuentran también otros materiales como el corcho, utilizado en los tapones, la madera, empleada en gradillas o soportes de pie para tubos, el teflón, en mangueras o las llaves de bureta o el asbesto, utilizado en las rejillas.
También se clasifican y ordenan por el material de laboratorio correspondiente, por ejemplo, las gradillas con las gradillas.

Actividades
35. Identificar al menos dos materiales de laboratorio por cada material de fabricación. Por ejemplo, para el vidrio: un vaso de precipitados y una pipeta.
Clasificación y ordenación de reactivos
Por otro lado, como ya se sabe, en un laboratorio existen productos y reactivos químicos.

Definición
Reactivo químico
Sustancia que interacciona con otra en una reacción química para generar otras sustancias totalmente diferentes denominadas productos o productos de la reacción.
Algunos reactivos químicos se deben manipular con cuidado por su peligrosidad, y por ello, después de su utilización se tienen que guardar en un armario especial de seguridad.
Los reactivos químicos, al igual que los productos químicos, se pueden clasificar y ordenar en función de su naturaleza en reactivos inorgánicos y orgánicos.
Reactivos inorgánicos
Son productos químicos inorgánicos.
Su clasificación y ordenación se lleva a cabo en función de sus diferentes grupos, de forma que estén siempre separados unos de otros.
Los diferentes grupos se muestran a continuación.
Ácidos
Son reactivos inorgánicos en estado líquido con pH bajo, menor de siete, y normalmente muy corrosivos.
Se colocan por orden alfabético de su no metal, es decir, en el ácido sulfúrico (H2SO4), la letra para el orden alfabético es la S del azufre.
Bases
Son reactivos inorgánicos en estado sólido con pH alto, mayor de siete, y que se disuelven muy bien en agua.
Se colocan por orden alfabético de su metal, es decir, en el hidróxido de sodio (NaOH), la letra para el orden alfabético es la N del sodio.
Sales
Es el producto de la mezcla de un ácido con una base, por ejemplo, el cloruro sódico (NaCl) es la mezcla de ácido clorhídrico (HCl) con hidróxido sódico (NaOH).
Se colocan por orden alfabético de su metal, es decir, en el cloruro sódico (NaCl), la letra para el orden alfabético es la N del sodio.
Disoluciones preparadas
Son mezclas de reactivos inorgánicos, normalmente con agua, que se preparan para ser utilizadas en cualquier momento.
No se colocan de ninguna forma especial.
Reactivos orgánicos
Son productos químicos orgánicos que se suelen ordenar en dos grupos fundamentalmente: los indicadores y los disolventes debido a que son los reactivos orgánicos más numerosos en un laboratorio.

Definición
Indicador
Sustancia que al añadirla a otra o a una mezcla de otras sustancias provoca un cambio químico apreciable, y que consiste normalmente en una variación de color.
Estos y el resto de reactivos que no se encuentran incluidos en alguno de estos dos grupos se pueden clasificar según el tipo de compuesto orgánico, es decir, si es un alcohol, una amina, una amida, un ácido, un aldehído, etc.

Actividades
36. Realizar un esquema de los tipos de reactivos químicos que existen.
En un laboratorio, el producto o la sustancia más utilizada es el agua (H2O), tanto como disolvente, como para la limpieza de materiales.
Los tipos de agua para utilizar en el laboratorio de menor a mayor calidad son:

Sabía que...
Una traza es un elemento químico presente en una sustancia a analizar que se encuentra en una cantidad muy pequeña, del orden de 100 mg por kilogramo de sustancia a analizar.
Después del agua, los productos y reactivos químicos más comunes en un laboratorio son los siguientes:
| Ácido clorhídrico |
|
|
|
|
|
|
|
| Ácido sulfúrico |
|
|
|
|
|
|
|
|
|
|
|
|

Envase con ácido sulfúrico
| Ácido nítrico |
|
|
|
|
|
|
|
|
|
| Hidróxido de sodio o sosa caústica |
|
|
|
|
|
|
|
|

Granos de hidróxido sódico
| Hidróxido de potasio o potasa cáustica |
|
|
|
|
|
|
|
|

Granos de hidróxido de potasio
| Carbonato sódico |
|
|
|
|
|

Carbonato de sodio
| Cloruro de sodio o sal común |
|
|
|
|
| Acetona |
|
|
|
|
|
|

Definición
Fórmula molecular o fórmula química
Representación de los elementos que tiene un compuesto químico y de la proporción en la que se encuentran presentes.

Actividades
37. Identificar los tres tipos de agua que existen en un laboratorio independientemente del agua de la red, y ordenar por orden de calidad.
38. Indicar las diferencias comunes existentes entre las sustancias ácidas y las básicas.
Varias son las operaciones básicas para el tratamiento de sustancias que se llevan a cabo en un laboratorio habitualmente: la molienda, el tamizado, la precipitación, la filtración, la decantación, la evaporación y el secado, entre otras.
Se va a estudiar a continuación cada una de estas operaciones básicas de forma detallada.
Molienda
La molienda es una operación básica mecánica que consiste en reducir el tamaño de una sustancia normalmente sólida hasta convertirla en polvo mediante la trituración o el machaqueo sin alterar su naturaleza.
Es una operación utilizada en multitud de procesos en el laboratorio, debido a que es necesario, en muchas ocasiones, reducir el tamaño de una sustancia sólida.

Ejemplo
La reducción de tamaño de un producto químico sólido para poder disolverlo con mayor facilidad en un líquido, por ejemplo, el hidróxido sódico (NaOH), que es una sal, y que se comercializa en forma de grano, es preferible molerlo hasta pulverizarlo antes de echarlo en agua porque así se disolverá con mayor rapidez que si se echa en forma de grano.
Para llevar a cabo la molienda se pueden emplear pequeños molinos para triturar y reducir a polvo las sustancias sólidas, o un mortero con su mazo si la cantidad a moler es pequeña.
Tamizado
En el tamizado se vierten los sólidos sobre el tamiz, a través del cual pasan las partículas pequeñas, también llamadas finos, y no permiten el paso o retienen las partículas de mayor tamaño, también llamadas rechazos, no siendo capaces estas últimas de atravesar la luz de malla.
Las partículas de este rechazo tienen un tamaño superior a la luz de malla y las que han atravesado el tamiz, tienen un tamaño menor.
Para que se lleve a cabo la operación de tamizado correctamente es necesario agitar o mover el tamiz, para que las partículas de mayor tamaño retenidas, puedan moverse y dejar pasar las partículas de menor tamaño que pueden atravesar el tamiz.

Tamiz de laboratorio

Definición
Tamizado
Operación básica que consiste en la separación física de partículas sólidas de diferentes tamaños.
Tamiz
Es una malla de filamentos que se entrecruzan y que dejan unos orificios o huecos de diferentes formas, y que se denominan luz de malla.
Por tanto, un tamiz solo es capaz de llevar a cabo una separación en esas dos fracciones.
Pero si se quieren separar los sólidos en un número mayor de fracciones, y así clasificarlos por su tamaño, se pueden hacer pasar estos a través de una serie de tamices, uno encima de otro, de manera que desde arriba hacia abajo vaya disminuyendo el tamaño de luz de malla de cada tamiz.
Cuando estén colocados los tamices se depositan los sólidos en la parte superior, y los de menor tamaño irán pasando de tamiz en tamiz, descendiendo, y los de mayor tamaño permanecerán en los tamices superiores.
Esta operación de tamizado con varios tamices se puede llevar a cabo también en un laboratorio con una tamizadora.

Tamices en serie

Tamizadora con varios tamices

Actividades
39. Definir qué es la molienda e indicar algún ejemplo.
40. Meditar sobre cuántos tamices serían necesarios utilizar si se quieren tamizar cinco tamaños diferentes de distintas sustancias.
Precipitación
La precipitación es una operación básica que se caracteriza por la aparición de un compuesto insoluble (sólido), denominado precipitado, originado al mezclar dos disoluciones diferentes.
Normalmente, la aparición de un precipitado se produce por la adición de un reactivo que genera un producto insoluble (no se disuelve) con algunas de las sustancias químicas presentes en una disolución líquida, por ejemplo, formando el cloruro de plata (AgCl), que es un precipitado, en un vaso de precipitados o en un matraz erlenmeyer.
Otras veces es debido a que aumenta la proporción de una cantidad de sustancia disuelta en un líquido respecto a ese líquido hasta que llega un momento en que esa sustancia no se puede disolver más. Por ejemplo, si en un vaso de precipitados o matraz erlenmeyer se tiene una sal disuelta en agua destilada, y se continúa echando sal, llega un momento en que la sal no puede seguir disolviéndose y aparece en el agua elementos sólidos que son el precipitado.
La operación de precipitación se lleva a cabo en un laboratorio para la determinación de la presencia de una sustancia concreta o para separar una determinada sustancia de otra en una disolución.

Nota
La operación de precipitación se efectúa con la formación del precipitado, que se puede apreciar visualmente cuando el líquido deja de ser transparente para tener turbidez.
Para poder separar el precipitado (fase sólida) del líquido (fase líquida) es necesario realizar una operación básica que se estudiará a continuación y que se denomina filtración.

Formación de un precipitado en una disolución
Filtración
La filtración es el proceso en el que se separan partículas sólidas de un líquido mediante una barrera que puede consistir en mallas, fibras, material poroso o un relleno sólido.
La filtración, que es la operación más usual y con mayor resultado para separar una fase sólida de una líquida, se basa en que las partículas sólidas son mucho mayores que las moléculas líquidas, y no pueden atravesar un filtro.
Se lleva a cabo vertiendo una mezcla de sólidos y líquidos sobre un filtro que retiene las partículas sólidas y que permite el paso del líquido. Este líquido que atraviesa el filtro se denomina filtrado.
El filtro puede ser de diversos materiales, por ejemplo, papel poroso, y se seleccionará la porosidad del filtro en función del diámetro de las partículas que se pretenden separar.
La filtración se puede realizar por gravedad o al vacío.
Filtración por gravedad
Se utiliza un embudo con forma cónica.
El procedimiento para llevarlo a cabo es colocar el embudo de forma vertical, por ejemplo, sobre un aro metálico cogido sobre un soporte universal con una nuez. La parte inferior del embudo debe estar tocando la pared interior de un erlenmeyer para evitar el goteo del líquido al salir por el embudo. A continuación se coloca en la zona cónica del embudo, que queda en la zona superior, un papel de filtro circular que tiene forma de cono y que no debe ser superior a la longitud de la parte cónica. Después se debe añadir sobre el filtro unas gotitas de la mezcla para que se adhiera a las paredes del embudo. Entonces se vierte la mezcla a filtrar evitando que se llene más de dos tercios del cono. Para que no se produzcan salpicaduras al verter la mezcla se puede apoyar una varilla de vidrio sobre el pico del recipiente en el que se encuentra la mezcla para que el líquido fluya a través de esta.
Filtración por gravedad

Filtración al vacío
Se utiliza si se quiere filtrar con rapidez, si el sólido puede deteriorarse por estar demasiado tiempo en el filtro, o si es tan fino el sólido que puede obstruir los poros del papel de filtro.
Se usan normalmente embudos buchner con un papel de filtro por encima del embudo para retener el sólido.
El procedimiento para llevarlo a cabo es colocar el filtro encima del embudo buchner, y esté bien ajustado (a presión, es decir, sin que pueda entrar o salir aire) al material que tenga una salida para succión, normalmente el kitasato. Para realizar el vacío se suele utilizar una trompa de agua o una bomba de vacío que funcionan como aspiradores. En el kitasato se coloca el embudo buchner en la abertura superior ajustado con una goma o un tapón, y la línea de vacío por la abertura lateral. A continuación se echan unas gotitas de la mezcla sobre el filtro que se encuentra en el embudo para que este no se mueva y posteriormente se echa la mezcla poco a poco, evitando que esta se salga del embudo.
Filtración al vacío


Actividades
41. Investigar y encontrar el nombre de tres sustancias químicas que puedan precipitar en una disolución.
42. Explicar por qué tienen distinta formas los filtros utilizados en la filtración por gravedad y el utilizado en la filtración a vacío.
Decantación
La decantación es el proceso en el que se separan dos componentes debido a que existe una diferencia entre las densidades de ambos.

Nota
Un ejemplo típico es la separación del agua, que es más densa que el aceite.
La decantación se puede producir entre dos componentes, ya sean dos líquidos inmiscibles, es decir, que no se mezclan, o entre un sólido y un líquido.
La forma de llevarla a cabo en un laboratorio es la siguiente: tomar la mezcla de los dos componentes y transvasarlo a un embudo de decantación. A este se le coloca un tapón, y se agita el embudo de decantación. Entonces se espera un tiempo razonable para que decante, es decir, se separen y descienda el componente más pesado, que será el líquido de mayor densidad. La llave que tiene este embudo en su zona inferior se abre para sacar primero el líquido con mayor densidad, sobre un vaso de precipitados, por ejemplo, y se cierra cuando haya caído todo. A continuación se vuelve a abrir para que caiga sobre otro vaso de precipitados el líquido menos denso. Conviene que el decantador, cuando realice la función de decantar, se encuentre de forma vertical, por ejemplo sobre un aro metálico cogido en un soporte universal con una nuez.
Decantación con un embudo de decantación

Evaporación
La evaporación es la operación básica que consiste en la separación de una sustancia líquida volátil de otra u otras que no lo son y con las que está mezclada, al aplicarles calor.

Nota
Son líquidos volátiles aquellos que presentan una gran facilidad para pasar al estado gaseoso.
La evaporación normalmente se utiliza en el laboratorio para evaporar y, por tanto, separar en una disolución un disolvente volátil mediante el calentamiento de la disolución.
Por ejemplo, si se tiene sal disuelta en agua destilada en un vaso de precipitados o en una cápsula de porcelana, y se calienta, el agua poco a poco se irá evaporando. Por tanto, esta es una forma de aumentar el porcentaje de sal en el agua, e incluso se puede llegar a evaporar toda el agua y obtener la sal en estado sólido.
Para ello, el vaso de precipitados o la cápsula de porcelana con la sal disuelta en agua debe colocarse sobre una rejilla metálica encima de un trípode o sobre un aro metálico unido a un soporte universal, y por debajo de estos un mechero bunsen para calentar la disolución.
Evaporación

La evaporación se utiliza muy a menudo para la eliminación de agua de una mezcla de sustancias.
Secado
El secado es la operación básica que consiste en separar un líquido de un sólido, un líquido, o un gas que lo retiene físicamente mediante procedimientos no mecánicos.
Aunque se puede llevar a cabo en algunas ocasiones el secado de un líquido o de un gas en un laboratorio, este apartado se va a centrar en el secado de sólidos que es la operación más habitual.
El secado de un producto sólido se realiza de alguna de las siguientes formas, o utilizando más de una:

Desecador de vacío

Estufa de laboratorio

Definición
Punto de fusión
Es la temperatura a la que la materia cambia de estado sólido a estado líquido.

Actividades
43. Investigar si se puede llevar a cabo la evaporación de alguna otra forma más rápida que la estudiada. En ese caso, indicar los materiales y equipos que se necesitan.
44. Señalar cuál es el método más eficaz para el secado.
Destilación
La destilación es la operación básica que consiste en separar los distintos componentes líquidos y sólidos disueltos de una mezcla mediante un aporte de calor para pasar el líquido a estado gaseoso y a continuación realizar un enfriamiento para transformarlo de nuevo a estado líquido.
Esta es la operación básica más importante de separación y purificación de líquidos.
Extracción
La extracción es la operación básica que consiste en extraer una sustancia disuelta en un disolvente mediante la adición de un segundo disolvente inmiscible con el anterior y en el que la sustancia se disuelve mejor.
Para ello, después de la adición del segundo disolvente mediante decantación, se separan los dos disolventes, ya con la sustancia extraída por el segundo disolvente.
Esta es la operación que más se utiliza para separar un compuesto orgánico de una muestra o de una disolución, añadiendo el disolvente adecuado y mediante una decantación posterior.

Aplicación práctica
Imagine que trabaja en un laboratorio químico y el jefe de laboratorio le pide que preparare una mezcla de hidróxido de potasio (KOH) y agua destilada (H2O). Para ello ha tomado con una cucharilla varios granos de KOH de su envase y colocados en un vidrio de reloj para su pesada, ya que se quiere obtener un peso de 5 g exactamente. Sin embargo, con esos granos no es posible obtener una pesada de 5 g, y además, cuando se vaya a mezclar con H2O, es posible que tarden mucho tiempo en disolverse. En este caso, ¿cuál es la operación básica necesaria para que el KOH tenga un tamaño adecuado para poder pesar 5 g y que posteriormente se pueda disolver con mayor facilidad en H2O? Razone la respuesta. ¿Qué materiales de laboratorio son necesarios y cómo debe llevarse a cabo el proceso?
SOLUCIÓN
La operación básica necesaria es la molienda, ya que esta operación consiste en reducir el tamaño de una sustancia sólida, lo que es preciso para realizar la pesada exacta de 5 g y disolver con facilidad el KOH en el H2O.
Es necesario solamente un mortero con su mazo. Se introduce el KOH en forma de grano en el mortero, y con su mazo se muele hasta obtener prácticamente polvo.

Aplicación práctica
Imagine que trabaja en el laboratorio de calidad de una industria que fabrica hormigones. Ha llegado una partida de arena de la cual se han tomado 50 kg para comprobar la calidad de esta y si cumple con la norma correspondiente sobre el tamaño mínimo que debe tener. La prueba consiste en saber, para diferentes tamaños de grano de arena, la cantidad de arena que hay. Para este caso, ¿cuál es la operación básica necesaria? Razone la respuesta. ¿Qué materiales de laboratorio son necesarios? ¿Cómo debe llevarse a cabo la operación?
SOLUCIÓN
La operación básica necesaria es el tamizado, ya que esta operación consiste en separar la arena por tamaño de grano.
Es necesario un tamiz por cada tamaño mínimo de arena que se quiera separar, y también es conveniente el uso de una tamizadora, ya que en este tipo de pruebas es muy habitual el uso de esta herramienta.
Se colocan los tamices en la tamizadora, un tamiz por cada tamaño mínimo que se quiera obtener de arena. Los tamices se pondrán de la siguiente manera: el de mayor luz de malla, el primero en la zona superior, y se irá disminuyendo el tamaño de luz de malla conforme se va descendiendo. Cuando estén colocados los tamices y preparada la tamizadora se hace pasar la arena por la zona superior, y esta empieza a descender pasando de tamiz en tamiz. La arena con tamaño de grano mayor quedará retenida en los tamices superiores y la de tamaño menor en los tamices inferiores. A continuación se pesa la cantidad de arena que tiene cada tamiz. Así se obtiene la cantidad de arena que tiene un diámetro mínimo, correspondiendo este diámetro a la luz de dicho tamiz.

Aplicación práctica
Imagine que trabaja en un laboratorio químico y ha llegado una muestra líquida que hay que analizar para obtener la cantidad de cloruro sódico (NaCl) que está presente en la muestra. Para ello prepara una mezcla de nitrato de plata (AgNO3) y agua destilada (H2O) que agrega a la muestra en un vaso de precipitados. A continuación se aprecia cómo la mezcla de la muestra, AgNO3 y H2O, deja de ser totalmente transparente y aparece una turbidez en forma de sustancia insoluble por la formación de cloruro de plata (AgCl). ¿Cuál es la operación básica que ha tenido lugar? Razone la respuesta.
SOLUCIÓN
La operación básica que ha tenido lugar es la precipitación, ya que ha aparecido un precipitado, es decir, una sustancia insoluble o un sólido cuando se han mezclado dos disoluciones diferentes, la muestra que tenía NaCl y la disolución preparada de AgNO3 y H2O.

Aplicación práctica
Imagine que trabaja en un laboratorio químico y que tiene una disolución con un precipitado sólido de cloruro de plata (AgCl) que quiere separar. Teniendo en cuenta que no tiene ni el embudo buchner ni el kitasato, ¿cuál es la operación básica que se debe llevar a cabo? Razone la respuesta. ¿Qué materiales de laboratorio son necesarios? ¿Cómo debe llevarse a cabo la operación?
SOLUCIÓN
La operación básica es la filtración por gravedad ya que se quiere separar un sólido de un líquido, y la forma más usual de llevarlo a cabo y con mejor resultado es mediante la filtración. Además no se tienen dos materiales necesarios para la filtración a vacío, como son el embudo buchner y el kitasato.
El material adecuado es un embudo, un filtro para colocar en el embudo, un soporte universal, un aro metálico para sostener el embudo y que esté fijado al soporte universal mediante una nuez, una varilla de vidrio y un matraz erlenmeyer para recoger el líquido que pase por el filtro.
Primero debe preparase el filtro, que debe tener forma cónica para situarlo sobre el embudo. A continuación se coloca el embudo de forma vertical encima del aro metálico, dejando debajo del embudo el erlenmeyer. La parte inferior del embudo estará tocando la pared interior del erlenmeyer. A continuación se pone el papel del filtro con forma de cono sin que supere en altura la zona cónica del embudo. Se añaden unas gotitas de mezcla sobre el filtro para que se adhiera a la pared del embudo. Después se vierte la mezcla a filtrar intentando que no se llene más de dos terceras partes del cono del filtro. Para que no se produzcan salpicaduras al verter la mezcla se puede apoyar una varilla de vidrio sobre el pico del recipiente en el que se encuentra la mezcla para que el líquido fluya a través de ella. El sólido quedará retenido en el filtro, y el líquido pasará a través del filtro hasta el erlenmeyer.

Aplicación práctica
Imagine que trabaja en un laboratorio químico y que tiene que separar dos sustancias inmiscibles líquidas como son el agua y el aceite, ¿cuál es la operación básica que se debe llevar a cabo? Razone la respuesta. ¿Qué materiales de laboratorio son necesarios? ¿Cómo debe llevarse a cabo la operación?
SOLUCIÓN
La operación básica es la decantación ya que se quiere separar dos líquidos con diferentes densidades.
El material necesario es un embudo de decantación y un tapón para cerrarlo por su zona superior, un aro metálico para sostener el embudo de decantación y que esté fijado al soporte universal mediante una nuez, y un matraz erlenmeyer para recoger el líquido que salga del embudo de decantación.
Primero se introduce la mezcla de agua y aceite en el embudo de decantación y se tapa el embudo con su tapón. A continuación se agita el embudo y se coloca de forma vertical sobre el aro metálico, colocando debajo del embudo un matraz erlenmeyer. Se deja esperar un tiempo razonable para que el agua, que es más pesada decante y descienda, y el aceite ascienda. Después se abre manualmente la llave del embudo de decantación y se deja salir la fase más pesada, es decir, el agua. Cuando haya salido todo el agua se cierra, y se cambia el erlenmeyer para recoger a continuación el aceite. Se vuelve a abrir el embudo con la llave y se recoge el aceite.

Aplicación práctica
Imagine que trabaja en un laboratorio químico y que tiene una disolución de cloruro sódico (NaCl) disuelto en agua destilada (H2O). Le indican que hay que eliminar el H2O y obtener NaCl sólido, ¿cuál es la operación básica que se debe llevar a cabo? Razone la respuesta. ¿Qué materiales de laboratorio son necesarios? ¿Cómo debe llevarse a cabo la operación?
SOLUCIÓN
La operación básica a realizar es la evaporación a través de calor, ya que es el procedimiento adecuado para separar dos sustancias mezcladas debido a que una de ellas es volátil, el agua, y la otra no lo es, el cloruro sódico.
El material necesario es una cápsula de porcelana, un soporte universal, una rejilla para sostener la cápsula de porcelana, un aro metálico para sostener la rejilla, una nuez para agarrar el aro metálico y el mechero bunsen debajo de la rejilla.
Primero se introduce la mezcla en la cápsula de porcelana que se coloca encima de la rejilla, y esta a su vez encima del aro metálico que está unido al soporte universal. Debajo de la rejilla se coloca el mechero bunsen que comienza a calentar la mezcla. El agua poco a poco irá evaporándose hasta que se obtenga el cloruro sódico en estado sólido.

Aplicación práctica
Imagine que trabaja en un laboratorio químico y que le ha llegado una muestra sólida a la que hay que quitarle la humedad para analizarla, ¿cuál es la operación básica que se debe llevar a cabo? Razone la respuesta. ¿Cómo debe llevarse a cabo la operación si es necesario con urgencia y la muestra tiene una alta temperatura de fusión?
SOLUCIÓN
La operación básica es el secado porque mediante un método no mecánico separa un líquido, en este caso el agua de la humedad, de un sólido, en este caso la muestra.
Primero se debe introducir en una estufa, y cuando esté seca se meterá en el interior de un desecador de vacío para que se enfríe y para evitar que vuelva a absorber humedad.
La masa es una magnitud física que mide la cantidad de materia que tiene un cuerpo.
El volumen es una magnitud física que mide el espacio ocupado por un cuerpo.
Para medir la masa y el volumen de sólidos y líquidos se utilizan sus unidades fundamentales, sus múltiplos y sus submúltiplos.

Definición
Múltiplo
Es una unidad secundaria mayor que la unidad fundamental y que se utiliza cuando la masa o el volumen a medir son muy grandes.
Submúltiplo
Es una unidad secundaria menor que la unidad fundamental y que se utiliza cuando la masa o el volumen a medir son muy pequeños.
La unidad fundamental para medir una masa en el Sistema Internacional de unidades (SI) es el gramo (g).
El kilogramo (kg) es un múltiplo del gramo y el miligramo (mg) es un submúltiplo.
El gramo, el kilogramo (kg) y el miligramo (mg) son los más utilizados para medir una masa.
La relación entre los tres es la siguiente:
1 kg = 1.000 g = 1.000.000 mg
La unidad fundamental para medir un volumen en el Sistema Internacional de unidades es el metro cúbico (m3) y corresponde al espacio que hay en el interior de un cubo con un metro de lado o arista.
Un metro cúbico o un cubo de un metro de arista

Normalmente, en un laboratorio se utilizan más a menudo los submúltiplos del metro cúbico, que son el decímetro cúbico (dm3) y el centímetro cúbico (cm3), y que corresponden al espacio que hay en el interior de un cubo con un decímetro (0,1 metro) y un centímetro (0,01 metro) de lado respectivamente.
La relación entre metro cúbico, decímetro cúbico y centímetro cúbico es la siguiente:
1 m3 = 1.000 dm3 = 1.000.000 cm3
Pero además, para medir el volumen de un líquido se puede utilizar la capacidad del recipiente en el que se encuentra y, por tanto, se pueden utilizar unidades de capacidad, como el litro (l), unidad fundamental, y el mililitro (ml), como submúltiplo. La relación entre ambos es:
1 l = 1.000 ml
Para relacionar unidades de volumen y capacidad se pueden utilizar las siguientes equivalencias:
1 l = 1 dm3
1 ml = 1 cm3

Actividades
45. Calcular cuántos miligramos son 12,52 g.
46. Calcular cuántos litros son 1.230 cm3.
Para realizar el análisis o el estudio de una sustancia, y que sea este correcto, se deben tomar una o varias muestras representativas de esta sustancia, lo que significa que la muestra contendrá la misma proporción de componentes que la sustancia a analizar o estudiar. Por tanto, la toma de muestra es una etapa muy importante, y si no se realiza correctamente puede dar lugar a un análisis o estudio erróneo de una sustancia.

Recuerde
La muestra es una parte o porción de un material tomada y seleccionada de tal manera que sea representativa.
Por ejemplo, si se quiere realizar un estudio de los contaminantes que tiene un vertido líquido de una industria se puede tomar una cantidad de agua de la conducción de salida de aguas residuales de la industria. Esta cantidad de agua, que es la muestra, debe tener un volumen mínimo necesario para que se pueda realizar correctamente el análisis o estudio de los contaminantes presentes en la misma, y proporcionará las características que tiene el vertido.
El muestreo que es el método para realizar la toma de muestra depende, entre otros factores, de la naturaleza de las sustancias que se quieran estudiar o analizar, ya que en función de estas se deberá realizar de una forma o de otra.
Existen diversas maneras de realizar el muestreo en función de la naturaleza de las sustancias que se quieran estudiar o analizar, aunque existen unas normas generales para todas ellas.
El muestreo de productos líquidos se puede llevar a cabo de varias formas en función de las circunstancias y características que tenga el líquido.
Muestreo de productos líquido en movimiento
En el muestreo de productos líquidos en movimiento se considera que el líquido es homogéneo en todos los lugares en los que se encuentra y por donde circula debido a que está en movimiento.

Definición
Líquido homogéneo
Es aquel líquido que es exactamente igual en todas sus partes, es decir, tiene la misma estructura y composición.
En este tipo de muestreo, cualquier porción que se tome en cualquier punto es representativa. Solo es necesario tomar una única muestra con el volumen mínimo necesario para realizar adecuadamente el análisis o el estudio.
Algunos ejemplos son las conducciones o tuberías de una industria o un tanque o depósito con agitación mecánica constante.
En caso de realizarse sobre la salida de una conducción o tubería se desecharán las primeras porciones del líquido. Además, si la velocidad del líquido es lenta, se debe provocar una turbulencia, es decir, una agitación del líquido antes de salir de la conducción mediante un estrechamiento o un codo en la tubería. Con esto último se consigue que la muestra de líquido sea más homogénea.
Muestreo de productos líquidos que no están en movimiento
En el muestreo de productos líquidos que no están en movimiento sucede que los líquidos están compuestos de diferentes sustancias y cada una de ellas tiene distinta densidad.
Al estar almacenado en un depósito y no estar en movimiento, las sustancias con mayor densidad o más pesadas tienden a descender y las de menor densidad o menos pesadas tienden a ascender.
De esta manera, el líquido almacenado tendrá en la zona superior mayor número de sustancias con menor densidad y en la zona inferior mayor número de sustancias con mayor densidad. Por tanto, el líquido no será homogéneo en todo su volumen sino lo contrario, es decir, heterogéneo, e irá variando su composición a diferentes profundidades.
El tipo de muestreo a realizar en este caso es el muestreo estratificado, es decir, se toman muestras a diferentes profundidades. A continuación se mezclan todas las muestras que se han tomado a distintas profundidades para obtener una muestra media, que será la muestra a enviar al laboratorio.
Algunos ejemplos son la mezcla de líquidos o líquidos con sólidos suspendidos en el líquido y que en ambos casos se encuentran almacenados en depósitos o tanques cerrados sin agitación.
Muestreo de productos líquidos envasados
Para productos líquidos envasados se realizará el muestreo del mismo modo que para los productos sólidos envasados.
Cuando el volumen de las diferentes porciones de muestra que se tomen sea superior a la capacidad del contenedor o envase que se va a utilizar para transportar la muestra, se tomarán otro u otros contenedores o envases hasta que se obtengan todas las porciones de muestra.
Cuando se tengan todas las porciones se prepara una muestra compuesta por el contenido de todos los contenedores o envases.
Teniendo en cuenta que un sólido a granel no es homogéneo, sino heterogéneo, el muestreo de sólidos a granel se lleva a cabo de dos maneras:
Dos ejemplos de las zonas o puntos a muestrear sobre un sólido a granel

Método de cuarteado

El muestreo de productos sólidos envasados debe hacerse de forma aleatoria o al azar.
Existen diferentes formas, y una de ellas es tomar un número de muestras igual a la raíz cuadrada del número de unidades del lote a realizar el muestreo.
Por ejemplo, si hay que muestrear 81 envases de 250 g de productos sólidos, se pueden tomar 9 muestras de los 81 envases. Para seleccionar las 9 muestras de los 81 envases se emplean diversos métodos:
Parte de una tabla de números aleatorios


Ejemplo
Para muestrear los 81 envases anteriores, si se quieren extraer 9 muestras mediante las tablas de números aleatorios, se pueden tomar por ejemplo los nueve primeros números leídos horizontalmente, despreciando aquellos números repetidos y aquellos con valor entre 82 y 99, ambos inclusive. Para la parte de la tabla con números aleatorios de la imagen siguiente serían el 26, 45, 74, 77, 51, 43, 37, 29 y 27, siendo este último de la segunda fila.
Cuando se hayan elegido los envases a muestrear se homogeniza la muestra, por ejemplo, mediante una agitación del contenido sólido del envase, y entonces se toma una porción de este contenido. A continuación se mezclan las distintas porciones para integrar una muestra representativa, a ser posible, en un mismo contenedor o envase.

Actividades
47. Indicar cómo realizar el muestreo a 49 sacos de productos sólidos.
Para cualquier tipo de toma de muestra siempre se debe tener un plan de muestreo. Este es un procedimiento donde se indica el número de muestras a tomar y cómo tomarlas, materiales a utilizar, conservación y transporte de la muestra, el análisis a realizar a dichas muestras, e incluso, la interpretación de los resultados.
En el ámbito de actividad de laboratorios industriales lo habitual es tener dos tipos de muestras, las microbiológicas y las fisicoquímicas, y dependiendo del tipo de muestras a tomar, el procedimiento de toma de muestra será diferente.
Pero, para realizar una toma de muestra para un análisis microbiológico, es necesario conocer primero qué es la microbiología, y cómo se aplica a nivel industrial.

Definición
Microbiología
Es la rama de la biología que se encarga del estudio de los microorganismos, es decir, seres vivos muy pequeños como bacterias, virus, hongos y protozoos, y solo visibles mediante microscopio.
En la industria también se utilizan los microorganismos en gran cantidad de operaciones, por ejemplo, para la fabricación en procesos industriales alimentarios como la fermentación de la cebada para obtener cerveza, o en los procesos de tratamiento de aguas residuales de las industrias.
Para llevar a cabo una toma de muestras para un análisis microbiológico se deben utilizar siempre recipientes, tapones y materiales esterilizados en una estufa o un autoclave, que deben ser cuidados correctamente para evitar su contaminación. Si es posible, es mejor utilizar recipientes intactos y sin abrir, es decir, que no hayan sido usados con anterioridad. Estos envases o recipientes para muestras tendrán además una envoltura externa de plástico transparente para protegerlos de una posible contaminación.

Sabía que...
Un autoclave es un aparato metálico y cierre hermético que trabaja a altas presiones y temperatura, y se utiliza para esterilizar material de laboratorio con vapor de agua.

Autoclave de laboratorio
En caso de no disponer de algún material puntual esterilizado, o si se ha utilizado anteriormente, se puede esterilizar in situ, por ejemplo, mediante inmersión en algún envase con alcohol (etanol al 96%) o con alguna otra técnica como, por ejemplo, el flameo con un mechero de alcohol.
Se deben usar envases de vidrio borosilicatado o polipropileno, resistentes a la esterilización, con boca ancha y tapa roscada o tapón esmerilado. También se pueden utilizar bolsas estériles con cierre hermético, por ejemplo, de 125 o 250 ml.

Tapón esmerilado
Cuando se realice la toma de muestra se debe actuar cuidadosamente, y a la vez con rapidez, ya que los recipientes esterilizados se deben tener abiertos el menor tiempo posible para evitar la contaminación (solamente para introducir la muestra y cerrarlo inmediatamente). Se deben utilizar siempre guantes estériles.
En ningún momento se tocará el interior del recipiente, ni siquiera el borde de la boca ni el interior de la tapa. Tampoco se debe permitir la contaminación de la tapa abierta, por ejemplo, por contacto. La tapa debe estar hacia abajo el tiempo que esté el recipiente abierto.
Al llenar el envase con la muestra a analizar se dejará aire suficiente entre la muestra y el tapón de cierre para agitar y homogeneizar la muestra, aproximadamente el 10–20% del volumen del recipiente.
Al realizar la toma de muestras de líquidos, el envase no se debe enjuagar con el líquido a muestrear y se debe tomar la cantidad de muestra necesaria para el análisis.
Nunca se debe tomar muestras en lugares polvorientos ya que puede contaminar la muestra, excepto si dicha contaminación es parte de la muestra.
La toma de muestra de líquidos, que es la más habitual, se puede llevar a cabo en diversos lugares, aunque estos se pueden agrupar en tres categorías diferentes: la toma de muestra en grifos, en tanques de almacenamiento profundos y en tanques de almacenamiento no profundos.
Toma de muestra en grifos
Este tipo de toma de muestra no debe realizarse nunca si existen fugas en los grifos que puedan contaminar la muestra. Primero se debe limpiar el orificio de salida con una gasa o algodón estéril empapado, por ejemplo, en hipoclorito sódico (NaClO). A continuación se deja correr el líquido hasta que pasen unos tres minutos, y de esa manera, no tomar aquella muestra que pudiese estar retenida en la tubería. En las proximidades del orificio se quitará el tapón de envase y la envoltura de protección. No se debe enjuagar el envase, y cuando se haya tomado la muestra se debe colocar de nuevo el tapón y la envoltura de protección del envase.
Toma de muestra en un tanque de almacenamiento no profundo
Es importante lavarse las manos y los brazos con agua y jabón, y quitarle la envoltura de protección. A continuación se debe sumergir el envase en el líquido tapado, con el tapón en dirección hacia abajo unos 15 o 30 cm. Después se abre el tapón y se coloca abierto en posición normal, con la boca del envase hacia arriba y llenándose de líquido. Después se cierra, se saca el envase del líquido y se coloca de nuevo la envoltura de protección.
Toma de muestra en un tanque de almacenamiento profundo
Se utiliza un envase en forma de botella dentro de un cesto y amarrado con una cuerda limpia. Se quita el tapón y la envoltura de protección a la vez para evitar la contaminación de estos. El cuello del tapón se colocará hacia abajo y se desenrollará la cuerda con lentitud sin que la botella toque las paredes del tanque hasta llegar a la profundidad necesaria. Cuando se realice la toma de muestra se debe colocar inmediatamente el tapón y la envoltura de protección.

Recuerde
Utilizar siempre recipientes para muestras, tapones y materiales esterilizados.
Los recipientes para muestras tendrán una envoltura de protección y no se deben abrir si no es para realizar la toma de muestra.
Las muestras deben almacenarse en envases de vidrio o plástico (teflón o polietileno) y con tapa roscada herméticamente. El vidrio se utiliza para la detección de sustancias orgánicas y el plástico para inorgánicas.
Estos envases deben ser lavados de manera específica con jabón y disolventes y enjuagados con agua destilada o desionizada.
La toma de muestra se debe realizar con mucho cuidado y sin que se pueda contaminar el interior del envase, el tapón o la boca del envase.
Para una muestra líquida, antes de tomarla, se enjuagará el recipiente que contendrá la muestra con el mismo líquido a muestrear dos o tres veces. Este líquido no se devolverá al punto donde se va a tomar la muestra excepto si se evita de alguna manera que esta pueda afectar sobre la muestra.
Los envases deben llenarse hasta su borde sin dejar aire entre la muestra y el tapón del envase.
Este tipo de muestras también se toma de grifos, de tanques de almacenamiento profundos y de tanques de almacenamiento no profundos y se procede igual que para el análisis microbiológico.

Actividades
48. Explicar qué procedimiento de toma de muestra cree que es más estricto o escrupuloso con la contaminación de la muestra (el que se realiza para análisis microbiológico o el que se realiza para análisis fisicoquímico). Razonar la respuesta.
49. Buscar dos procedimientos de toma de muestra, uno para análisis microbiológico y otro para análisis fisicoquímico de aguas residuales. Verificar que en los procedimientos se tienen en cuenta todos los conocimientos adquiridos en este epígrafe.
Para la toma de muestra es necesario tener equipos de muestreo y materiales adecuados para ello.
Seguidamente se detallarán cuáles son esos equipos y los materiales empleados.
Los equipos de muestreo o muestreadores a utilizar en esta actividad se pueden desglosar en dos grupos.
Equipos para el muestreo de líquidos
Se pueden utilizar los siguientes sistemas:
Botella en un cesto portador

Equipos para el muestreo de sólidos
Se pueden utilizar los siguientes equipos:
Sonda simple para la toma de muestra en sacos

Sonda tipo bayoneta simple

Sonda tipo bayoneta de alvéolos


Actividades
50. Indicar un equipo de muestreo que se puede utilizar para muestrear líquidos en un depósito sin agitación si se realiza desde una zona que se encuentra a bastante altura desde el líquido. Explicar el uso del equipo.
51. Indicar un equipo de muestreo que se pueda utilizar para muestrear sólidos a granel a diferentes profundidades. Explicar el uso del equipo.
También hay diverso material que se puede utilizar en el muestreo tanto líquido como sólido, este puede ser:

Bolsas de plástico estériles
Para la toma de muestra para análisis microbiológico es necesario que todo el material tenga un envoltorio de protección individual y haya sido previamente esterilizado.
Además, los recipientes que deben contener la muestra, también deben estar esterilizados y deben ser irrompibles.
Para este tipo de análisis se debe tener además un mechero de alcohol y un recipiente pequeño de alcohol para esterilizar la varilla del termómetro o algún otro pequeño material utilizado y que sea necesario volver a usar.
Es necesario tener en cuenta una serie de aspectos muy importantes para el buen análisis y estudio de la muestra desde el momento de la toma hasta que llega al laboratorio. Estos aspectos son la identificación, manipulación, conservación y transporte de la muestra.
Inmediatamente después de la toma de muestra se debe identificar correctamente el recipiente que la contiene mediante una etiqueta indeleble, que debe estar bien fijada, en el exterior del recipiente.
El procedimiento se lleva a cabo de esta manera para prevenir confusiones en su identificación y aportar la mayor información posible al envase de la muestra y, por tanto, a la muestra misma.
Las etiquetas, aunque pueden tener mucha más información, deben contener al menos la siguiente:

Recuerde
El etiquetado de las muestras debe contener al menos la siguiente información: número de muestra, descripción de la sustancia, persona que ha realizado el muestreo, lugar, día y hora en que se ha realizado la toma de muestra, metodología de muestreo llevada a cabo e incidencias durante el muestreo.
Esta información es muy importante cuando se vayan a interpretar los resultados de las analíticas y estudios de la muestra, e incluso, en ciertas ocasiones, puede llegar a justificar la aparición de resultados que no tienen ningún sentido.
Una vez recogidas las muestras se deben entregar al laboratorio lo antes posible y evitar todo tipo de alteraciones.
Para el análisis microbiológico deben ser analizadas antes de una hora y como máximo antes de seis. Para el análisis fisicoquímico deben ser analizado antes de 24 horas.
En referencia a la conservación de muestras, en algunos casos, las muestras pueden tener componentes inestables, es decir, sustancias que varían sus características químicas, no siendo eficaz por tanto su análisis posterior. En esos casos, las muestras deben ser transportadas a una temperatura fría entre 2 y 4 °C, como por ejemplo, las muestras para análisis microbiológico. Si son muestras biológicas, como los alimentos, se deben transportar congeladas (–20 °C). Para estos casos se utilizarán envases térmicos herméticos.
Además, las muestras se conservan mejor en la oscuridad, y en algunos casos concretos, para conservarlas durante más tiempo, se les puede añadir algunos compuestos químicos.
El envase que contendrá la muestra debe estar herméticamente cerrado, y debe ser seleccionado con sumo cuidado, debido a que si no es el adecuado, puede contaminar la muestra.

Importante
Los envases de plástico, excepto los fabricados en teflón (politetrafuoruroetileno), pueden introducir sustancias orgánicas a las muestras, por lo que no será adecuado para aquellas que contengan compuestos orgánicos.
Para el análisis de compuestos orgánicos se deben utilizar los recipientes de vidrio, y para compuestos inorgánicos los recipientes de plástico, por ejemplo, teflón o polietileno.
Para muestras microbiológicas se deben emplear los recipientes de vidrio borosilicatado y polipropileno esterilizados.
Otras circunstancias básicas que se deben tener en cuenta durante el transporte y para la conservación de la muestra son:

Actividades
52. Identificar al menos diez materiales que pueden ser necesarios en el muestreo.
53. Indicar la información mínima que debe contener la etiqueta de una muestra.
54. Indicar tres buenas actuaciones para una adecuada manipulación, conservación y transporte de una muestra.

Aplicación práctica
Imagine que trabaja en un laboratorio químico y que le ha pedido el jefe de laboratorio que realice una toma de muestra de un líquido en un depósito con agitación continua para realizar posteriormente un análisis fisicoquímico de sustancias inorgánicas. Después de realizar la toma de muestra debe llevarla al laboratorio. ¿Qué medidas tendrá que tomar para mantener y conservar la muestra adecuadamente y que no sufra ningún deterioro o problema?
SOLUCIÓN
Las actuaciones a tomar para mantener y conservar la muestra adecuadamente son:
Para llevar a cabo operaciones auxiliares elementales en un laboratorio y en procesos de la industria química y afines es necesario conocer qué son las materias primas y los productos químicos, los tipos de productos químicos, tanto orgánicos como inorgánicos, las clases de envases y el material de acondicionamiento.
Además se debe saber identificar y entender los tipos de pictogramas y las características que tienen todas las etiquetas de los productos químicos, tanto las antiguas como las nuevas, con toda su información e indicaciones.
También es conveniente conocer cuáles son las dependencias típicas de un laboratorio y su mobiliario.
Es imprescindible distinguir los tipos de pipetas, volumétrica de enrase simple, volumétrica de enrase doble, graduada y pasteur, además de cuándo y cómo se deben utilizar y cuáles son sus características. También es importante conocer otros materiales volumétricos como son la probeta, bureta y matraz aforado, y cómo se lleva a cabo su mantenimiento.
También es fundamental saber los tipos de balanzas que existen y cuál se debe utilizar en cada momento. Las balanzas electrónicas son las más usadas, y cabe destacar las balanzas analíticas que son mucho más precisas que las granatarias.
Por otro lado es necesario aprender sobre cuál es el sistema de clasificación y ordenación tanto de los materiales como de los reactivos químicos.
Es imprescindible conocer qué es, cómo y con qué materiales se realizan en el laboratorio las operaciones básicas de molienda, tamizado, precipitación, filtración, decantación, evaporación y secado.
Y, por último, se deben tener conocimientos sobre las técnicas de muestreo para productos líquidos, sólidos a granel y productos sólidos envasados.

Ejercicios de repaso y autoevaluación
1. La sustancia formada por la unión de dos o más elementos químicos o una mezcla de sustancias que tienen una función concreta es la definición de...
2. Los productos químicos que en contacto con sustancias inflamables dan lugar a una reacción con desprendimiento de mucho calor y/o energía son:
3. Complete los huecos con las siguientes palabras: cuadrado, rojo, vértice, blanco y negro.
“Los pictogramas de peligro del etiquetado nuevo se caracterizan porque están formados por un símbolo ___________ sobre un fondo ___________, con un marco __________, y con forma de ___________ apoyado sobre un ___________”.
4. Con respecto al almacenamiento de productos químicos...
5. ¿Cuáles son los tres tipos de pipetas que se pueden encontrar en un laboratorio?
6. La bureta...
7. De las siguientes frases, indique cuál es verdadera o falsa.
En los laboratorios, la balanza mecánica es más utilizada que la electrónica.
La balanza analítica proporciona pesadas con valores de cuatro o cinco decimales de gramo.
Para realizar una pesada correctamente NO es importante el lugar y las condiciones ambientales en las que se encuentre la balanza.
8. Relacione los siguientes elementos:
9. El ácido sulfúrico...
10. Complete la siguiente oración.
“La filtración es la operación básica en la que se separan partículas __________ de un ____________ mediante una _____________”.
11. Defina el concepto de evaporación completando la frase.
“La evaporación es la operación básica en la que al aplicar ___________ se separa una sustancia ___________ volátil de otra u otras que no lo son y con las que está __________”.
12. Un muestreo realizado de forma correcta es:
13. De las siguientes frases, indique cuál es verdadera o falsa.
En la toma de muestra para análisis microbiológico se deben utilizar siempre recipientes, tapones y materiales esterilizados.
Para la toma de muestra para análisis fisicoquímico, al llenar el envase o recipiente, se dejará aire suficiente en la muestra.
Para la toma de muestra para análisis microbiológico se pueden utilizar envases de vidrio borosilicatado o polipropileno con boca ancha, tapa roscada o tapón esmerilado.
14. Relacione los siguientes elementos:
15. Para la manipulación, conservación y transporte de la muestra se debe tener en cuenta que...