2
Todo sobre el funcionamiento de la microbiota
DEL NERVIO VAGO AL ALMA
Existen varios caminos que conectan la microbiota con el cerebro. ¿Qué vías toman las bacterias de nuestros intestinos para actuar sobre él?
La primera es la vía anatómica, la más evidente: la del nervio vago. El vago es el nervio más largo de nuestro organismo. Se trata de una extensa red que parte del cerebro y envuelve las vísceras, sobre todo el corazón, los pulmones y el intestino delgado (pero no el grueso). Su activación no depende de nuestra voluntad: es automática.
El nervio vago es el pacificador de nuestro organismo, el director de orquesta que indica que debemos ir piano piano. Se activa cuando nos encontramos en reposo, es decir, cuando nuestro organismo no está en alerta. Favorece la digestión y la movilidad de los intestinos, gracias a la cual los alimentos avanzan a lo largo de nuestro tubo digestivo. Por eso las personas que sufren estrés padecen en ocasiones estreñimiento o el fenómeno contrario: diarrea. Se debe a que sus intestinos se desajustan por la alteración del nervio vago. Entre mis pacientes suelo identificar a los que padecen ansiedad porque a menudo presentan trastornos digestivos.
El 80 por ciento de la información del nervio vago circula desde los intestinos hacia el cerebro, donde se procesa de manera no consciente (por suerte para nosotros, porque así podemos concentrarnos en otras cosas). Esto significa que nuestro cerebro registra a cada instante nuestro estado interno y responde a él.
El mecanismo por el que las bacterias intestinales activan el nervio vago aún no está suficientemente estudiado. Por ahora se sabe que las fibras del nervio vago no están en contacto directo con la cavidad de los intestinos, sino que reciben el influjo de los compuestos que liberan las bacterias o bien de la interacción con las células locales productoras de hormonas. Estas células, que pueden secretar infinidad de moléculas activas cuando los intestinos se llenan de hidratos de carbono, proteínas o lípidos, se ubican en puntos de vigilancia clave para hacer saltar las alarmas en caso de un ataque al aparato digestivo, como ocurre, por ejemplo, cuando se sufre una gastroenteritis.
El nervio vago cuenta con receptores que le permiten reconocer un compuesto de la pared de las bacterias y se convierte en una señal cuando la barrera intestinal es objeto de una agresión.
Además, dispone de un sistema antiinflamatorio basado en el neurotransmisor acetilcolina, capaz de regular la permeabilidad intestinal y probablemente también de influir en la composición de la microbiota. El estrés inhibe la actividad del nervio vago, lo que altera la microbiota. Por eso puede acabar dando lugar a brotes de dolencias crónicas inflamatorias de los intestinos, como la enfermedad de Crohn.
En el cerebro, el nervio vago está indirectamente conectado con la corteza prefrontal, la parte de este órgano que se sitúa por encima de nuestros ojos y que es la última en madurar (de hecho, lo hace en torno a los veintiún años). La corteza prefrontal está vinculada a numerosos trastornos psiquiátricos, ya que condiciona nuestra reacción ante el estrés, nuestra manera de percibir el mundo y también la aparición de emociones negativas. El nervio vago está conectado igualmente con el hipotálamo, una zona de control del «eje del estrés» (véase el capítulo siguiente).
La Food and Drug Administration (la agencia nacional estadounidense encargada de la regulación de los alimentos y los medicamentos) ha reconocido el papel fundamental que desempeña el nervio vago en este sentido, ya que ha autorizado su estimulación como tratamiento de la depresión en aquellos pacientes que no responden adecuadamente a los antidepresivos. La técnica en cuestión consiste en el uso de un neuroestimulador para activar las fibras del nervio vago, lo cual podría reducir los efectos del estrés. Este método ya ha dado resultados prometedores en varias patologías inflamatorias crónicas, como la enfermedad de Crohn o la poliartritis reumatoide.
Así pues, cabe pensar que, si se estimula la microbiota con una buena alimentación y, llegado el caso, con probióticos o incluso con un trasplante completo de microbiota, se podría estimular el nervio vago sin necesidad de recurrir a una carcasa externa, como se hace hoy en día en los hospitales1 en el marco de este tratamiento. De ese modo se curarían ciertas depresiones resistentes que no responden a los antidepresivos convencionales.
En resumen
El nervio vago es una vía anatómica por la que circula información. El 80 por ciento de ella se mueve desde los intestinos hasta el cerebro. Aunque aún no se haya esclarecido por completo cuáles son los mecanismos exactos por los que se produce la interacción entre la microbiota y este nervio, es probable que el vago desempeñe una función importante en la comunicación intestinos-cerebro.
LA NEUROSINFONÍA DEL ESTRÉS
Sabemos qué es el estrés y qué efectos produce en nuestro cuerpo: unos efectos a veces beneficiosos, pero también desagradables. Todos hemos sentido alguna vez que las manos se nos humedecen antes de un examen o hemos sufrido palpitaciones antes de alguna prueba de acceso a la universidad. Lo que conocemos peor es el mecanismo por el que se desencadena este fenómeno.
Desde el punto de vista cerebral, el eje del estrés conecta tres glándulas: el hipotálamo, la hipófisis (ambas situadas bajo el cerebro) y las glándulas suprarrenales (que, como su propio nombre indica, se encuentran por encima de los riñones). Cuando este sistema se activa, secreta cortisol, la hormona del estrés. No obstante, las respuestas frente al estrés no se circunscriben de forma exclusiva a este eje, sino que también accionan otros sistemas a los que se conoce con el poético término de la «neurosinfonía del estrés».
El cortisol se combina con la adrenalina y la noradrenalina con el fin de preparar al cuerpo para la defensa o la huida en caso de peligro. Se suele producir en ciclos de veinticuatro horas y alcanza su punto más elevado en la hora que sigue al despertar matutino. Pero además de esta producción básica, el cortisol también se secreta para responder ante estímulos estresantes, ya sean internos o externos, en picos que suelen ser breves.
El eje del estrés se desarrolla desde la gestación y concluye su maduración en los seis primeros meses de vida. En varias pruebas de laboratorio se ha conseguido demostrar que existen importantes variaciones en la respuesta al estrés de cada niño, dependiendo de su edad, de la naturaleza del estímulo y de su nivel de exposición al estrés durante el embarazo y la primera infancia. Hoy en día se da ya por sentado que el maltrato infantil puede alterar el desarrollo de este eje y dar lugar a trastornos psiquiátricos en la edad adulta, relacionados con una activación deficiente del eje en sí o con fallos en la regulación emocional, como el autismo, la depresión y la esquizofrenia.
Aunque tradicionalmente la ciencia se ha centrado sobre todo en el sentido descendente del eje del estrés (es decir, el que va del cerebro a los intestinos), en realidad, la comunicación cerebro-intestinal es bidireccional. Hace ya tiempo que se sabe que la exposición al estrés genera una activación de la corteza prefrontal que, en forma de cascada, libera y difunde cortisol en la sangre a través del par hipotálamo-hipófisis, lo que reduce la movilidad del colon y, en consecuencia, se traduce en un estancamiento y, por tanto, en una alteración de la microbiota.
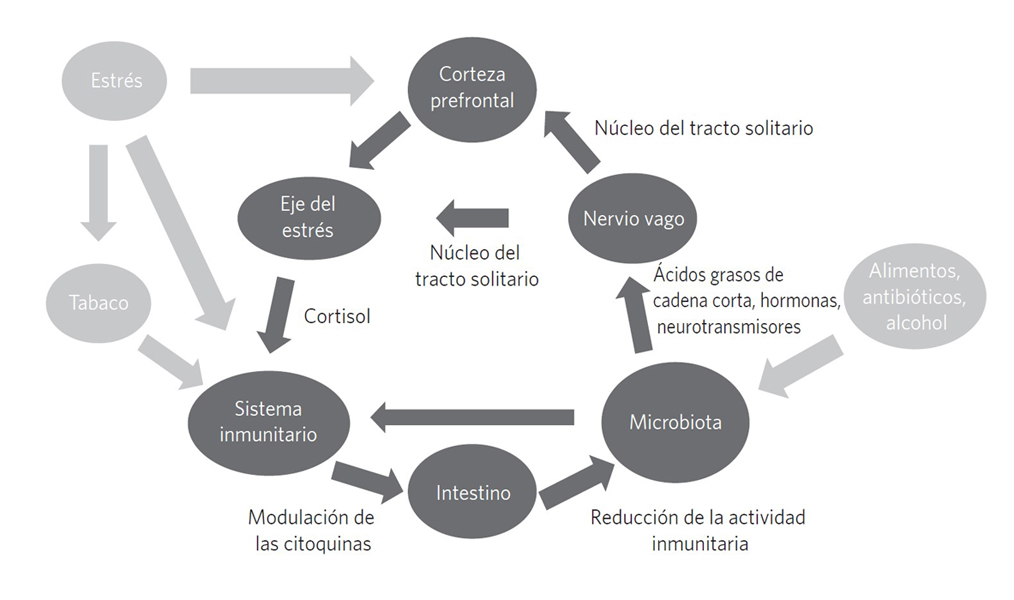
Figura 1. El circuito microbiota-intestinos-cerebro
En resumen
Existe una interacción bilateral entre los intestinos y el cerebro a través del eje del estrés. El cerebro puede provocar una liberación de hormonas del estrés, que aumentarán la permeabilidad intestinal, mientras que la microbiota interactúa con el sistema inmunitario modulando una serie de moléculas que tendrán un impacto sobre el cerebro. Comprender estos mecanismos constituye un reto determinante para la salud mental.
LAS TRES BARRERAS INTESTINALES
Nuestra microbiota desempeña un papel fundamental como «cortafuegos» en nuestra barrera intestinal, es decir, nos protege de los ataques de los agentes agresivos presentes en nuestra alimentación. Esta barrera constituye una entidad dinámica, formada por tres elementos cuya función es filtrar los alimentos para extraer de ellos la energía y los nutrientes que nuestro organismo necesita para funcionar.
Primera barrera: los jugos digestivos
La primera barrera consta de la bilis, los ácidos del estómago y del páncreas —que digieren las bacterias y sus productos— y las bacterias comensales, que secretan sustancias antimicrobianas. Nuestra microbiota puede destruir directamente los patógenos mediante la producción de endotoxinas. Es lo que se conoce como la «resistencia a la colonización».2
E. coli, una bacteria sobradamente conocida
E. coli, que se encuentra muy presente en nuestros intestinos, secreta, entre otras sustancias, una toxina que impide que otra bacteria parecida, aunque patógena (denominada «enterohemorrágica»), los colonice.
La resistencia a la colonización se da en todas nuestras mucosas. Uno de los ejemplos más conocidos es el de los lactobacilos de la mucosa vaginal, que, al reducir la acidez local, evitan que los patógenos proliferen.
Un estafilococo beneficioso
Staphylococcus epidermidis, que es un estafilococo muy abundante en nuestra piel, produce sustancias antimicrobianas que impiden que otro estafilococo, Staphylococcus aureus, forme una biopelícula dañina.
Así pues, una alteración de la primera barrera intestinal puede debilitar la resistencia a la colonización y provocar así una proliferación microbiana en el intestino delgado. Por ejemplo, si disminuye la acidez gástrica o pancreática, se facilita el crecimiento anómalo de bacterias en la zona. Esas bacterias comenzarán el proceso de fermentación, que en realidad debería tener lugar en el colon, y, en consecuencia, generarán hinchazón y, en ocasiones, diarrea o estreñimiento.
Segunda barrera: mucosa y azúcares complejos
La segunda barrera intestinal está formada por una barrera física que se compone de una capa de agua estancada, un conjunto de azúcares fijados a lípidos y una capa de moco. Entre este cortafuegos y la microbiota existe una zona «desmilitarizada» que nos permite convivir armoniosamente con nuestras bacterias. En ella también hay anticuerpos, encargados de impedir que los microorganismos se adhieran a la pared intestinal.
El proceso de aparición de las enfermedades inflamatorias
Esta segunda barrera, que es más gruesa en el colon que en el intestino delgado y presenta un tamaño similar al de las vellosidades intestinales, interactúa constantemente con nuestra microbiota. En condiciones patológicas, se produce un daño en el cortafuegos y en la zona desmilitarizada, lo que conlleva la aparición de enfermedades crónicas de los intestinos.
La microbiota es una verdadera maestra que instruye a nuestro sistema inmunitario acerca de la inmunotolerancia. Sus discípulos son tanto el sistema inmunitario innato (que es el que nos proporciona nuestras defensas básicas) como el adaptativo (que es el que nos protege frente a una infección en particular).
Intestinos y sistema inmunitario
El 70 por ciento de nuestras células inmunitarias se hallan en nuestros intestinos e interactúan con los microbios que se encuentran en ellos. La microbiota es capaz de modular el sistema inmunitario a través de la regulación de las citoquinas, unas pequeñas moléculas relacionadas con la inflamación, que son un producto de nuestro sistema inmunitario y que circulan por la sangre. Se trata de una especie de llaves mágicas que, cuando se introducen en las cerraduras apropiadas (los receptores), desencadenan o inhiben la inflamación.
Pero este papel inmunoestimulante de la microbiota no se da solo en el intestino: de hecho, tiene efectos sobre todo nuestro organismo. En un metaanálisis* publicado en 2015 en la revista Cochrane, que incluía doce ensayos controlados aleatorizados y 3.720 participantes, se concluyó que los probióticos (cápsulas que contienen cepas bacterianas) son más eficaces que el placebo a la hora de reducir las infecciones agudas de las vías aéreas altas (resfriados y bronquitis), la duración media de un episodio infeccioso, la necesidad de antibióticos y el absentismo escolar ligado a las bajas temperaturas.3
Otro metaanálisis ha confirmado la eficacia de los probióticos para el tratamiento de las gastroenteritis de origen vírico, lo que prueba que son capaces de estimular el sistema inmunitario.4También las bifidobacterias o la levadura Saccharomyces boulardii han demostrado su utilidad como protectoras de la barrera intestinal.
Los antiinflamatorios no esteroideos, como el ibuprofeno, pueden provocar patologías en los intestinos, ya que inhiben la secreción de moco. Además, los emulsionantes a base de ácidos grasos, que se encuentran en ciertos aditivos empleados en la industria agroalimentaria, como el E471, el E473 o el E475, pueden alterar la mucosidad, que en tal caso deja de cumplir su función de segunda barrera.5
Tercera barrera: la pared intestinal
La tercera barrera es la propia pared de los intestinos, cuyas células pueden defenderse por sí mismas en caso de agresión bacteriana. Estas células están unidas entre sí a través de diferentes tipos de conexiones, que, si se modifican, darán lugar a un incremento de la permeabilidad intestinal.
Pues bien, se ha observado que el nivel de gravedad de la depresión en adolescentes no tratados4 y en adultos está relacionado con una mayor permeabilidad.6El embarazo, la actividad física que exige un esfuerzo prolongado de resistencia (como una prueba de maratón) y el estrés son otros factores que la incrementan.
Para reparar o fortalecer la barrera intestinal, lo primero que se recomienda es reintroducir los microbios intestinales a través de probióticos, retirar de la dieta los alimentos problemáticos (por ejemplo, el gluten, el azúcar y la leche) y sustituirlos por otros que irriten menos los intestinos (como los alimentos fermentados: el chucrut, el plato coreano kimchi, el yogur, el kéfir o los pepinillos encurtidos). A pesar de estas restricciones, es importante seguir manteniendo una dieta variada. Por último, también se puede recurrir a determinados complementos que ayudan a proteger o reparar la barrera intestinal, como la L-glutamina, el colecalciferol, el zinc y los ácidos grasos omega-3, que veremos en la tercera parte de este libro.
En resumen
Los intestinos nos protegen a través de tres barreras: los jugos digestivos, la mucosa intestinal —cuyo grosor es similar al de las vellosidades de esta región del organismo—
y, por último, la propia pared de los intestinos. Hay diferentes fenómenos que pueden
alterar estas tres barreras, como una dieta inflamatoria, el consumo de antibióticos, la absorción de emulsionantes alimentarios o ciertas patologías crónicas. Es necesario
adaptar la alimentación de cada persona al nivel de vulnerabilidad de sus barreras para prevenir los trastornos.
EL ELIXIR DE LA VIDA QUE PRODUCE LA MICROBIOTA
Ya estarás empezando a comprender la importancia de nuestra microbiota intestinal. Pero, aparte de lo que hemos visto, hay que saber también que estas bacterias secretan un elixir de la vida, denominado «ácidos grasos de cadena corta» (en inglés, short chain fatty acids, SCFA), unos productos de la fermentación de la microbiota a partir de la fibra alimentaria (que se encuentra en la lechuga, las verduras, las frutas y las legumbres). Por eso es tan importante incluir este componente en nuestra dieta.
Uno de esos ácidos, el butirato (del latín butyrum, «mantequilla»), es un combustible fundamental, que proporciona el 70 por ciento de la energía de las células del intestino grueso. De hecho, cuando estas células no tienen acceso al butirato, empiezan a devorarse entre ellas. Por eso, un déficit de butirato provoca una destrucción de la barrera intestinal. El butirato, además, protege frente al cáncer de colon, la cuarta causa de mortalidad por cáncer más frecuente en el mundo. Por otra parte, al igual que otros ácidos grasos de cadena corta, posee propiedades hipocolesterolemiantes, antidiarreicas y antiinflamatorias e interviene en la estimulación y la organización de las células inmunitarias del colon y en la termogénesis a través de las mitocondrias. Podría ser eficaz igualmente para tratar la diabetes tipo 2 y la obesidad, así como para favorecer la acción de la microbiota sobre el nervio vago que ya hemos visto (Capítulo 2).
El butirato
El butirato es un eficaz inhibidor de la histona desacetilasa. En los ratones ha demostrado efectos antidepresivos similares a tratamientos farmacológicos como el Prozac. Mantiene el ADN en una forma relajada que facilita la producción de neurotrofinas, una especie de abono para las neuronas, que las ayuda a sobrevivir y a multiplicarse.
En 2018 se publicó un estudio coreano que demostraba que existe una relación entre la diversidad de la microbiota y los rasgos de la personalidad: después de analizar las variables edad, sexo, índice de masa corporal e ingesta de nutrientes, se constató que las personas que presentaban índices más elevados de neuroticismo (es decir, una predisposición a la ira, la ansiedad y la depresión) disponían de más gammaproteobacterias, mientras que las que tenían menor nivel de conciencia contaban con más proteobacterias.7En cambio, el grupo con un mayor nivel de conciencia se caracterizaba por presentar un nivel más alto de determinadas bacterias productoras de butirato.
Entre los factores de crecimiento, en 1989 se identificó el brain-derived neurotrophic factor (BDNF) o factor neurotrófico derivado del cerebro, uno de los fertilizantes fundamentales para el crecimiento de las neuronas. Actúa sobre el hipocampo, la corteza y la parte basal del cerebro anterior, zonas cruciales para el aprendizaje, la memoria a largo plazo y la cognición. También se encuentra en numerosos tejidos, como los de la retina, los riñones, la próstata o los músculos esqueléticos, así como en las neuronas motoras y la saliva. Además, el BDNF inhibe las citoquinas inflamatorias y aumenta la síntesis de glutatión, un potente antioxidante del cerebro. Se ha observado que los ratones que presentan síntomas de estrés crónico expresan más BDNF que los ratones calificados de resilientes.
La microbiota contiene una serie de enzimas de las que nuestras células están desprovistas. Algunos de los productos de estas enzimas, como los indoles, permiten reducir el estrés oxidativo, una verdadera tempestad de electrones que deteriora nuestras células y acelera el envejecimiento. Estas moléculas también limitan la inflamación intestinal, mejoran las secreciones hormonales y protegen la barrera mucosa de los intestinos. Además, combaten la colonización por parte del hongo Candida albicans.
Una buena manera de fomentar la síntesis de butirato por parte de nuestra microbiota es añadir a nuestros platos almidones resistentes, unas cadenas de azúcares complejos que no podemos digerir porque carecemos de las enzimas necesarias para ello y que, en consecuencia, sirven de alimento para las bacterias de nuestro colon. Se encuentran en las patatas crudas, que se deben consumir únicamente en pequeñas cantidades, y en los plátanos verdes, que se pueden batir para preparar un smoothie o espolvorear como condimento sobre otras recetas (aumentando poco a poco la dosis para evitar la aparición de gases y molestias digestivas, y sin superar nunca los 60 miligramos diarios). También podemos obtener almidones resistentes cociendo las patatas y el arroz y, a continuación, enfriándolos. Para empezar a notar sus beneficios, hay que esperar entre dos y cuatro semanas... No hay más remedio que armarse de paciencia.
MICROBIOTA Y CEREBRO
Nuestra microbiota también podría desempeñar un papel importante en la protección de nuestro cerebro, contribuyendo a la integridad de su recubrimiento. A menudo se etiqueta a este órgano como un «santuario inmune» porque por él patrulla tan solo una cantidad muy limitada de células inmunitarias. Esta situación de «privilegio inmune» es posible gracias a la presencia de una barrera vascular especializada que limita el paso de las grandes moléculas y células de la sangre al cerebro.
La barrera hematoencefálica
La barrera hematoencefálica está formada por células endoteliales, que construyen una red de estrechas uniones entre las células.
Recientemente se ha descubierto que la microbiota intestinal actúa como reguladora de la integridad de esta barrera del cerebro en los fetos de ratones y también en los ratones adultos. De hecho, los ejemplares adultos que carecen de una microbiota intestinal normal presentan un recubrimiento del cerebro más permeable y una desorganización de dos tipos de uniones: las uniones estrechas y las claudinas.5
Sin embargo, es posible revertir esta permeabilidad inoculándoles la microbiota de otros ratones libres de agentes patógenos y también favoreciendo una monocolonización por parte de alguna bacteria que sintetice ácidos grasos de cadena corta (como el butirato, el acetato o el propionato). En cualquier caso, aún no se conocen bien los mecanismos por los que estos ácidos grasos mejoran la barrera del cerebro.
Lo cierto es que una parte de las personas que padecen trastornos mentales presentan una barrera hematoencefálica más permeable, por lo que la microbiota podría abrir las puertas a una terapia inédita que permita proteger mejor sus cerebros.
En resumen
La microbiota sintetiza ácidos grasos de cadena corta, metabolizados por el cerebro, que podrían desempeñar un papel crucial en el neurodesarrollo. Estos ácidos grasos, además, sirven de alimento para la pared del colon. Es posible que intervengan en las patologías intestinales que acaban dando lugar a dolencias crónicas inflamatorias y a ciertas enfermedades mentales.
LA MICROBIOTA: ESE CAMELLO QUE NOS PROPORCIONA SEROTONINA Y ENDOCANNABINOIDES
La fórmula del elixir de la vida que produce la microbiota no solo incluye ácidos grasos de cadena corta. También sintetiza una cantidad de hormonas y neurotransmisores tan elevada que existe toda una disciplina (la endocrinología microbiana) que se ocupa de estudiarlos.
Las pruebas del impacto de estas secreciones sobre su huésped se acumulan: los modelos animales han demostrado que la microbiota intestinal proporciona al cerebro serotonina, pero también dopamina, GABA, acetilcolina, noradrenalina y endocannabinoides; en definitiva, todos los neurotransmisores que permiten a nuestras neuronas comunicarse entre sí. Sin embargo, hasta ahora no se ha probado que ocurra lo mismo en los seres humanos. En cualquier caso, estos neurotransmisores controlan las emociones, las capacidades cognitivas y la movilidad intestinal, entre otros elementos.
Serotonina, dopamina, lactobacilos y ansiedad
La serotonina es una hormona cuyos niveles se reducen en buena parte de las depresiones, los trastornos de ansiedad y los problemas del sueño. Participa en la termorregulación, en la regulación de la agresividad, el dolor y los comportamientos alimentarios y sexuales y en el control de los movimientos. La serotonina de la madre tiene un gran peso en el desarrollo del embrión. Además, el 50 por ciento de los casos de muerte súbita del lactante se explican por un desequilibrio de esta hormona.
En el colon (al que no llega el nervio vago), las bacterias comensales producen metabolitos, que envían señales a las células enterocromafines del intestino grueso, que a su vez producen la serotonina que estimula el sistema nervioso intestinal. La dopamina, que constituye uno de los principales neurotransmisores implicados en los comportamientos guiados por la recompensa, es un precursor de la noradrenalina y de la adrenalina. Tradicionalmente, la noradrenalina se ha conocido por su papel en el despertar, la vigilia, el comportamiento, la memoria, el aprendizaje y la atención.
Existen varias especies de nuestra microbiota que producen dopamina y noradrenalina. De hecho, las bacterias del tubo digestivo no solo son capaces de fabricar neurotransmisores, sino también de responder a ellos. Un incremento de la dopamina o de la noradrenalina en esta región del organismo puede favorecer el crecimiento de agentes patógenos, facilitar la formación de biopelículas y aumentar su virulencia. Parece que la noradrenalina se utiliza como una molécula de señal entre las bacterias.
Los lactobacilos o E. coli de nuestra microbiota pueden sintetizar a partir del glutamato el ácido gamma-aminobutírico (GABA), un aminoácido de cuatro carbonos que se ha mantenido a lo largo de toda la evolución, desde las bacterias hasta los vertebrados. Se lo considera el mensajero de la comunicación «entre reinos», es decir, entre las plantas, los hongos, las bacterias y los animales. Se encuentra presente en al menos el 30 por ciento de las sinapsis de nuestro cerebro y en todo el organismo de los insectos. Además, favorece el crecimiento de determinadas neuronas. Las plantas lo sintetizan en caso de estrés celular y es el inhibidor más potente de todos los que producen el cerebro humano, el cerebro del resto de los mamíferos y el de los pájaros. Sin embargo, el GABA no atraviesa la barrera que rodea el cerebro, así que no se puede obtener directamente de la alimentación o de la microbiota. Unos niveles anormalmente bajos de GABA constituyen un signo de ansiedad o depresión.
En 2011 se publicó un estudio que levantó un verdadero revuelo: en él se demostraba que el probiótico Lactobacillus rhamnosus podía modular el GABA en el cerebro de las ratas.8Esta misma cepa, tomada sola o junto con otros productos, probó su eficacia en varios ensayos controlados aleatorizados con pacientes que sufrían depresión.9A partir de las conclusiones de estos trabajos se podrían desarrollar nuevos tratamientos para la ansiedad y la depresión. Por otra parte, en 2016 se identificó por vez primera la bacteria intestinal KLE1738, que se alimenta exclusivamente del GABA que secreta nuestro cerebro.
En 2020, otro estudio llamó poderosamente la atención porque señalaba que una alteración de la microbiota provoca una alteración del metabolismo de los ácidos grasos poliinsaturados (los omega-3) y que, si se administra en ratones una determinada cepa de lactobacilos, es posible incrementar la cantidad de cannabinoides endógenos, lo que sirve para contrarrestar los efectos de un estrés crónico leve.10
La microbiota también puede influir en los niveles de otros neurotransmisores, principalmente la histamina, los gasotransmisores, los neuropéptidos y los esteroides. En los últimos veinte años se han multiplicado los hallazgos sobre las múltiples propiedades de la microbiota, que siguen sorprendiéndonos.
En resumen
La microbiota es capaz de sintetizar las moléculas del cerebro que resultan alteradas en los casos de enfermedad mental. Hoy en día aún no se ha demostrado que esas moléculas sintetizadas se puedan integrar directamente en el cerebro humano, pero sí se ha conseguido probarlo en otras especies animales.
En las siguientes páginas veremos qué es lo que ocurre en nuestros intestinos cuando sufrimos una depresión.