El sistema inmunitario es el sistema de defensa del organismo. Combate los ataques o agresiones, ya sean de microorganismos como bacterias o virus, o de la conversión de nuestras células sanas en células cancerosas. También interviene en caso de agresión física o química para desencadenar el proceso de curación.
Es un arma de defensa especialmente eficaz, tan poderosa que a veces puede descontrolarse y provocar una reacción excesiva, como ocurre con las alergias o las enfermedades autoinmunes.
Un sistema inmunitario eficaz y seguro debe ser capaz de:
• Reconocer cuándo nuestro cuerpo está siendo atacado, para poder actuar tan pronto como sea necesario (pero solo si es necesario).
• Contener y eliminar eficazmente al agresor, esté donde esté y sea cual sea su naturaleza: virus, bacteria, hongo, parásito, célula cancerosa, etc.
• Controlar su reacción para evitar que se descontrole y provoque enfermedades inflamatorias.
• Contar con una memoria de ataques para poder responder con mayor rapidez y contundencia en caso de nuevas agresiones similares.
Para alcanzar estos objetivos, el sistema inmunitario coordina una serie de células inmunitarias con funciones complementarias: células centinela (como las células dendríticas), que, como su nombre indica, detectan a los agresores; células efectoras, que actúan (como los neutrófilos o los linfocitos citotóxicos CD8), y células coordinadoras (como los linfocitos auxiliares CD4+).
Los glóbulos blancos (o leucocitos) se producen en la médula ósea y luego migran a los tejidos, la sangre y la linfa para poblar los órganos.
Después de los glóbulos rojos (eritrocitos) y las plaquetas, son los elementos celulares sanguíneos más pequeños. Todas las células del sistema inmunitario se producen en la médula ósea a partir de células madre denominadas hematopoyéticas, porque intervienen en la formación de las células sanguíneas, y pluripotentes, lo que significa que el organismo es capaz de utilizar estas células madre para producir todas las demás células que componen la sangre: glóbulos blancos, glóbulos rojos y plaquetas. Este proceso se denomina hematopoyesis.
Desde un punto de vista morfológico, existen tres tipos de glóbulos blancos: granulocitos (células polimorfonucleares), linfocitos y monocitos/macrófagos.
Tienen un aspecto granular y núcleos polilobulados. Las células polinucleares incluyen a los neutrófilos, eosinófilos y basófilos.
Representan el 60-70 % de los glóbulos blancos que circulan en la sangre y son, por tanto, los más abundantes de todos los glóbulos blancos. Desempeñan un papel fundamental en la defensa contra bacterias y hongos.
Los neutrófilos atacan a los patógenos de varias formas: por fagocitosis (ingestión de los agresores), degranulación (liberación de gránulos antimicrobianos) y formación de trampas extracelulares (una especie de telaraña que atrapa a los agresores).
Los neutrófilos son la primera línea de defensa contra las bacterias. Circulan durante unas horas por la sangre antes de entrar en los tejidos, donde ingieren y matan a los agresores. Mueren una vez que han ingerido unos pocos agresores, lo que explica por qué se encuentran en gran número en el pus de las heridas.
En caso de neutropenia (disminución del número de neutrófilos), el organismo puede ser fácilmente víctima de infecciones bacterianas.
Representan el 2-3 % de los glóbulos blancos que circulan en la sangre.
Los eosinófilos desempeñan un papel importante contra los parásitos; también son células implicadas en las alergias e inflamaciones. Cuando se activan, liberan sustancias tóxicas e inflamatorias a través de sus gránulos directamente fuera de la célula, lo que permite atacar a los parásitos, que son organismos demasiado grandes para ser ingeridos.
Demasiados eosinófilos en sangre (hipereosinofilia) suele ser signo de una infección parasitaria o una enfermedad alérgica.
Representan entre el 0,5 y el 1 % de los glóbulos blancos que circulan en la sangre.
Son las células inmunitarias que más a menudo causan inflamaciones y alergias. Cuando se activan, sus gránulos liberan histamina, responsable de la dilatación de los vasos sanguíneos. Afortunadamente, suelen ser los menos comunes de los glóbulos blancos (0,5 %).
Representan el 30 % de los glóbulos blancos que circulan en la sangre.
Hay tres tipos: linfocitos B, linfocitos T citotóxicos y linfocitos T auxiliares.
Los linfocitos B desempeñan un papel en la inmunidad humoral (eliminación de los agresores mediante la producción de anticuerpos) y los linfocitos T desempeñan un papel en la inmunidad celular (destrucción directa de las células infectadas o cancerosas por las células T).
Los linfocitos B se denominan así1 porque maduran en la médula ósea (bone marrow), mientras que los linfocitos T maduran en el timo.
La función de los linfocitos B es fabricar proteínas, los anticuerpos, que se secretan en el plasma sanguíneo y linfático y circulan por todo el organismo.
Entre los linfocitos T, hay linfocitos T citotóxicos (linfocitos T CD8), cuya función es destruir directamente las células infectadas por un virus o por células cancerosas.
Los linfocitos T cooperadores (T-CD4, T-helper) coordinan la respuesta inmunitaria, en particular mediante la producción de citocinas. Dependiendo de su activación, pueden tener diferentes perfiles de citocinas, en función de si ayudan a dirigir la respuesta inmunitaria celular (Th1), humoral (Th2), inflamatoria (Th17) o inmunosupresora (T-reguladora).
Los linfocitos NK (natural killers, «asesinos naturales») son células citotóxicas que forman parte del sistema inmunitario innato. Proporcionan una protección precoz contra los agresores intracelulares y las células tumorales. No tienen un receptor de antígeno específico, pero contienen gránulos que pueden destruir células y segregar citocinas para atraer a otros agentes inmunitarios.
Su papel puede ser suficiente para controlar al agresor, pero, en caso contrario, pueden limitar la infección hasta que lleguen los linfocitos citotóxicos específicos.
Representan entre el 3 y el 8 % de los glóbulos blancos que circulan en la sangre.
Son los glóbulos blancos de mayor tamaño. Al igual que los neutrófilos, son células fagocíticas que pueden ingerir agresores.
Sin embargo, tienen una vida útil más larga y desempeñan un papel importante en la presentación de fragmentos de los agresores a los linfocitos T con el fin de educarlos y activarlos.
Al pasar a los tejidos, se convierten en macrófagos o células dendríticas.
Células inmunitarias presentes en los tejidos
Algunas células inmunitarias solo se encuentran en los tejidos y, por tanto, no se detectan cuando se extrae sangre: se trata principalmente de macrófagos, células dendríticas y mastocitos.
Los macrófagos desempeñan una función de vigilancia inmunitaria en los tejidos. Además de ingerir a los agresores y defender el organismo contra las infecciones, contribuyen a eliminar los desechos celulares y a reparar o mantener los tejidos.
Las células dendríticas son las células presentadoras de antígenos por excelencia.
Se denominan dendríticas porque forman dendritas (una especie de «dedos») cuando se activan para favorecer el contacto con otras células.
Al igual que los agentes que se infiltran en los tejidos, captan señales inflamatorias y antígenos, y los llevan de vuelta a los ganglios linfáticos para presentarlos a los linfocitos inexpertos.
Los mastocitos son células centinelas de los tejidos cuya función es equivalente a la de los basófilos en la sangre. Desempeñan un papel importante en las alergias y las inflamaciones al liberar gránulos que contienen sustancias inflamatorias y citotóxicas. También intervienen en las infecciones parasitarias. Los eosinófilos, los basófilos y los mastocitos participan en la protección de las mucosas.
Se distingue entre eosinófilos y basófilos, que son células que circulan por el torrente sanguíneo y pueden migrar a los tejidos, y mastocitos, que son células centinela presentes en los tejidos.
Es muy importante que el sistema inmunitario sea capaz de reconocer a su agresor, ya que esto le permite reaccionar con una respuesta adecuada. Para ello, utiliza dos niveles de reconocimiento: el reconocimiento de las señales de peligro y el reconocimiento específico.
Sin embargo, no todas las células inmunitarias tienen la capacidad de reconocer a un agresor.
Esta capacidad pasa, en primer lugar, por que se detecten señales de peligro —que informan al sistema inmunitario de una situación anormal— y, en segundo lugar, por focalizar la acción hacia la zona del cuerpo expuesta a ese peligro.
Este reconocimiento de las señales de peligro se realiza mediante receptores presentes en las células del sistema inmunitario innato (neutrófilos, macrófagos, células dendríticas). Estas células son capaces de reconocer dos tipos principales de anomalías:
1. Patrones moleculares asociados a patógenos (PAMP, pathogen-associated molecular patterns).
2. Patrones moleculares asociados a daños (DAMP, damage-associated molecular patterns).
Los patrones moleculares asociados a patógenos (PAMP) se vinculan con moléculas que se conservan y repiten en la superficie de los agresores. Pueden ser componentes de la pared bacteriana, como lipoproteínas o lipopolisacáridos (LPS), o componentes víricos, como glicoproteínas víricas o cadenas víricas de ADN. Los receptores PAMP están representados por diferentes familias, en particular los receptores tipo Toll (TLR, toll-like).
Los patrones moleculares asociados al daño celular (DAMP) están vinculados a componentes celulares que se liberan de forma anormal en el entorno celular durante una agresión. Entre ellos se encuentran el ADN (que normalmente está contenido en el núcleo celular) o proteínas producidas por las células sometidas a estrés, como las proteínas de choque térmico (HSP, heat shock proteins).
Una vez activados, estos receptores inducen la producción de sustancias inflamatorias que señalan el ataque y activan y refuerzan la respuesta inmunitaria: la respuesta inflamatoria.
Nuestro organismo requiere un segundo nivel de reconocimiento más preciso para actuar de forma muy específica ante el agresor. Esto se conoce como reconocimiento específico y también implica la detección de lo que forma parte del organismo (lo «propio») frente a lo que no (lo «ajeno»). Es el sistema inmunitario adaptativo (linfocitos T y B) el que entra en juego en este tipo de reconocimiento detallado.
Este reconocimiento específico se consigue mediante receptores que se encuentran en la superficie de los linfocitos:
• TCR: receptores de linfocitos T;
• anticuerpos o BCR: receptores de linfocitos B.
El BCR (B-cell receptor) es el receptor de las células B que reconoce específicamente un antígeno. Cuando el BCR activa su linfocito B, empieza a producir un gran número de anticuerpos que son idénticos a este BCR, pero sin su transmembrana. Estos anticuerpos ya no están «unidos» a la membrana y, por lo tanto, se liberan en el torrente sanguíneo para reconocer su antígeno (por ejemplo, uno de tipo viral).
Los anticuerpos también se conocen como inmunoglobulinas o Ig. De hecho, las inmunoglobulinas son una gran familia de proteínas (denominada superfamilia de inmunoglobulinas) que incluye los anticuerpos, aunque no exclusivamente. Sin embargo, se ha mantenido el término inmunoglobulina para la nomenclatura de los tipos de anticuerpos: IgG, IgM, etc.
¿Qué es un antígeno?
Un antígeno es una sustancia que puede reconocer el sistema inmunitario adaptativo (por anticuerpos/BCR de los linfocitos B o por los TCR de los linfocitos T).
Estas sustancias suelen ser proteínas, pero también pueden ser azúcares (poliósidos, glucoproteínas), ácidos grasos (lípidos, lipoproteínas) y, a veces, ácidos nucleicos (ADN).
Un antígeno puede proceder de nuestro propio cuerpo, en cuyo caso se denomina antígeno propio, de otro organismo o del medio ambiente, en cuyo caso se denomina antígeno no propio.
Inmunogenicidad del antígeno
Aunque sea reconocido por el sistema inmunitario, un antígeno puede no provocar una respuesta inmunitaria (lo que se conoce como inmunogenicidad). Por tanto, un antígeno puede ser inmunogénico o no inmunogénico.
Así pues, normalmente se supone que los antígenos propios no son inmunógenos, pues en caso contrario se produciría una enfermedad autoinmune.
Epítopo
La parte del antígeno que reconoce específicamente el TCR o el anticuerpo/BCR se denomina epítopo. Un antígeno puede ser reconocido en diferentes lugares y, por lo tanto, puede tener varios epítopos.
Anticuerpos y TCR,
los receptores de antígenos
TCR y anticuerpos/BCR: características comunes de los receptores de antígenos linfocitarios
Estas proteínas se componen de partes variables (V) y constantes (C). La parte variable es la que reconoce el antígeno y, por tanto, es específica. La parte constante es la que interactúa con la célula inmunitaria y, por tanto, confiere al receptor su función.
Estructura del TCR
Un TCR está formado por un heterodímero, es decir, un conjunto de dos proteínas: la cadena alfa y la cadena beta. Cada una de estas dos cadenas tiene una parte constante (C alfa y C beta) unida a la membrana y una parte variable (V alfa y V beta). La combinación de las dos partes variables constituye el sitio de reconocimiento del TCR.
Estructura del anticuerpo
Un anticuerpo está formado por cuatro cadenas proteicas en forma de Y: dos cadenas pesadas (H, heavy) y dos cadenas ligeras (L, light). Cada cadena tiene un dominio constante (C) y un dominio variable (V). En un anticuerpo determinado, las dos cadenas ligeras son idénticas, al igual que las dos cadenas pesadas. Es la combinación de la parte variable de una cadena pesada y la cadena ligera adyacente lo que constituye el sitio de reconocimiento del antígeno. De este modo, un anticuerpo tiene dos sitios de reconocimiento idénticos (monovalentes) al final de cada brazo de la Y.
Un anticuerpo puede dividirse en dos partes principales, denominadas «fragmentos»:
• El fragmento variable (fragmento Fv). Es la parte que reconoce el antígeno y confiere al anticuerpo su especificidad. También se denomina «paratopo» porque es la parte que reconoce el epítopo.
• El fragmento constante (fragmento Fc). Es la parte que interactúa con el sistema inmunitario y define la función del anticuerpo.
TCR/BCR reconocen un antígeno, pero no de la misma manera:
• El TCR y el anticuerpo/BCR no utilizan la misma forma de reconocimiento.
• El BCR y los anticuerpos reconocen directamente los antígenos en su forma nativa, es decir, en su arquitectura natural (conformación tridimensional). El TCR, en cambio, reconoce los antígenos de manera transformada, es decir, cortado en trozos (llamados péptidos) y cebados en una proteína del CMH (HLA).
El complejo mayor de histocompatibilidad (CMH o HLA, por sus siglas en inglés, human leukocyte antigen) es el sistema de autorreconocimiento. En cierto modo, es el carné de identidad de nuestras células. Permite a cada célula demostrar al sistema inmunitario que efectivamente procede del organismo. Las moléculas del CMH se asocian sistemáticamente a proteínas internalizadas o producidas por la célula, lo que permite mostrar su funcionamiento. De este modo, el linfocito T con el TCR comprueba sistemáticamente que la célula pertenece al organismo y que funciona correctamente.
En caso de infección vírica, por ejemplo, la célula empezará a producir proteínas víricas, que se presentarán en la superficie celular en moléculas del CMH. Por tanto, el linfocito T reconocerá la presencia de una infección vírica.
En caso de trasplante de un órgano, los linfocitos y su TCR no reconocerán el CMH del donante y, por tanto, atacarán a la célula, con el consiguiente riesgo de rechazo. Por eso se buscan donantes compatibles, es decir, con un CMH similar, y los pacientes trasplantados también reciben tratamientos con inmunosupresores.
El CMH se basa en un complejo conjunto de genes: el sistema de genes HLA. Para cada uno de los genes HLA existen varias versiones, denominadas alelos: es lo que se conoce como polimorfismo genético. Como todos los genes, cada persona hereda dos alelos (versiones del gen) para cada gen y cada versión se expresa de forma codominante, es decir, se expresa la versión heredada del padre y también la versión heredada de la madre. Como hay varios genes implicados en el sistema HLA, el polimorfismo de cada gen permite aumentar exponencialmente las combinaciones posibles para formar el HLA único de cada individuo, conocido como haplotipo HLA. Así, cada célula de un mismo individuo expresa en su superficie una combinación única de las distintas versiones heredadas de cada uno de los genes HLA.
Se trata de una proteína presente en la superficie de las células que tiene una parte capaz de fijar un péptido, denominada bolsillo peptídico. Aquí es donde el TCR reconoce el complejo péptido + CMH.
Nota: El TCR del linfocito T solo reconoce su diana específica si se trata efectivamente del CMH del mismo organismo y si es el péptido del que es específico. En ausencia de uno u otro, el reconocimiento no se produce y el linfocito no se activa.
Cada individuo tiene su propio CMH, que le permite ser identificado por su propio sistema inmunitario. Sin embargo, en función de su CMH, los péptidos se presentan de forma más o menos eficaz al sistema inmunitario T. Así pues, algunas personas tienen un CMH que es más capaz de presentar determinados péptidos y, por tanto, de activar mejor el sistema inmunitario contra ellos. Esto es especialmente beneficioso en el caso de péptidos virales o tumorales. Por ejemplo, en el caso del VIH, los pacientes portadores del HLA-B57 tienden a controlar más la infección vírica. En cambio, si el CMH presenta mejor determinados péptidos propios, existe un mayor riesgo de enfermedad autoinmune.
Las personas portadoras del HLA-B27 tienen mayor riesgo de desarrollar espondilitis anquilosante, una enfermedad inflamatoria de las articulaciones y la columna vertebral.
Las moléculas CMH de clase I están presentes en la superficie de todas las células nucleadas de nuestro cuerpo. Se trata, por tanto, de una especie de pasaporte que cada célula tiene y debe presentar al sistema inmunitario para demostrarle que pertenece al mismo organismo (con el CMH) y lo que produce (con el péptido).
Las moléculas CMH de clase I contienen fragmentos de todas las proteínas implicadas en el funcionamiento de la célula, que son degradadas por la maquinaria celular (proteasoma) una vez que han cumplido su misión.
Estas proteínas se descomponen en pequeños fragmentos denominados péptidos. Estos péptidos, que ilustran la identidad de la célula, se unen a una molécula CMH de clase I en el interior de la célula y este complejo CMH I + péptido se une a continuación a la superficie de la célula. De este modo, gracias al CMH, cada célula mostrará en su superficie un mosaico de todo lo que produce para informar al sistema inmunitario de su funcionamiento.
Solo los linfocitos T citotóxicos (CD8) utilizan su TCR para reconocer el complejo CMH de clase I + péptido.
Es fácil entender por qué: en caso de infección por virus o de aparición de anomalías cancerosas, la célula empezará a mostrar proteínas anormales (proteínas víricas o proteínas tumorales) que reconocerán los linfocitos T citotóxicos y, por tanto, serán destruidas.
El CMH de clase II es un CMH reservado a las células presentadoras de antígenos profesionales, como las células dendríticas o los macrófagos, así como a los linfocitos B activados. Solo permite la presentación de péptidos derivados de patógenos internalizados (fagocitados).
Las células capaces de reconocer el complejo CMH de clase II + péptido son los linfocitos T auxiliares (CD4+). Este sistema es el que presenta y activa el sistema inmunitario contra patógenos extracelulares como bacterias, parásitos y toxinas bacterianas. El linfocito T auxiliar (CD4) puede ayudar a activar los macrófagos para destruir los patógenos fagocitados o activar los linfocitos B para producir anticuerpos que neutralicen el patógeno extracelular.
Explicación de la figura:
Los antígenos endógenos se generan dentro de una célula normal: autoantígenos, pero también antígenos víricos o tumorales. La célula los presenta en su superficie a nivel de las moléculas de clase I del CMH. A continuación, pueden ser reconocidos específicamente por los linfocitos T CD8+ citotóxicos, que destruirán la célula si se activa.
Los antígenos exógenos proceden del exterior y entran en el organismo por inhalación, ingestión o inyección. Los captan las células fagocíticas presentadoras de antígenos y presentan fragmentos a los linfocitos T auxiliares (CD4+) gracias al CMH de clase II. Esto permite la activación de los linfocitos T citotóxicos, linfocitos B secretores de anticuerpos o macrófagos.
Los grupos sanguíneos
Los hematíes carecen de núcleo y, por tanto, de moléculas HLA. De hecho, el grupo sanguíneo corresponde a la presencia de azúcares en la superficie del glóbulo rojo: N-acetil-galactosamina (denominada antígeno A) o galactosa (antígeno B). La ausencia de estos azúcares en la superficie se indica con una letra O (de Ohne, «sin» en alemán).
Así, una persona del grupo A tiene el antígeno A en la superficie de sus glóbulos rojos, una persona del grupo B tiene el antígeno B en la superficie de sus glóbulos rojos y una persona del grupo AB tiene tanto el antígeno A como el B en la superficie de sus glóbulos rojos.
Por último, una persona del grupo O no tiene ni el antígeno A ni el B.
Dependiendo del grupo sanguíneo, se desarrollan de forma natural anticuerpos contra antígenos que no se poseen. Por ejemplo, una persona del grupo A desarrollará anticuerpos contra el antígeno B; del mismo modo, una persona del grupo B desarrollará anticuerpos contra el antígeno A.
Por lo tanto, una persona con sangre del tipo O desarrollará anticuerpos contra los antígenos A y B. Sin embargo, como sus glóbulos rojos no contienen antígenos A ni B, una persona del grupo sanguíneo O podrá donar sus glóbulos rojos a otra persona independientemente de su grupo sanguíneo, ya que el sistema inmunitario del receptor no tendrá antígenos A ni B a los que atacar. Por eso se dice que las personas con sangre del tipo O son donantes universales.
Una persona del grupo AB no desarrollará anticuerpos contra los antígenos A o B. Por eso se dice que las personas con el grupo AB son receptores universales. Tanto si reciben sangre del grupo A, B u O, no tendrán una reacción inmunitaria dirigida contra los antígenos A o B.
Los donantes O pueden donar a receptores O, A, B y AB; los donantes A pueden donar a receptores A y AB; los donantes B pueden donar a receptores B y AB; pero los donantes AB solo pueden donar a receptores AB.
¿Y el Rh?
El factor Rhesus (Rh) se añade al sistema anterior (ABO) y refleja la presencia (+) o ausencia (-) del antígeno D en la superficie del glóbulo rojo. Al igual que ocurre con el sistema ABO, una persona Rh- desarrollará anticuerpos contra el antígeno D, mientras que una persona Rh+ no los desarrollará. Por lo tanto, podemos decir que, en última instancia, los verdaderos donantes universales son del grupo O- y los verdaderos receptores universales son del grupo AB+.
Para poder reconocer todos los antígenos naturales, los linfocitos deben ser capaces de generar un gran número de receptores antigénicos diferentes. Cada individuo posee más de diez mil millones de receptores de antígenos distintos. Esta extrema diversidad del repertorio de receptores de antígenos está ligada a la variabilidad de los genes que codifican las partes variables (V) de los anticuerpos/BCR o TCR.
No todas las variantes de estos receptores pueden codificarse en el genoma, ya que para ello se necesitarían más genes para codificar los receptores de los que ya posee el genoma humano. De hecho, lo que permite generar esta gran diversidad proteínica está vinculado a un mecanismo de reordenación de segmentos génicos.
Aunque los genes que codifican los TCR y los anticuerpos/BCR no son los mismos, los linfocitos utilizan un mecanismo de reordenación idéntico para generar su diversidad conocido como recombinación V(D)J.
Del sistema inmunitario no es responsable un órgano concreto, ya que las células inmunitarias pueden encontrarse en cualquier parte del cuerpo. Sin embargo, su funcionamiento depende del sistema linfático, que concentra una gran proporción de células inmunitarias.
El sistema linfático es la red de vasos linfáticos (que contienen linfa) y órganos linfoides.
La linfa es un líquido blanquecino que se encuentra entre las células del cuerpo (conocido como líquido intersticial) y que se forma cuando el plasma y los glóbulos blancos atraviesan los vasos capilares. Gracias a las células dendríticas, la linfa drena hacia los ganglios linfáticos el líquido intersticial, que contiene los productos de desecho de las células, en particular los antígenos presentes en los tejidos.
A diferencia de los vasos sanguíneos, que cuentan con la ayuda del corazón, los vasos linfáticos no tienen ninguna bomba que haga avanzar la linfa. Son los movimientos de las extremidades, en particular mediante la contracción de los músculos adyacentes, los que permiten que la linfa se desplace por los vasos linfáticos. Un sistema de válvulas impide que la linfa retroceda. Si los vasos linfáticos funcionan mal y la linfa se estanca, puede producirse un edema.
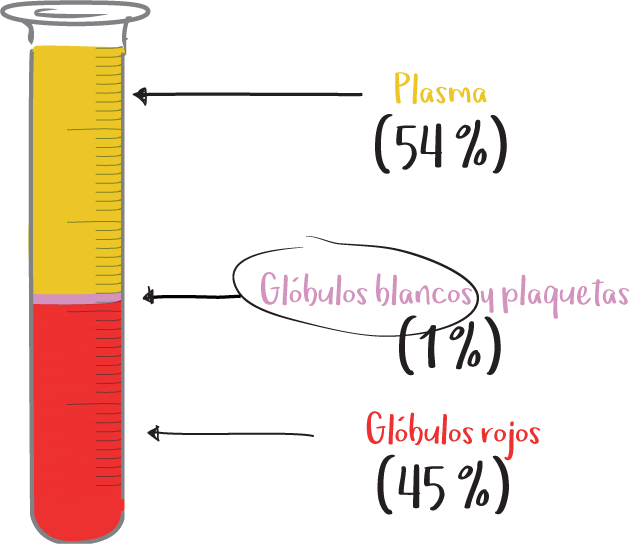
Por su parte, el plasma es el componente líquido de la sangre en el que están las células sanguíneas (glóbulos rojos, glóbulos blancos, plaquetas, etc.).
Los órganos linfoides concentran las células inmunitarias: son principalmente los ganglios linfáticos, la médula ósea, el timo, el bazo, las amígdalas y los tejidos linfoides asociados a las mucosas.
Los órganos linfoides se dividen en dos tipos: órganos linfoides primarios y órganos linfoides secundarios.
Incluyen la médula ósea y el timo.
En estos órganos se producen y maduran las células inmunitarias.
Todas las células inmunitarias se producen en la médula ósea y en ella maduran, excepto los linfocitos T, cuya maduración final tiene lugar en el timo.
El timo es un órgano situado en la parte anterosuperior del mediastino (región de la cavidad torácica situada entre los pulmones y que contiene el corazón, el esófago, la tráquea y los dos bronquios). Su actividad, que corresponde a la maduración final de los linfocitos T (adquisición del receptor TCR), alcanza su máximo durante la pubertad. Normalmente, en la edad adulta, este órgano tiende a contraerse.
La médula ósea es el tejido que se encuentra en el centro de los huesos. La médula roja es responsable de la producción de las distintas células sanguíneas (glóbulos blancos, glóbulos rojos, plaquetas) a partir de células madre (denominadas células madre hematopoyéticas) en un proceso denominado hematopoyesis. En la edad adulta, la mayor parte de la actividad hematopoyética tiene lugar en los huesos ricos en médula roja, como el esternón, los huesos de la pelvis (alas ilíacas), las vértebras, las costillas y los huesos planos del cráneo.
Están formados por los ganglios linfáticos, el bazo, las amígdalas y los tejidos linfoides asociados a las mucosas. Corresponden a los centros de activación y diferenciación de la respuesta inmunitaria. Es en los órganos linfoides secundarios donde las células dendríticas presentan los antígenos a los linfocitos para activarlos. Por tanto, en estos se pone en marcha la respuesta inmunitaria adaptativa.
Son los centros nerviosos donde se organiza la respuesta inmunitaria. En ellos los linfocitos se activan y proliferan antes de desplazarse a donde deben actuar. Todos los tejidos tienen un ganglio linfático cercano, que drena los antígenos de los tejidos a través de los vasos linfáticos.
Normalmente, un ganglio linfático mide menos de un centímetro. En caso de activación o si es invadido por un agente infeccioso o células tumorales, empieza a crecer (pasa a medir más de 1 cm) en un proceso que se denomina adenopatía.
Los linfocitos B y T inexpertos circulan constantemente por los distintos ganglios linfáticos del organismo hasta que encuentran a su antígeno específico.
Áreas de localización de los principales ganglios linfáticos
• yugulo-carótida (cuello)
• submandibular (debajo de la mandíbula)
• torácica
• mesentérica (en el peritoneo, la membrana que protege los órganos del abdomen)
• epitroclear (extremo inferior del húmero, en la cara medial del brazo)
• fosa poplítea (parte posterior de la rodilla)
Este órgano, de unos doce centímetros de longitud, está formado por dos tipos de tejido: la pulpa roja y la pulpa blanca. Desempeña dos funciones principales.
La pulpa roja contiene numerosos vasos (sinusoides venosos) y produce glóbulos rojos durante la vida embrionaria y antes del noveno mes de vida. Pero, sobre todo, actúa como reservorio y filtro de la sangre, en particular de los glóbulos rojos, durante la vida de la persona.
La pulpa blanca es la zona donde se concentran los glóbulos blancos. Organizada de forma similar a un ganglio linfático, desempeña un papel clave en la producción de anticuerpos contra bacterias encapsuladas, como el neumococo y el meningococo.
Parcialmente visibles en la parte posterior de la boca, son los órganos linfoides de la faringe. Están situadas estratégicamente a la entrada de los tractos digestivo y respiratorio. Permiten informar al sistema inmunitario de los antígenos que se han ingerido o inhalado y desencadenar una respuesta en caso necesario.
En caso de infección de garganta, pueden aumentar de tamaño y ser dolorosas, dando lugar a lo que se conoce como anginas.
En los niños, puede ser necesario extirparlas quirúrgicamente (amigdalectomía), si alcanzan un tamaño excesivo en relación con el diámetro de la faringe, por riesgo de obstrucción de las vías respiratorias.
Los tejidos linfoides asociados a la mucosas (también conocidos como MALT, mucosa-associated lymphoid tissue) se encuentran dispersos por los distintos órganos con mucosa, como el tubo digestivo (GALT, gut-associated lymphoid tissue), los bronquios (BALT), la cavidad nasal (NALT) y la piel (SALT, skin-ALT). Su organización y funcionamiento son muy parecidos a los de los ganglios linfáticos.
Los órganos linfoides terciarios son estructuras linfoides presentes en el interior de los tejidos y que contienen pocos linfocitos en condiciones de salud normales. De hecho, podría decirse que son puestos avanzados de los órganos linfoides capaces, en caso de agresión local, de reclutar y activar rápidamente un gran número de linfocitos. A menor escala, su arquitectura es similar a la de los ganglios linfáticos.
En resumen
Las células del sistema inmunitario que se encuentran en la mayoría de los tejidos:
• se producen en la médula ósea;
• se extienden por los órganos linfoides;
• circulan por la sangre y la linfa.
Las citocinas son moléculas solubles (proteínas o glicoproteínas) que desempeñan una función de señalización entre las células. Las sintetizan principalmente las células del sistema inmunitario. También pueden producirlas otras células del organismo, como las células vasculares (endoteliales) o las células de soporte tisular (epiteliales/fibroblastos).
Es el medio por el que las células inmunitarias se comunican entre sí y con su entorno. Además de su participación en la respuesta inmunitaria y la inflamación, las citocinas intervienen en la formación de las células sanguíneas y el desarrollo embriológico.
Actúan localmente y a distancia gracias a receptores específicos denominados receptores de citocinas: directamente entre células cercanas (acción paracrina), células distantes (acción endocrina) o incluso en la propia célula productora (acción autocrina).
La activación del receptor de una citocina desencadenará una cascada intracelular de señales que modificarán la función celular aumentando o disminuyendo la expresión génica.
Se dice que las citocinas tienen un perfil de actividad pleiotrópico y redundante. Pleiotrópico, porque una misma citocina tiene consecuencias múltiples y diferentes según el tipo de célula que recibe su señal. Y redundante, porque varias citocinas pueden producir el mismo efecto.
Un apunte sobre el vocabulario
El término «citocina» es el más utilizado para designar estas moléculas de comunicación intercelular. Inicialmente se utilizó el término «interleucina», ya que los investigadores creían que las citocinas las producían los glóbulos blancos (leucocitos) y actuaban principalmente entre ellos. En la actualidad, la nomenclatura de las distintas citocinas ha conservado el término interleucina, sea cual sea el origen o la función de la citocina. La numeración de las citocinas es la siguiente: IL-1, IL-2, IL-10, etc.
Los términos «linfocina» (producida por linfocitos) o «monocina» (producida por monocitos) ya no se utilizan habitualmente.
Por su parte, las quimiocinas son citocinas con poder quimiotáctico (poder de atracción).
¿Qué diferencias hay entre
las citocinas y las hormonas?
Citocinas |
Hormonas |
|
Origen |
Secretadas por varios tipos de células |
Secretadas por un único tipo de células especializadas y localizadas: las células de las glándulas |
Objetivos |
Numerosos: inmunes y no inmunes |
Solo las células diana |
Actividad |
Pleiotrópica |
Actividad única o restringida |
Modo de acción |
Paracrina Autocrina Endocrina |
Endocrina |
Para dirigirse al lugar de un ataque, las células inmunitarias utilizan sus receptores para detectar las quimiocinas que se emiten desde donde aquel se produce. Las quimiocinas son un subgrupo de citocinas con propiedades quimioatrayentes (quimiotaxis), es decir, capaces de atraer a otra célula. Las células inmunitarias se orientan detectando una concentración de quimiocina y se desplazan hacia la zona donde la concentración es mayor.
Existen varias formas de clasificar las citocinas: según su papel funcional, según su función antiinflamatoria o inflamatoria, según la estructura de su receptor, etc.
Clasificación según su función antiinflamatoria o inflamatoria
Citocinas inflamatorias: TNF-α, IL-1, IL-4
Citocinas antiinflamatorias: TGF-β, IL-10, IL-4, IL-13
Clasificación funcional de las citocinas
Interferones (IFN): citocinas implicadas en la eliminación de patógenos
Se distingue entre:
Interferones
Interferones de tipo I: por ejemplo, IFN-α o IFN-β, que se producen en caso de infección vírica e inhiben directamente la replicación vírica.
Interferones de tipo II: por ejemplo, el IFN-γ, que atrae a los leucocitos al lugar adecuado y activa a los macrófagos para que destruyan las bacterias que se hayan podido ingerir.
Citocinas de la familia del TNF (tumor necrosis factor, «factor de necrosis tumoral»): citocinas implicadas en el desencadenamiento de la muerte celular (apoptosis).
Por ejemplo:
TNF-α, TRAIL (TNF-related apoptosis inducing ligand), FAS-L.
Citocinas implicadas en la hematopoyesis: CSF (colony-stimulating factors). Intervienen en la producción y diferenciación de células sanguíneas a partir de células madre hematopoyéticas. También pueden participar en la activación de las células inmunitarias.
Por ejemplo:
M-CSF: factor estimulante de colonias de macrófagos
GM-CSF: factor estimulante de colonias de granulocitos macrófagos
G-SCF: factor estimulante de colonias de granulocitos
Citocinas de factores de transformación: TGF (transforming growth factors). Intervienen en la cicatrización y en el control de la inflamación (acción antiinflamatoria).
Por ejemplo:
TGF-α, TGF-β
Quimiocinas: son citocinas con propiedades quimiotácticas.
Por ejemplo: CXCL8, CXCL1, CCL4, CCL5
Es un proceso por el que determinadas células ingieren a un agresor para digerirlo. Estas células se denominan células fagocíticas o fagocitos.
La fagocitosis de un agresor comprende varias etapas:
1. Adhesión: la célula fagocítica reconoce y se adhiere al agresor utilizando receptores de reconocimiento de patrones moleculares asociados a patógenos (PAMP).
2. Ingestión: gracias a las extensiones celulares llamadas pseudópodos (en forma de dedos), la célula rodea al agresor con su membrana celular y lo ingiere.
3. Digestión: la célula fagocítica posee vesículas en su citosol con contenido ácido y llenas de enzimas de degradación (proteasas, glicosidasas, nucleasas, fosfatasas, etc.) llamadas lisosomas. Estas vesículas lisosomales se fusionan con el fagosoma para formar el fagolisosoma. De este modo, el agresor contenido en el fagosoma se pone en contacto con un conjunto de enzimas que llevan a su digestión.
Las células presentadoras de antígenos, como las células dendríticas o los macrófagos, presentan en su superficie fragmentos del agresor en moléculas CMH de clase II. Los receptores de los linfocitos auxiliares (CD4 +) pueden reconocer estos antígenos.
Las siguientes células inmunitarias están implicadas en la fagocitosis: neutrófilos, macrófagos, células dendríticas.
La célula diana se destruye el entrar en contacto directo con la célula inmunitaria.
Existen dos métodos de destrucción celular:
• Por liberación de gránulos citotóxicos que contienen perforina o granzimas. La perforina forma poros (agujeros) en la membrana de la célula diana. Las granzimas son un tipo de enzimas que, una vez presentes en el citoplasma de la célula diana, activan su apoptosis (muerte celular programada).
• Por expresión de ligandos de receptores de muerte celular: la expresión del ligando Fas (FasL) o TRAIL (TNF-related apoptosis inducing ligand) induce la activación en la célula diana de enzimas implicadas en la muerte celular (apoptosis).
Las siguientes células inmunitarias recurren a la citotoxicidad celular directa:
linfocito T citotóxico (CD8 +), célula natural killer (NK).
Los anticuerpos son la forma secretada de los receptores de antígenos de los linfocitos B (BCR). Por su origen, son capaces de unirse muy específicamente a su antígeno gracias a su parte variable. Los anticuerpos atacan al agresor de varias maneras:
• Aglutinación: el anticuerpo actúa como un pegamento sobre el agresor, aglutinándolo en grumos y obstaculizando su proliferación.
• Neutralización: el anticuerpo se une a un elemento que el agresor utiliza para atacar a la célula (receptor para entrar en la célula normal, toxina, etc.). De este modo, el anticuerpo impide directamente el mecanismo de ataque del agresor.
• La opsonización o fagocitosis celular dependiente de anticuerpos (ADCP, antibody-dependent cellular phagocytosis): cuando un agresor está recubierto de anticuerpos, las posibilidades de reconocimiento por parte de las células fagocíticas son mayores.
• Activación del complemento: la presencia de anticuerpos en la superficie de un agresor activa una reacción en cascada conocida como cascada del complemento (véase la página siguiente). Se trata de un mecanismo de respuesta inmunitaria innata que provoca la atracción de efectores inmunitarios y la formación de agujeros en el agresor para facilitar su destrucción.
• Citotoxicidad mediada por células dependientes de anticuerpos (ADCC, antibody-dependent cell-mediated cytotoxicity): las células NK reconocen el fragmento Fc del anticuerpo y eliminan al agresor por citotoxicidad directa gracias al reconocimiento específico del anticuerpo.
Una vez unido a su antígeno, es la parte constante del anticuerpo (el fragmento Fc) la que interactúa con el sistema inmunitario. Varios tipos de células inmunitarias pueden utilizar estos anticuerpos para actuar contra el agresor, gracias a la presencia de receptores —que reconocen el fragmento constante— denominados receptores Fc:
• Macrófagos y neutrófilos: activación de la fagocitosis (ADCP).
• Mastocitos, basófilos y eosinófilos: degranulación de sustancias inflamatorias para luchar contra los parásitos (ADCC).
• NK: citotoxicidad directa por secreción de perforina y granzima (ADCC).
La parte constante del anticuerpo (fragmento Fc): un papel esencial
La función y distribución del anticuerpo en el organismo dependen de la cadena pesada que compone el fragmento constante. La inmunoglobulina M (anticuerpos formados a partir de una cadena μ pesada) no tienen la misma función ni distribución que la inmunoglobulina G (anticuerpos formados por una cadena γ pesada).
Este mecanismo de defensa forma parte de la inmunidad innata. Implica una cascada de reacciones basadas en proteínas presentes en el plasma y que tiene lugar al entrar en contacto con la superficie del agresor.
Esta cascada de reacciones puede activarse por la presencia de grupos de anticuerpos (denominados complejos inmunitarios) en la superficie de un agresor.
Esta cascada conduce a:
• Una respuesta inflamatoria y al reclutamiento de efectores celulares (atracción por quimiotaxis de neutrófilos y macrófagos).
• La estimulación de la fagocitosis (opsonización) por los neutrófilos o macrófagos.
• La formación de agujeros (poros) en el agresor para favorecer su destrucción mediante la formación de complejos de ataque de membrana.
Cada agresor tiene su propio medio de lucha
Bacterias, parásitos: neutrófilos y macrófagos intervienen para fagocitar al agresor mediante internalización y digestión.
Células infectadas por virus y células cancerosas: los linfocitos T citotóxicos CD8+ (asesinos) participan en su eliminación.
Toxinas bacterianas, virus, parásitos: los anticuerpos (producidos por los linfocitos B) se encargan de neutralizarlos.
El sistema inmunitario es un arma muy poderosa que debe regularse para evitar que se descontrole; de ello se encargan los mecanismos de tolerancia inmunitaria.
Para mantener la integridad de nuestro organismo, incluso en caso de infección grave, el sistema inmunitario busca sistemáticamente volver a un punto de equilibrio. Toda reacción inmunitaria va acompañada de mecanismos reguladores.
La tolerancia inmunitaria le permite al sistema evitar la aparición o la continuación de su respuesta a una agresión determinada.
Es esencial para el funcionamiento normal de nuestro organismo. Es lo que impide que nuestro sistema inmunitario ataque a las células sanas del organismo (células propias) o reaccione de forma exagerada, incluso peligrosa, ante una agresión. Sin estos mecanismos de tolerancia, el sistema inmunitario puede favorecer la aparición de enfermedades autoinmunes, reacciones alérgicas o respuestas inflamatorias fulminantes, incluso mortales, a las infecciones. Gracias a ellos también, el sistema inmunitario de una mujer embarazada no ataca al feto.
Existen dos niveles de tolerancia inmunitaria: mecanismos centrales durante la maduración de los linfocitos, para limitar con antelación el riesgo de producir linfocitos autorreactivos, o mecanismos periféricos, para limitar la intensidad y la duración de la respuesta inmunitaria.
Los mecanismos centrales de tolerancia son procesos que tienen lugar durante la maduración de los linfocitos T (en el timo) o de los linfocitos B (en la médula ósea). De hecho, la extrema diversidad de los receptores antigénicos hace que se generen linfocitos autorreactivos. Para evitar la producción de linfocitos que ataquen al propio organismo, el proceso de maduración linfocitaria da lugar a la supresión de los linfocitos en maduración que reconocen los antígenos propios con demasiada intensidad. Este proceso regulador central se conoce como selección negativa y no elimina los linfocitos que son débilmente autorreactivos, es decir, que reconocen antígenos propios, pero con baja afinidad. Por tanto, se necesitan mecanismos de tolerancia periféricos para limitar su activación.
Son las células inmunosupresoras por excelencia. Su función es suprimir o reducir la inducción y proliferación de linfocitos efectores.
Para llevar a cabo sus funciones inmunosupresoras/reguladoras, el linfocito T regulador puede:
• Inducir directamente la muerte de los linfocitos T efectores mediante la producción de granzimas o perforina.
• Expresar moléculas de coinhibición en su superficie para inhibir los linfocitos efectores o las células presentadoras de antígenos.
• Liberar citocinas antiinflamatorias, como TGF-β o IL-10.
Las células dendríticas y los macrófagos captan los residuos del entorno y los presentan al sistema inmunitario adaptativo. Sin embargo, los mismos antígenos pueden presentarse de forma inmunógena (para inducir una respuesta inmunitaria) o tolerogénica (para promover la tolerancia), en función de las señales de peligro detectadas. Así, si las señales de peligro son débiles, la célula dendrítica responsable de presentar los antígenos a los linfocitos se diferenciará en una célula dendrítica tolerogénica.
Una célula dendrítica tolerogénica es capaz de inhibir a los linfocitos efectores por diversos mecanismos (expresión en su superficie de moléculas coinhibidoras para inhibir a los linfocitos efectores, liberación de citocinas antiinflamatorias al medio, producción de una enzima, la IDO, indoleamina 2,3-dioxigenasa).
Anergia de los linfocitos efectores: señales de coinhibición
El reconocimiento específico del complejo CMH+péptido por parte del TCR es necesario, pero no suficiente, para activar el linfocito. Es el equilibrio entre las señales activadoras y las inhibidoras lo que determinará si el linfocito se activa o no. Estas señales de coactivación o coinhibición se denominan chekpoints («puntos de control»). Este mecanismo impide que el sistema inmunitario se active con demasiada facilidad, lo que podría ser perjudicial.
Así, un linfocito efector puede volverse anérgico, es decir, reconocer su antígeno específico, pero ser incapaz de activarse debido a inhibidores de puntos de control.
¿Cómo escapa el feto
al sistema inmunitario materno?
Durante el embarazo, el feto se percibe, al menos teóricamente, como un elemento ajeno por parte del sistema inmunitario de la madre debido a la presencia de genes paternos.
De hecho, esta tolerancia hacia el feto está vinculada a la placenta, que actúa como barrera inmunitaria entre la madre y su descendiente. En primer lugar, las células de la placenta no expresan las moléculas HLA-A o HLA-B del CMH de clase I, lo que limita la destrucción por los linfocitos T citotóxicos maternos.
La placenta produce sustancias inmunomoduladoras, como la progesterona o el estradiol, que inhiben las células NK. La placenta también limita el paso de las células inmunitarias maternas, permitiendo únicamente el paso de inmunoglobulinas de tipo IgG. Estos anticuerpos no se dirigen normalmente a las células fetales, que no pasan al torrente sanguíneo materno.
En caso de que los glóbulos rojos o las plaquetas fetales pasen al torrente sanguíneo materno, existe el riesgo de inmunización fetomaterna (de la madre al feto) si los glóbulos rojos o las plaquetas son portadores de un antígeno (heredado del padre) que la madre no posee. Este paso de antígenos fetales a la sangre de la madre se favorece durante el parto, en caso de traumatismo abdominal o de interrupción del embarazo (aborto espontáneo o voluntario). Esta inmunización es la causa de la enfermedad hemolítica del recién nacido (si la inmunización afecta a los glóbulos rojos) o de la trombocitopenia neonatal (si afecta a las plaquetas).
Para detectar el riesgo de que se produzca una enfermedad hemolítica durante el embarazo, se controlan sistemáticamente los anticuerpos irregulares mediante pruebas de detección de aglutininas irregulares. Cuando nace un niño con Rh positivo de una mujer con Rh negativo, se inyectan inmunoglobulinas anti-D como medida preventiva para enmascarar las moléculas de Rh fetales e impedir que el sistema inmunitario materno las detecte y desarrolle una respuesta.
Cuando el sistema inmunitario se desboca en su lucha contra las infecciones
Las enfermedades infecciosas suponen una amenaza directa para el organismo debido a la acción nociva directa del elemento agresor. Sin embargo, a veces el sistema inmunitario, que trata de destruir las células infectadas, pierde el control y empieza a destruir todo lo que encuentra a su paso. Por ejemplo, en el caso de las infecciones víricas agudas por hepatitis, como la hepatitis B, existe el riesgo de hepatitis fulminante. Esta inflamación aguda de todo el hígado, ligada a la reacción excesiva del sistema inmunitario al virus, expone al paciente a un riesgo de muerte si no se realiza un trasplante urgente del órgano.
Con una superficie de doscientos cincuenta metros cuadrados, el tubo digestivo es una interfaz gigantesca de intercambio con nuestro entorno. Las mucosas del organismo, y en particular el tubo digestivo, están constantemente expuestas a estímulos para el sistema inmunitario: bacterias, alérgenos derivados de la alimentación, metabolitos de medicamentos, etc., que teóricamente deberían provocar una respuesta inmunitaria. Sin embargo, treinta billones de bacterias, o más de mil especies diferentes, habitan en nuestro tracto digestivo sin causar ninguna enfermedad. Estas bacterias se conocen como bacterias comensales, lo que significa que se alimentan de los residuos presentes en la mucosa digestiva sin atacar al huésped.
De hecho, el papel de la flora bacteriana es esencial para regular el sistema inmunitario: tanto para evitar una acción excesiva como para mantener una activación mínima en todo momento.
El estudio experimental en animales en los que se han suprimido las bacterias comensales muestra una reducción significativa del tamaño de los órganos linfoides y de la capacidad de respuesta inmunitaria.
Las bacterias comensales estimulan de manera continua nuestro sistema inmunitario. Y, como hemos visto, el sistema inmunitario innato nos protege de las bacterias comensales. La mucosa digestiva nos protege a través de la barrera epitelial (unión entre las células de la mucosa), de la producción de moco y de los péptidos antimicrobianos. Esto permite contener las bacterias en el tubo digestivo para evitar que entren en el organismo. Los macrófagos que residen en la mucosa ingieren rápidamente, llegado el caso, las bacterias capaces de atravesar esta barrera fisicoquímica. También estimulan los linfocitos B de memoria presentes para mantener la producción de IgA (inmunoglobulina A), que se segrega en la mucosa.
Por lo tanto, las bacterias comensales desempeñan un papel en la estimulación regular de las defensas innatas para que sigan siendo funcionales en caso de ataque de una bacteria patógena.
El equilibrio entre las distintas especies bacterianas comensales también impide que una bacteria virulenta cause daños.
Esta es una de las razones por las que la toma de antibióticos es a menudo responsable de la aparición de diarrea. Al tratar una infección bacteriana, como una neumonía, el antibiótico altera el equilibrio de la flora bacteriana comensal eliminando ciertas especies, lo que favorece la predominancia de bacterias virulentas responsables de la inflamación de la mucosa digestiva, que se manifiesta en forma de diarrea.
La flora bacteriana comensal también modera la respuesta local y general del sistema inmunitario. La captación de productos bacterianos o metabolitos de la flora comensal por parte de los macrófagos y células dendríticas presentes en la mucosa digestiva tiende a provocar la secreción de señales antiinflamatorias que permiten la inducción y expansión local de linfocitos T reguladores (Treg).
Esto podría explicar, por ejemplo, el efecto antidiarreico beneficioso de los probióticos, lo que sucede cuando se ingieren ciertas especies bacterianas, como la Saccharomyces boulardii. Este principio también explica los beneficios del trasplante de flora fecal para el tratamiento de enfermedades inflamatorias del tubo digestivo o de infecciones bacterianas digestivas graves.
Hoy en día, algunos estudios en animales parecen demostrar el papel de la microbiota en la aparición de determinadas patologías generales: enfermedades inflamatorias, algunos tipos de cáncer, etc.
Trasplante de microbiota fecal (TMF)
Consiste en lavar primero el intestino del enfermo antes de administrarle heces de un donante sano a través de una sonda nasogástrica o una colonoscopia. Se utiliza como tratamiento experimental, si los tratamientos convencionales no funcionan, para formas graves de infecciones multirresistentes por Clostridium difficile. De hecho, el TMF es casi cuatro veces más eficaz que los antibióticos (94 % de éxito frente al 23 %; referencia: «Duodenal Infusion of Donor Feces for Recurrent Clostridium difficile», New England Journal of Medicine).
Los probióticos son microorganismos vivos (como bacterias o levaduras) que pueden añadirse como suplemento a determinados productos alimenticios con el objetivo de obtener un efecto beneficioso para la salud.
Los conocimientos científicos actuales no permiten definir la composición de la microbiota de un tubo digestivo sano. Más que de una composición precisa de bacterias, se trata de un equilibrio dinámico, propio de cada individuo, que viene determinado por nuestros genes, pero sobre todo por nuestros hábitos de higiene y alimentación.
Los probióticos no sustituyen la compleja diversidad de la flora comensal. Además, no contienen necesariamente bacterias comensales (presentes de forma natural en el organismo), lo que sugiere que las bacterias presentes en los probióticos solo desempeñan una función temporal, mientras se reconstituye la flora comensal.
En general, los probióticos han demostrado ser beneficiosos en el tratamiento sintomático de la diarrea infecciosa, la prevención de la diarrea relacionada con la toma de antibióticos por parte de niños y la prevención de la diarrea relacionada con la bacteria Clostridium difficile.
Es importante señalar que los datos científicos actuales que demuestran estos beneficios se refieren a un número muy elevado de cepas bacterianas diferentes. Pero no todas las especies bacterianas tienen el mismo efecto y este efecto también puede variar en función de la flora comensal de cada individuo.
Pese a las expectativas que pudieran crear, los datos científicos actuales no demuestran que los probióticos sean realmente beneficiosos para prevenir las infecciones urinarias o vaginales, las alergias o los eccemas. Más bien, los probióticos parecen desempeñar un papel en la prevención de las infecciones de las vías respiratorias superiores (como el resfriado común), pero los estudios actualmente disponibles no son suficientemente rigurosos para poder afirmarlo categóricamente.
Los alimentos probióticos no cumplen
los criterios exigidos para los medicamentos
A diferencia de la normativa que impone a los medicamentos definir sus componentes al detalle, los alimentos probióticos a la venta rara vez indican las cepas bacterianas que contiene el producto. Es más, no se puede conocer la cantidad exacta de cada una de las bacterias que se ingieren. Y tampoco se indica la duración de la actividad de las bacterias.
Los beneficios de los probióticos: afirmaciones
infundadas hasta la fecha
Según la Autoridad Europea de Seguridad Alimentaria (EFSA, según sus siglas en inglés), ningún alimento probiótico ha demostrado su eficacia hasta la fecha.
Desde 2007, es la normativa europea, aplicable en todos los Estados miembros, la que regula el uso de declaraciones nutricionales y acerca de las propiedades saludables en las comunicaciones comerciales de los productos alimenticios (Reglamento CE n.º 1924/2006).
Las declaraciones nutricionales y de propiedades saludables son afirmaciones, imágenes o símbolos que realzan el valor nutritivo o saludable de los alimentos, como frases del tipo «refuerza las defensas naturales», «facilita el tránsito intestinal» o similares.
Estas declaraciones se someten ahora a una evaluación científica centralizada por parte de la Autoridad Europea de Seguridad Alimentaria, que protege a los consumidores de la información falsa que pueda utilizar la industria.
Hasta la fecha, todas las declaraciones de propiedades saludables de alimentos que contienen microorganismos (como los probióticos) han sido rechazadas por la EFSA.
La memoria inmunitaria es el mecanismo por el cual el organismo, cuando se encuentra por segunda vez con el mismo agente infeccioso, desencadena una respuesta más rápida y eficaz.
Este mecanismo es posible gracias a los linfocitos de memoria. Cuando se encuentra con un agresor por primera vez, el sistema inmunitario adaptativo tarda una semana en poder ofrecer una respuesta eficaz.
Los linfocitos B se dividen en células productoras de anticuerpos (células plasmáticas) y en células de memoria que, si vuelven a encontrarse con el mismo agresor, pueden empezar a producir anticuerpos más rápidamente. Además de un tiempo de reacción más corto, los anticuerpos resultantes son más precisos y eficaces. Esta nueva estimulación por el antígeno conduce a una diversificación secundaria de los anticuerpos, que modifica su afinidad (mejor reconocimiento) y su función (modificación de la cadena pesada del anticuerpo). Por ejemplo, el cambio de una IgM a una IgG permite que el anticuerpo se propague mejor por los tejidos del organismo.
Para determinar si una infección es más o menos reciente, los médicos pueden pedir que se analicen anticuerpos específicos: si solo hay IgM, la infección es reciente, ya que los linfocitos B aún no han tenido tiempo de producir IgG. Por el contrario, si los anticuerpos son IgG +/- IgM, la infección tiene más tiempo.
Del mismo modo, cuando los linfocitos T se activan por primera vez, se diferencian en células de memoria que pueden reaccionar más rápidamente en caso de una segunda infección por el mismo agente patógeno.
La respuesta inmunitaria protege al organismo a dos niveles: a través de la inmunidad innata y la inmunidad adaptativa, mencionadas anteriormente.
La inmunidad innata comprende todos los mecanismos de defensa que pueden movilizarse inmediatamente (en pocas horas). Es la primera línea de defensa del organismo. Es capaz de reconocer señales de peligro y patrones generales en la superficie de los patógenos (véase la página 17).
Por su parte, la inmunidad adaptativa es la respuesta inmunitaria específica que proporcionan los linfocitos. Tarda más en desarrollarse (unos días), pero conduce a una identificación precisa del agresor gracias al reconocimiento antigénico (véase la página 18).
Estos dos niveles de respuesta inmunitaria son complementarios e interdependientes. El inicio de la agresión pone en marcha inmediatamente la inmunidad innata (macrófagos, neutrófilos, células dendríticas) para luchar contra el agresor y liberar señales inflamatorias (citocinas). Las células dendríticas presentes localmente capturan fragmentos del agresor (antígenos) y migran al ganglio linfático de drenaje a través de los vasos linfáticos.
Es en el ganglio linfático donde el sistema inmunitario innato pone en marcha el sistema inmunitario adaptativo: la célula dendrítica activa el linfocito presentándole su antígeno específico. Las señales inflamatorias que envía localmente el sistema inmunitario innato guían a los linfocitos al lugar del ataque. Una vez allí, estos eliminan a los agresores y liberan señales para reforzar las respuestas inmunitarias innatas.
Como mecanismo de defensa inespecífico e inmediato, la inmunidad innata también envía señales de alerta para guiar la respuesta inmunitaria.
Varios elementos forman parte de la inmunidad innata:
• Barreras físicas, químicas y microbiológicas.
• Inflamación.
• Una serie de células propias de este tipo de inmunidad:
– mastocitos;
– células fagocíticas (neutrófilos, macrófagos, células dendríticas);
– basófilos y eosinófilos;
– células NK.
• La cascada del complemento.
Inmunidad innata |
Inmunidad adaptativa |
|
Elementos |
1. barrera física y química 2. células fagocíticas 3. células dendríticas 4. Células NK 5. proteína o plasma (complemento) |
1. inmunidad humoral: linfocitos B, células plasmáticas 2. inmunidad celular: linfocitos T |
Seguimiento de la actividad |
siempre presente |
normalmente silencioso |
Velocidad/eficiencia |
respuesta inmediata, pero eficacia limitada |
respuesta más lenta, pero mucho más eficaz |
Especificidad |
distingue entre diferentes clases de agentes patógenos (bacterias/virus/hongos/parásitos) sin distinción fina |
reconocimiento específico de perfiles precisos: antígenos específicos |
Desarrollo |
destrucción inmediata del agente patógeno o intento por contener la infección, a la espera de la acción de la respuesta adaptativa |
las células efectoras se producen en una semana y la respuesta global tiene lugar en una o dos semanas |
Memoria |
sin memoria eficacia y reactividad similares con cada exposición al agente patógeno |
células de memoria respuesta más rápida y eficaz en una nueva exposición al agente patógeno |
Adaptado del módulo de Inmunología de la UCSF, creado por Patrick Fisher, http://missinglink.ucsf.edu/lm/immunology_module
Los epitelios de revestimiento son los tejidos celulares que recubren el cuerpo con respecto al medio exterior: la piel (epidermis) y las mucosas. Son partes expuestas al exterior, como el epitelio respiratorio o el epitelio digestivo, entre otros. Están formados por células estrechamente relacionadas entre sí por uniones celulares.
Frente a las agresiones externas, estos epitelios de revestimiento desempeñan una función protectora esencial a través de diversos mecanismos:
• uniones estrechas entre células;
• superposición densa de capas de células y descamación (epitelio multicapa de la epidermis);
• flujo de aire (tracto respiratorio, tos) o líquido (tracto digestivo, peristaltismo), lo que ayuda a evacuar los agentes patógenos;
• producción de moco (epitelio bronquial), que atrapa los agentes patógenos;
• movimientos ciliares (epitelio bronquial).
Además de la protección mecánica que proporcionan los epitelios de revestimiento, otros mecanismos intervienen en el refuerzo de las defensas del organismo frente a los ataques infecciosos:
• Cambio del pH: acidez gástrica.
• Enzimas antimicrobianas: pepsina (estómago), lisozima (lágrimas), que descomponen los elementos constituyentes de los agentes infecciosos.
• Péptidos antimicrobianos: defensinas, catelicidinas, histatinas, etc. Son auténticos antibióticos naturales.
Como hemos visto, los microorganismos (bacterias, virus, hongos, etc.) que suelen residir en la superficie de la piel o las mucosas se conocen como flora comensal. Estos microorganismos, que viven en equilibrio con nuestro organismo, constituyen una primera defensa contra cualquier agente infeccioso susceptible de atacarlo. El agente sucumbe ante una flora comensal extremadamente abundante, que compite por los nutrientes disponibles y, por tanto, por la supervivencia. Además, la flora comensal mantiene localmente una estimulación mínima permanente de nuestro sistema inmunitario, contribuyendo a reforzarlo y a reforzar la función de la barrera epitelial (véase la página 51, «Papel de la microbiota»).
Si las barreras fisicoquímicas y microbiológicas locales no contienen la agresión, el segundo mecanismo que entra en juego es la respuesta inflamatoria.
La respuesta inflamatoria es un mecanismo de defensa inmunitario innato que alerta y dirige la respuesta inmunitaria, pero también participa en la activación de las células inmunitarias efectoras locales.
Las células inmunitarias que residen en el tejido atacado (mastocitos, macrófagos) reconocen un ataque detectando la presencia de agresores, o incluso la aparición de daños celulares. Para ello, utilizan receptores de señales de peligro (véase la página 17, «Reconocimiento de las señales de peligro»):
• PAMP: receptores de patrones moleculares asociados a patógenos.
• DAMP: receptores moleculares de reconocimiento de patrones asociados al daño celular.
Al reconocer las señales de peligro, estas células de la inmunidad innata liberan mediadores inflamatorios.
La liberación de estos mediadores inflamatorios da lugar al síndrome inflamatorio que todos conocemos, con los siguientes síntomas: enrojecimiento, calor, hinchazón y dolor. El enrojecimiento y la sensación de calor se deben a la vasodilatación de los pequeños vasos sanguíneos (capilares), que también provoca una ralentización local de la circulación sanguínea. La permeabilidad de los vasos se altera, lo que favorece la fuga de plasma (la parte líquida de la sangre), responsable del edema. Por último, el dolor se debe a la presión ejercida sobre las fibras nerviosas cercanas.
Estos mediadores inflamatorios permiten:
• Activar las células efectoras para estimular su acción antimicrobiana.
• Aumentar la dilatación y la permeabilidad de los vasos. Este mecanismo aumenta el suministro de componentes inmunitarios en la sangre y permite que más células fagocíticas lleguen al lugar de la inflamación.
La inflamación desempeña un papel muy importante en la lucha contra las agresiones al organismo, ya que activa los efectores inmunitarios ya presentes en el lugar (mastocitos, macrófagos), recluta nuevos efectores (neutrófilos, monocitos/macrófagos) e informa al sistema inmunitario adaptativo (mediante la activación de las células dendríticas).
Cuando tomar antiinflamatorios reduce la respuesta inmunitaria
Si tomamos antiinflamatorios para reducir los síntomas ligados a la inflamación (dolor), corremos el riesgo de reducir la eficacia de la respuesta inmunitaria. De hecho, el antiinflamatorio disminuye la producción de mediadores de la inflamación, lo que sin duda reduce los síntomas, pero al mismo tiempo dificulta la respuesta inmunitaria contra el agresor. En caso de infección, se corre el riesgo de que el agresor escape al control y siga propagándose en los tejidos, de manera completamente asintomática, porque el antiinflamatorio suprime los síntomas asociados a la infección.
Cuando se interrumpe la toma del antiinflamatorio, o cuando la infección se ha extendido, la inflamación deja de estar controlada y reaparece, esta vez en forma de una infección grave y, por tanto, más difícil de tratar.
Un ejemplo son las infecciones dentales en las que, a falta de un tratamiento eficaz por parte del dentista, la toma de un antiinflamatorio expone al paciente al riesgo de que se le propague la infección a la cara, lo que puede desembocar en una celulitis facial odontógena, una infección especialmente difícil de tratar.
Por eso siempre es aconsejable consultar a un médico antes de tomar antiinflamatorios para dolores inusuales o si se sospecha de que puedan estar causados por una infección.
Residen en los tejidos y las mucosas, y participan en la lucha contra los agentes infecciosos, la cicatrización de heridas y las alergias. Cuando reconocen señales de peligro, liberan gránulos que contienen sustancias inflamatorias y citotóxicas: histamina, leucotrienos, prostaglandinas y TNF-α.
Comprenden los neutrófilos, los macrófagos y las células dendríticas. Son capaces de fagocitar, es decir, ingerir, agresores o restos celulares (véase la página 41, «¿Cómo elimina el sistema inmunitario a sus agresores?»). Además de destruir al agresor ingiriéndolo, las células fagocíticas liberan sustancias inflamatorias para reforzar y atraer a las células efectoras.
Los macrófagos y las células dendríticas son células fagocíticas que residen en los tejidos. Y, por su parte, los neutrófilos son células sanguíneas capaces de migrar a los tejidos en caso de inflamación.
Algunas células fagocíticas, como los macrófagos y las células dendríticas, actúan como enlace con la inmunidad adaptativa. Son capaces de presentar trozos de agresores digeridos (llamados antígenos) a las células efectoras del sistema adaptativo (linfocitos): son las llamadas células presentadoras de antígenos.
Las células fagocíticas incluyen:
Neutrófilos
Pertenecen a la familia de los polinucleares (como los eosinófilos y los basófilos) y son los glóbulos blancos más importantes de la sangre. Poco presentes en los tejidos en su estado basal, acuden para reforzar la inflamación, lo que les permite atravesar los vasos e infiltrarse en los tejidos. Son, por tanto, los principales efectores celulares de la respuesta innata.
Cuando se activan por el reconocimiento de señales de peligro, liberan gránulos con contenidos tóxicos para eliminar al agresor: mieloperoxidasas, defensinas, lisozimas, etc. Como resultado de la fagocitosis de patógenos, acaban muriendo y a veces pueden formar lo que se conoce comúnmente como pus: una mezcla esencialmente de neutrófilos alterados, células muertas, patógenos residuales y plasma.
La liberación de mediadores inflamatorios también provoca un aumento de su producción en la médula ósea, lo que explica que aparezcan en mayor cantidad en las muestras de sangre tomadas durante una infección (lo que se conoce como hiperleucocitosis de neutrófilos).
Macrófagos
Son las principales células fagocíticas que residen en los tejidos. Tienen su origen en los monocitos de la sangre que, una vez en los tejidos, se convierten en macrófagos. Su función es actuar como efectores contra las agresiones, pero también eliminar los desechos celulares y, por último, reparar y mantener los tejidos (cicatrización).
Células dendríticas
Presentes en los tejidos, las células dendríticas no son realmente células efectoras, sino más bien sensores del entorno. Son las células presentadoras de antígenos por excelencia. Al igual que los macrófagos, estas son células que se originan en los tejidos a partir de monocitos que circulan en la sangre. En ausencia de señales inflamatorias, se encuentran en un estado basal, «inmaduro». En cuanto captan agentes patógenos o señales de peligro, sufren un proceso de maduración que les permite adquirir:
• mayor capacidad migratoria;
• mejor capacidad de presentación del antígeno.
A continuación, las células dendríticas maduras migran al ganglio linfático cercano (ganglio de drenaje), donde presentan el antígeno a los linfocitos inexpertos que circulan entre los distintos ganglios linfáticos.
Pertenecen a la familia de los polinucleares (como los neutrófilos) y circulan por la sangre. Al igual que los neutrófilos, suelen estar ausentes de los tejidos, pero pueden propagarse por ellos en caso de inflamación. Los eosinófilos y los basófilos desempeñan un papel importante en la lucha contra los parásitos, las alergias y las enfermedades inflamatorias. Cuando se activan, sus gránulos liberan sustancias tóxicas e inflamatorias directamente fuera de la célula (como la histamina), lo que permite atacar a los parásitos, que son organismos demasiado grandes para ser ingeridos.
Las células NK (natural killers, «asesinas naturales») están presentes en la sangre y se difunden en los tejidos en caso de inflamación. Se llaman así porque son intrínsecamente citotóxicas, es decir, su función es la de matar.
Se trata de células efectoras que no eliminan el agente patógeno en sí, sino las células alteradas (infectadas, tumorales, etc.). Su función es contener la infección hasta que se activen y produzcan linfocitos T CD8 citotóxicos específicos. Proporcionan una protección precoz contra los agentes patógenos intracelulares y las células tumorales.
No forman parte de las células inmunitarias adaptativas, ya que no tienen un receptor de antígeno específico. Llevan receptores activadores e inhibidores (moléculas coestimuladoras) que determinan su estado de activación.
Como ya se ha mencionado, la cascada del complemento es una reacción en cadena de proteínas presentes en el plasma que tiene lugar cuando estas entran en contacto con la superficie del agente patógeno.
Activada por la presencia de grupos de anticuerpos (llamados complejos inmunitarios) en la superficie de un patógeno, complementa la acción de los anticuerpos estimulando la fagocitosis, lo que lleva a crear una respuesta inflamatoria para reclutar otros efectores celulares y forma agujeros (poros) en el agresor.
La inmunidad adaptativa es la inmunidad específica que median los linfocitos. Solo puede establecerse si previamente se ha activado la inmunidad innata, pero tarda más en ser eficaz.
Por otro lado, es mucho más precisa a la hora de eliminar a los agresores porque los reconoce específicamente: se trata de la especificidad antigénica, posible gracias a los receptores antigénicos de los linfocitos (véase la página 20).
Por último, la inmunidad adaptativa es capaz de crear una memoria inmunitaria que le permite reaccionar con mayor rapidez y eficacia si vuelve a encontrarse con el mismo agente patógeno.
Las células de la inmunidad adaptativa son los linfocitos, que a su vez se dividen en linfocitos B y linfocitos T.
Algunas definiciones
Linfocito inexperto: linfocito T maduro que aún no ha encontrado un antígeno.
Linfocito efector: linfocito T maduro específico de antígeno capaz de realizar funciones celulares.
Linfocito de memoria: linfocito T maduro específico de antígeno en estado de reposo, que se ha generado durante un ataque anterior y que es capaz de responder rápidamente al antígeno si la agresión se produce de nuevo (efector de memoria).
Linfocitos T: sus receptores de antígenos se denominan TCR (T-cell receptor). Reconocen el antígeno en forma de trozos (péptidos) asociados a una molécula del complejo mayor de histocompatibilidad (CMH).
Esto se conoce como reconocimiento específico del antígeno propio (véase la página 21).
Los antígenos intracelulares se presentan en moléculas CMH de clase I y son reconocidos por el TCR de los linfocitos T CD8+ (véase la página 25).
Los antígenos extracelulares se presentan en moléculas CMH de clase II y los reconoce el TCR de los linfocitos T CD4+ (véase la página 25).
Existen 2 tipos de linfocitos T:
– Linfocitos T CD4:linfocitos T auxiliares (T-helper o Th) que activan las células de la respuesta inmunitaria: macrófagos, linfocitos B, NK, linfocitos T CD8, y hacen posible la respuesta adaptativa. El TCR de los linfocitos T CD4 reconoce un antígeno presentado por el CMH de clase II.
– Linfocitos T CD8:linfocitos T citotóxicos que reconocen y destruyen las células infectadas por virus y las células tumorales. El TCR de los linfocitos T CD8 reconoce un antígeno presentado por el CMH de clase I.
Linfocitos B:sus receptores de antígenos se denominan BCR (B-cell receptor) y corresponden a un anticuerpo con una parte de membrana. Reconocen el antígeno en su forma extracelular natural (forma nativa, es decir, no modificada). En su reconocimiento no interviene molécula alguna del CMH, por lo que se trata de un reconocimiento específico del antígeno no restringido al sistema inmunitario propio.
Una vez activados, los linfocitos B se convierten en células plasmáticas, una especie de fábricas de producción celular que segregan anticuerpos que se distribuyen por todo el organismo para combatir el agente patógeno.
La activación y orientación de la respuesta adaptativa dependen de la respuesta inmunitaria innata. Las señales inflamatorias que las células inmunitarias innatas envían específicamente al lugar de la agresión permiten:
1. Activar las células dendríticas, que migran hacia el ganglio de drenaje de la zona atacada.
2. Difundir quimiocinas (citocinas quimiotácticas), que guían a los linfocitos hasta el lugar del ataque.
La activación de un linfocito inexperto tiene lugar en los órganos linfoides secundarios (ganglios linfáticos) cuando encuentra a su objetivo concreto: el antígeno para el que es específico. Los linfocitos inexpertos circulan constantemente entre los ganglios linfáticos a través de la linfa. Solo se activan cuando encuentran a su antígeno específico, que presenta la célula dendrítica.
Cada linfocito reconoce a su antígeno mediante un receptor antigénico específico: es lo que se conoce como clon linfocitario. Gracias a la diversificación de los receptores antigénicos (véase la página 29, «¿Cómo funciona el sistema inmunitario para reconocer específicamente todos los antígenos posibles?: por recombinación V(D)J)», nuestro sistema inmunitario es capaz de reconocer todos los antígenos existentes. Sin embargo, dada la extrema diversidad de antígenos que nos rodean, el organismo no puede mantener tropas de linfocitos en reserva para cada antígeno. Por eso, para cada uno, el sistema inmunitario solo dispone de un clon de linfocitos. Cuando se activa, el linfocito se multiplica dividiéndose: entonces forma un ejército de clones contra el antígeno, lo que se conoce como respuesta clonal (multiplicación del mismo clon específico: 1 antígeno = 1 tipo de receptor = 1 clon de linfocito).
Un mismo agresor presenta varios antígenos que pueden activar diversos clones de linfocitos, lo que da lugar a una «respuesta policlonal» (multiplicación de varios clones). Una respuesta policlonal suele ser más eficaz porque permite atacar al mismo agente patógeno a varios niveles.
Para que el linfocito se active, deben ponerse en marcha una serie de salvaguardas. En primer lugar, el linfocito debe reconocer el antígeno del que es específico gracias a su receptor antigénico (TCR o BCR).
A continuación, la célula presentadora de antígeno envía diversas señales moduladoras al linfocito. Estas señales de coestimulación o coinhibición se conocen como puntos de control (checkpoints) del sistema inmunitario (véase la página 49). Es el equilibrio global de la señal recibida lo que determina en última instancia la activación del linfocito.
De hecho, en función de las señales de peligro percibidas localmente en el tejido atacado, la célula dendrítica presentará en su superficie diferentes moléculas coestimuladoras o coinhibidoras, que modularán la activación linfocitaria.
Una vez activado por su antígeno específico, el linfocito se multiplica dividiéndose en abundancia en el ganglio linfático donde se activó. El ejército de clones así formado se desplaza entonces a la zona de agresión, guiado por las quimiocinas que la inmunidad innata envía localmente. Algunos de los clones formados se diferencian en células de memoria (linfocitos de memoria), que podrán reactivarse con mayor rapidez en caso de nuevo ataque por parte del mismo agente patógeno (y tras la estimulación por el mismo antígeno).
Una vez allí, los linfocitos efectores reconocen específicamente su objetivo y desempeñan su función:
• Destrucción celular directa por linfocitos T citotóxicos CD8+ de células que presentan el péptido específico en una molécula CMH de clase I.
• Activación de efectores innatos locales por linfocitos T auxiliares CD4+ (neutrófilos, macrófagos) que presentan el péptido específico en una molécula CMH de clase II.
• Producción de anticuerpos por los linfocitos B.
Para que un linfocito B inexperto se active, primero debe reconocer específicamente su antígeno a través de su BCR (véase la página 18). La unión del antígeno al BCR permite la internalización del agente patógeno y la presentación de fragmentos suyos en las moléculas CMH de clase II de la superficie del linfocito B.
De este modo, los linfocitos T auxiliares (CD4+) específicos del mismo patógeno y activados en el mismo ganglio linfático pueden reconocer el antígeno presentado en el CMH de clase II. A continuación, el linfocito T auxiliar permite la activación formal del linfocito B mediante la expresión de moléculas coestimuladoras (CD40-L) y la secreción de citocinas (IL-4, IL-5). Una vez activado, el linfocito B se multiplica y se convierte en linfocitos B de memoria y linfocitos secretores de anticuerpos: las células plasmáticas.
Las células T auxiliares CD4+ no tienen la capacidad de eliminar directamente las células anormales, como hacen las células T CD8+, pero su papel es esencial en la coordinación y activación de toda la respuesta inmunitaria.
Cuando la célula dendrítica la activan en el ganglio, aquella también transmite señales que dirigen la función del linfocito auxiliar: es lo que se conoce como polarización linfocitaria. En realidad, estas señales de polarización dependen de las condiciones en las que se activó la célula dendrítica en el lugar del ataque: transmite a la vez información específica sobre el agresor (especificidad antigénica) e información general sobre el contexto del ataque.
La célula dendrítica activada puede liberar citocinas que polarizan el linfocito T auxiliar durante su activación. En función de la polarización, se han identificado varios perfiles de T auxiliares: la polarización Th1 (para T-helper de tipo 1), que dirige el sistema inmunitario para que luche contra las agresiones intracelulares, la polarización Th2, para que ataque a los agentes patógenos extracelulares como los parásitos, la polarización Th17, para que luche contra los agentes patógenos extracelulares bacterianos y fúngicos, y la polarización Treg (linfocitos T reguladores), para la inhibición de las respuestas inmunitarias.
Así, la presencia de interferón gamma dirige al linfocito T auxiliar para que evite una agresión intracelular: los linfocitos T auxiliares Th1 activan los macrófagos para que digieran los agentes patógenos que se hayan ingerido y promuevan la activación de los linfocitos T citotóxicos CD8+ o de los linfocitos B para producir anticuerpos opsonizantes (IgG) que facilitarán la fagocitosis.
La presencia de IL-4 dirige al linfocito T auxiliar para que evite la agresión parasitaria extracelular: los linfocitos T auxiliares Th2 activan más específicamente a los linfocitos B para que produzcan anticuerpos neutralizantes (IgG, IgM, IgA e IgE).
La presencia de IL-21 e IL-23 dirige al linfocito T auxiliar para que luche contra la agresión extracelular bacteriana o fúngica: los linfocitos T auxiliares Th17 activan más específicamente a los neutrófilos.
Por último, la presencia de IL-10 o TGF-β polariza el linfocito T auxiliar en un linfocito T regulador capaz de inhibir las respuestas inmunitarias, especialmente mediante la secreción de citocinas inmunosupresoras.
El hemograma proporciona un análisis cuantitativo (numeración) y cualitativo (tipología) de los distintos elementos de la sangre.
Valores normales2 del análisis de sangre
Glóbulos rojos: |
Hemoglobina (Hb): anemia (disminución de la Hb) frente a poliglobulia (aumento de la Hb) Hombres: 13-17 g/dL Mujeres: 12-16 g/dL |
Plaquetas: |
150 000 a 400 000/mm3 (trombocitosis frente a trombocitopenia) |
Glóbulos blancos - leucocitos: 4000-10 000/mm3 |
Células polinucleares Neutrófilos (PNN) 1500-7000/mm3 (neutropenia frente a polinucleosis neutrófila) Eosinófilos < 400/mm3 (hipereosinofilia en caso de exceso) Basófilos < 100/mm3 (hiperbasofilia en caso de exceso) Linfocitos 1500-4000/mm3 (linfopenia frente a linfocitosis) Monocitos 200-800/mm3 (monocitopenia, hipermonocitosis) |
En cuanto al sistema inmunitario, los análisis de sangre pueden detectar un aumento de los glóbulos blancos, lo que se conoce como hiperleucocitosis.
Se trata de un signo de activación global del sistema inmunitario y puede revelar una infección bacteriana o una inflamación (polinucleosis neutrófila), una alergia o una enfermedad parasitaria (hipereosinofilia), cáncer de la sangre (neoplasia hematológica) o una infección vírica (hiperlinfocitosis).
Una disminución de los glóbulos blancos puede indicar una infección vírica (linfopenia), la toxicidad de un tratamiento (quimioterapia) o un cáncer de sangre (neoplasia hematológica) caracterizado por una disminución de los distintos tipos de glóbulos blancos, e incluso de los glóbulos rojos y las plaquetas, pero también por la presencia de células anormales llamadas blastos.
Anticuerpos: herramientas moleculares de uso cotidiano
Los receptores de antígenos de linfocitos B, o anticuerpos, se utilizan actualmente como herramientas de precisión en los análisis de laboratorio.
Los investigadores han aprendido a aprovechar el funcionamiento de los linfocitos B secretores de anticuerpos, o células plasmáticas, para utilizarlos en la producción de anticuerpos en grandes cantidades. La ventaja de los anticuerpos es su especificidad: reconocen su objetivo con gran precisión. Combinados con sustancias químicas o enzimáticas, estos anticuerpos se utilizan como herramientas de detección.
Esta técnica utiliza células en suspensión para hacerlas pasar por un flujo líquido y caracterizarlas mediante un láser.
La citometría de flujo se utiliza para analizar una muestra (sangre, líquido bronquial, tejido en suspensión) a nivel celular. Es una técnica muy habitual para identificar poblaciones inmunitarias en muestras biológicas.
Para identificar las células, se añaden a la suspensión celular anticuerpos específicos de la proteína de interés. Estos anticuerpos están acoplados a una molécula llamada fluorocromo, que emite una señal luminosa cuando pasa por el láser. Al ser específicos, los anticuerpos solo se unen a las células que expresan la proteína. Así, cuando las células pasan a través del láser, las que reflejan la luz son las que expresan la proteína de interés.
Por ejemplo, para marcar los linfocitos T que expresan la proteína CD3 (que corresponde al TCR), se utiliza un anticuerpo anti-CD3. Solo se identificarán las células que expresen CD3 en relación con todas las células de la suspensión, lo que permitirá calcular el porcentaje de linfocitos T (CD3 +).
Se pueden utilizar varios tipos de anticuerpos con fluorocromos que emiten luces de diferentes colores para estudiar varios parámetros. Actualmente, las máquinas más avanzadas pueden estudiar más de veinte parámetros simultáneamente.
Esta técnica hace uso de un método inmunoenzimático para medir anticuerpos, citocinas o antígenos.
Para ello se utilizan anticuerpos específicos del elemento de interés y anticuerpos acoplados a una enzima (conocidos como anticuerpos conjugados). En presencia de un sustrato, la enzima presente en los anticuerpos conjugados activa una reacción química que emite una señal coloreada (reacción cromogénica) o luminosa (fluorescencia). Esta coloración o fluorescencia se mide con un aparato específico (espectrofotómetro) y permite definir la concentración del elemento de interés. La enzima actúa como un amplificador: aunque se unan pocos anticuerpos conjugados con la enzima, esta produce muchas señales, lo que hace que esta prueba sea muy sensible.
Para detectar anticuerpos, utilizamos una placa de prueba recubierta con un antígeno diana contra el que buscamos anticuerpos. Se añade el suero del paciente: si contiene anticuerpos, se unirán a los antígenos presentes. Los pocillos se enjuagan para eliminar los anticuerpos no específicos que no se han unido. Tras el aclarado, solo quedan adheridos a la superficie del pocillo los complejos antígeno-anticuerpo específicos. Estos se revelan utilizando anticuerpos secundarios acoplados a una enzima reactiva.
La técnica ELISA se utiliza para la serología vírica, es decir, la prueba que detecta los anticuerpos contra los virus presentes en el suero, lo que permite confirmar que el paciente ha sido infectado por el virus.
Para detectar un antígeno o una citocina, se utiliza una placa de prueba en la que se fijan previamente anticuerpos «primarios» específicos del antígeno diana (el que se desea medir). El suero del paciente se añade al pocillo: si hay restos del antígeno presente, se unirá a los anticuerpos primarios en el fondo. El pocillo se enjuaga para eliminar los metabolitos que no se han unido. Tras el enjuague, solo quedan adheridos a la superficie del pocillo los complejos antigénicos específicos de los anticuerpos primarios. A continuación, se añaden «anticuerpos secundarios» (también conocidos como anticuerpos de detección), que también reconocen el antígeno unido por los anticuerpos primarios, formando un sándwich alrededor del antígeno. El pocillo se enjuaga de nuevo para eliminar los anticuerpos que no se han unido. Tras este segundo enjuague, solo quedan adheridos a la superficie del pocillo los complejos anticuerpo primario-antígeno-anticuerpo secundario.
Estos anticuerpos secundarios permiten la revelación gracias a su enzima acoplada.
Esta prueba analiza el funcionamiento de la médula ósea.
La realiza un médico de forma ambulatoria (sin necesidad de hospitalización), con el paciente tumbado y anestesia local.
Este examen se realiza cuando se detecta un mal funcionamiento de la médula en el hemograma (descenso de glóbulos blancos, rojos y plaquetas), en busca de células anormales que puedan estar interfiriendo en la actividad de producción de la médula.
La médula se extrae de huesos accesibles y ricos en médula roja, como el esternón o la cresta ilíaca (hueso de la cadera).
Tras inyectar un anestésico local, el médico punciona el hueso para aspirar una pequeña cantidad de médula. Esta muestra se extiende en un portaobjetos para observarla al microscopio.
La médula ósea normal contiene células madre precursoras de células sanguíneas: precursoras de glóbulos rojos (linaje eritroblástico), precursoras de plaquetas (linaje megacarioblástico), precursoras de neutrófilos (linaje granulocítico), linajes de eosinófilos, basófilos y el linaje monocítico. De este modo, el biólogo que observa la muestra puede determinar la riqueza de la médula (basada en el número de células) para cada linaje o si, por el contrario, determinados linajes son anormalmente pobres. También puede detectar si existen células anómalas que permitan diagnosticar distintos tipos de cáncer sanguíneo, como la leucemia.
Esta técnica se utiliza habitualmente para detectar y localizar la expresión de proteínas en los tejidos. En la práctica, una biopsia (muestra de un pequeño trozo de tejido) o una muestra quirúrgica (lesión extirpada durante una intervención quirúrgica) se corta en finas tiras de unas pocas micras para colocarlas en un portaobjetos que pueda examinarse al microscopio. Los médicos encargados de interpretar y realizar estos análisis son los anatomopatólogos.
Para detectar la expresión de una proteína concreta, se utilizan anticuerpos que la reconocen específicamente. Estos anticuerpos se unen con precisión a la zona del tejido que expresa la proteína de interés.
Se emplea este término, «inmunohistoquímica», porque esta técnica de análisis de tejidos (histo en griego) utiliza anticuerpos específicos de la proteína que se estudia —de ahí el término inmuno— acoplados a enzimas que catalizan una reacción química responsable de la tinción (reacción cromogénica).
También se puede utilizar un anticuerpo acoplado a un fluorocromo (sustancia química capaz de emitir fluorescencia) que es visible con un microscopio específico llamado microscopio de fluorescencia: es lo que se conoce como inmunohistofluorescencia.
Se pueden utilizar diferentes enzimas o fluorocromos acoplados a varios anticuerpos para observar la expresión de otras proteínas dentro de la misma sección de tejido.
Así pues, la inmunohistoquímica permite caracterizar mejor los tejidos observando las proteínas que expresan: proteínas estructurales (citoqueratinas), proteínas asociadas a la proliferación (Ki67), proteínas infecciosas, etc.
Esta técnica es de especial interés para caracterizar mejor el entorno inmunitario de los tejidos mediante la detección de las proteínas de las células del sistema inmunitario.
_______________________
1. En realidad, la denominación «B» procede de la bolsa de Fabricio, un órgano linfoide primario que solo se encuentra en las aves, donde se descubrieron.
2. Los valores normales pueden variar en función del sistema automatizado que utilice el laboratorio.