Antes de que salgáis de vuestra base interplanetaria con una carretilla espacial y la carguéis con piedras aleatorias, creo que os ayudará saber de qué están hechas las rocas que nos rodean y de dónde salieron los elementos que las componen. Y eso significa que nos tendremos que remontar al principio de los tiempos.
Lo primero que hay que tener en cuenta es que la materia que nos rodea está hecha de átomos y que los átomos están divididos en dos «partes». En el centro tienen un núcleo que alberga unas partículas con carga eléctrica positiva y otras sin carga, llamadas protones y neutrones, respectivamente. Alrededor de este núcleo se extiende una «nube» de unas partículas más pequeñas llamadas electrones, que tienen carga negativa y una masa unas 2.000 veces menor que a la de los protones o los neutrones.
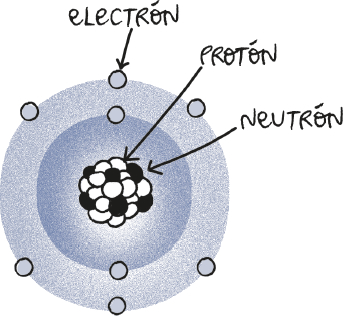
Este detalle es importante porque, en esencia, lo que distingue un elemento químico de otro es el número de protones que contiene el núcleo de sus átomos. Por ejemplo, los átomos que tienen 79 protones en su núcleo producen el metal amarillento y denso que llamamos oro. Si a esos átomos de oro les añadimos un solo protón, aumentando el total hasta 80, obtendremos un metal plateado que permanece en estado líquido a temperatura ambiente: el mercurio.
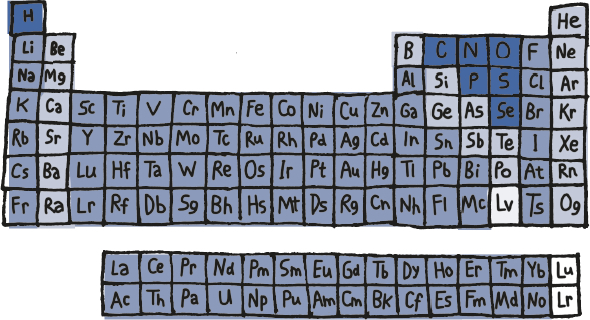
Si queréis saber cuántos protones contienen los átomos de un elemento en concreto, basta con consultar el llamado «número atómico» de su casilla de la famosa tabla periódica.
Información insuficiente para reconstruir la sección sobre la materia de mi base de datos.
Bueno, vale. Añadir un protón a un átomo tiene otras consecuencias.
Los protones tienden a repelerse entre ellos porque todos tienen carga eléctrica positiva, así que un núcleo atómico que solo contuviera protones saltaría por los aires al instante. Ahí es donde entran los neutrones, que, al no tener carga eléctrica y atraerse mutuamente con los protones mediante la llamada fuerza nuclear fuerte, los mantienen retenidos en el núcleo atómico. Dicho de otra manera: cuantos más protones contenga un núcleo atómico, más neutrones serán necesarios para mantenerlo estable y que ninguno de ellos se «escape».
Otro dato que se debe considerar es que los átomos tienden a poseer la misma cantidad de protones y de electrones (cargas positivas y negativas) porque «buscan» la neutralidad eléctrica. Por tanto, el incremento de protones de cualquier núcleo atómico tendrá que ir acompañado del mismo número de electrones. Este detalle es importante porque la cantidad de electrones que contiene un átomo y cómo están distribuidos alrededor del núcleo son lo que proporciona la mayor parte de las propiedades físicas y químicas a cada elemento, como su dureza, su color o su punto de fusión.
La información sigue siendo insuficiente.
Pues lo siento, ordenador, pero esta transmisión va sobre sobrevivir en el espacio, no es una clase detallada de física fundamental. Si algún náufrago espacial quiere ahondar en este tema, le recomiendo que le eche un ojo al libro Las cuatro fuerzas que rigen el universo,1 de mi abuelo Jordi Pereyra.
Calculando la probabilidad de que ese libro se esté vendiendo en otros planetas. Resultado: baja.
De momento es baja, ordenador. Tal vez en el futuro esta transmisión llegue a una colonia humana tan desarrollada que hasta tenga librerías.
La moraleja de todo esto es que en la actualidad se conocen 118 elementos químicos distintos o, lo que es lo mismo, sustancias puras con hasta 118 protones en sus núcleos atómicos y distintas cantidades de neutrones y electrones que les proporcionan diferentes apariencias y propiedades. Y esas 118 sustancias puras, recopiladas en la tabla periódica, son las que componen toda la materia que nos rodea.
Sin embargo, nuestro universo no siempre ha contenido una variedad de elementos tan amplia.2
La existencia del universo tal y como lo conocemos comenzó con el Big Bang. Este evento no fue una «gran explosión», como mucha gente piensa. Lo que se cree que ocurrió en realidad es que toda la energía del universo estaba concentrada originalmente en un volumen muchísimo menor que el actual, hasta que, hace unos 13.800 millones de años, se empezó a expandir de manera violenta y repentina.
Aunque la temperatura inicial del espacio era del orden de billones de trillones de grados (1032 ºC), el universo se enfrió rápidamente a medida que se expandía y su energía se repartía por un volumen cada vez mayor. Un segundo después del Big Bang, la temperatura había bajado hasta unos 10.000 millones de grados y el espacio estaba lo bastante frío como para que se condensasen los primeros electrones y quarks. Además, estas últimas partículas subatómicas se comenzaron a combinar entre ellas y dieron lugar a los primeros protones y neutrones individuales. Acababa de surgir el primer elemento químico, el más sencillo, el hidrógeno, con un solo protón en su núcleo y símbolo químico H.
Pero esos núcleos de hidrógeno no estarían solos mucho tiempo, porque unos 9 segundos después, la temperatura del espacio había bajado de los 1.000 millones de grados y un gran número de parejas de protones y neutrones se congregaron en grupos de cuatro partículas. Estos núcleos atómicos con dos protones y dos neutrones se correspondían con el helio (He), el segundo elemento más simple.
Llegados a este punto, el universo primigenio estaba ocupado por nubes gigantescas de núcleos con carga positiva de hidrógeno y helio y de electrones libres con carga negativa, pero los electrones no se podían incorporar a los núcleos atómicos y formar átomos neutrales porque hacía demasiado calor.
Datos insuficientes. ¿Por qué iba el calor a impedir que se uniesen?
Simplificando muchísimo, porque lo que los humanos percibimos como calor es solo un reflejo de lo rápido que se mueven los átomos de una sustancia: cuanto más caliente está un objeto, más deprisa se mueven u oscilan sus átomos o moléculas. Es decir, que, durante la infancia de nuestro universo, las partículas se movían tan deprisa que los núcleos atómicos no eran capaces de capturar los electrones que chocaban con ellos. Como resultado, el universo primigenio estaba inundado por una «sopa» de pequeñas cargas positivas y negativas.
Este detalle es relevante porque implica que cualquier rayo de luz que emitía la materia incandescente que abarrotaba el espacio en aquella época era absorbido rápidamente por las partículas con carga eléctrica de su entorno inmediato. Esa es la razón por la que no es posible observar la luz que se emitió durante los primeros cientos de miles de años de vida del universo: el espacio era totalmente opaco. Afortunadamente, eso cambió unos 370.000 años después del Big Bang, cuando la temperatura del espacio bajó de los 3.000 ºC y los núcleos atómicos de hidrógeno y helio pudieron unirse con los electrones, convirtiéndose en átomos eléctricamente neutrales que dejaban pasar la luz.
Y… Bueno… La verdad es que no sucedieron muchas más cosas durante las siguientes decenas o incluso cientos de millones de años. El universo era un lugar en continua expansión lleno de nubes de hidrógeno y helio que se enfriaban lentamente. No había estrellas que iluminasen el cielo ni planetas que le pudiesen dar algo de vidilla al espacio. Solo nubes de gas inmensas moviéndose en la más absoluta oscuridad.
Error de compilación. ¿De dónde salieron los 118 elementos químicos de los que hablabas, si el Big Bang solo produjo hidrógeno y helio?
De las estrellas, ordenador.
Estas nubes de gas primigenias no eran homogéneas, ya que contenían algunas regiones más densas en las que el campo gravitatorio era más intenso. El gas que contenían estas regiones se comenzó a colapsar bajo su propia gravedad, comprimiéndose cada vez más hasta producir densas bolas de hidrógeno y helio de millones de kilómetros de diámetro. Mientras estas masas de gas se comprimían, la temperatura y la presión de su interior incrementaron sin parar hasta que, finalmente, los átomos de hidrógeno (H) que habían quedado atrapados en sus profundidades estaban tan apiñados y se movían tan deprisa, que, cuando colisionaban, quedaban unidos y formaban un núcleo de helio (He). Esta fusión de núcleos atómicos se llama fusión nuclear y libera una cantidad de energía tremenda, aunque reconozco que el proceso no es tan simple en la vida real.
En el siguiente dibujo aparece representada la cadena protón-protón, la serie de fusiones nucleares que genera la mayor parte de la energía del Sol. En este caso, la unión de dos núcleos de hidrógeno corrientes (1H), con un único protón en su núcleo, produce un núcleo de deuterio (2H). Si el nombre de deuterio no os suena de nada, no os preocupéis: no es más que hidrógeno que es un poco más denso de lo habitual porque, además del protón solitario que lo caracteriza, su núcleo atómico contiene un neutrón.
Pues, bien, cuando un núcleo de deuterio colisiona con uno de hidrógeno, las tres partículas involucradas se unen y dan lugar a un núcleo de helio-3 (3He). Y, a su vez, la unión de dos núcleos de helio-3 genera helio-4 (4He) que nuestra estrella no puede seguir fusionando para obtener energía, ya que su interior no está lo bastante caliente. Sin embargo, la formación de 4He expulsa dos núcleos de hidrógeno que quedan libres para unirse con otros núcleos y continuar alimentando la cadena de fusión.
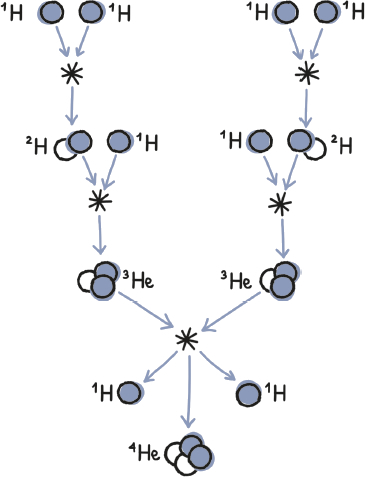
Por cierto, muchos habréis notado que, junto a 1H, 2H, 3He y 4He he colocado un número. Ese número simplemente representa la cantidad total de partículas que contiene el núcleo de cada uno de estos elementos. Estas distintas «versiones» de un mismo elemento químico que albergan una cantidad diferente de neutrones se llaman isótopos... Y hablaré de ellos con más detalle en un rato.
La cuestión es que en el centro de esas bolas de gas compactas se fusionaban millones de toneladas de hidrógeno cada segundo que generaban temperaturas del orden de decenas e incluso cientos de millones de grados. Calentadas por estas calefacciones centrales extremas, la superficie de las bolas de gas alcanzó temperaturas de decenas de miles de grados, así que comenzaron a brillar con una tonalidad incandescente blanquecina, convirtiéndose en estrellas. Por primera vez, la oscuridad insondable del espacio se vio interrumpida por un sinfín de puntos luminosos.
La mayoría de estas primeras estrellas tenían una masa decenas de veces superior a la de nuestro Sol y temperaturas interiores tan elevadas que, cuando convirtieron todo el hidrógeno de su núcleo en helio, continuaron fusionando ese helio en elementos cada vez con más protones en su núcleo, como el carbono (C), el nitrógeno (N), el oxígeno (O), el silicio (Si) y el potasio (K). Estos nuevos elementos más densos se iban hundiendo hacia el centro de las estrellas, de manera que, en el núcleo de estos astros, se acumulaba el elemento más denso producido por esta cadena de fusiones: el hierro (Fe), con 26 protones.
Este último detalle es relevante porque la fusión de los átomos de hierro absorbe energía, en lugar de liberarla. Por tanto, cuando una estrella gigante acumula mucho hierro en su núcleo, sus reacciones de fusión nuclear se detienen y la única fuerza que mantenía a raya el peso de las capas externas de la estrella desaparece. En un instante, toda la masa de la estrella se precipita hacia su núcleo a gran velocidad y el astro se comprime tanto que, de repente, todo su volumen está sometido a presiones y temperaturas lo bastante altas como para sostener reacciones de fusión nuclear. ¿El resultado? Toda la masa de la estrella se fusiona al mismo tiempo y el astro revienta como si fuese una inmensa bomba termonuclear.
Este tipo de eventos son las famosas supernovas y son tan energéticas que el brillo emitido por el estallido de una sola estrella puede llegar a competir con el de una galaxia entera.
Además de proporcionar uno de los mayores espectáculos de fuegos artificiales conocidos, las supernovas expulsan al espacio los elementos con hasta 26 protones en sus núcleos atómicos que se habían formado en el interior de la estrella. Pero, además, algunos de los átomos que salen despedidos durante estas explosiones chocan a velocidades tan altas que se fusionan en medio del espacio y producen elementos aún más pesados, con hasta 40 protones en su núcleo. De esta manera, la muerte de las primeras estrellas llenó el cosmos con elementos más pesados que el hidrógeno y el helio en pocos millones de años.
Y, para que veáis que todo esto no me lo estoy inventando, en la «Carpeta de imágenes» que he adjuntado al final de esta transmisión os he dejado una fotografía de los restos en expansión de una supernova. Se trata de la imagen 1, para ser más concretos.
La variedad química del universo no hizo más que aumentar después de esta primera y fugaz generación de estrellas gigantes. Por ejemplo, en el interior de las estrellas medianas, más longevas que las gigantes, los núcleos atómicos son capaces de crecer poco a poco a lo largo de millones de años a medida que absorben los neutrones sueltos que pululan por su entorno. Esta captura lenta de neutrones produjo elementos con entre 38 y 83 protones en su núcleo, que también acabaron esparcidos por el cosmos cuando estas estrellas agotaron su combustible y se hincharon hasta que sus capas externas se difuminaron por el espacio.
Hay que decir que existen otros eventos astronómicos que forjaron elementos con números de protones distintos. Las explosiones de estrellas enanas blancas producen elementos con entre 14 y 30 protones en su núcleo, mientras que las colisiones de estrellas de neutrones expulsan núcleos atómicos con entre 41 y 92 protones. Sea como sea, unos pocos cientos de millones de años después del Big Bang, las estrellas habían llenado el universo con los 118 elementos que conforman toda la materia que nos rodea. O, mejor dicho, con los 90 elementos que son más estables… Pero de eso hablaré con más detalle cuando explique cómo obtener combustible nuclear.
La cuestión es que, una vez en el espacio, todos estos elementos químicos forjados por las estrellas empezaron a reaccionar químicamente entre ellos y dieron lugar a una gran variedad de compuestos químicos. Dicho de otra manera: los átomos comenzaron a enlazarse a través de sus electrones y formar moléculas. O, lo que es lo mismo, grupos de átomos de uno o más elementos distintos.
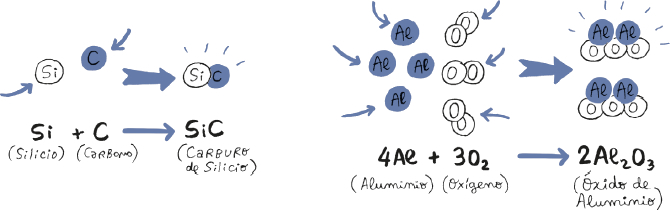
Por ejemplo, muchos átomos de silicio (Si) y de carbono (C) se unieron y formaron granos sólidos de carburo de silicio (SiC), una sustancia oscura y muy dura que, en la Tierra, se usa como abrasivo.
Error. La palabra «SiC» no está en mi diccionario.
Porque eso no es una palabra, ordenador. Es la fórmula química del carburo de silicio.
Estas fórmulas simplemente indican qué elementos contienen las moléculas de un compuesto químico y cuántos átomos albergan de cada uno de ellos. Así pues, una molécula de SiC está hecha de un átomo de silicio (Si) y otro de carbono (C). Por su parte, el óxido de aluminio (Al2O3) es otro sólido duro que se forma en el espacio y, como su fórmula indica, está hecho de moléculas que contienen dos átomos de aluminio (Al2) y tres de oxígeno (O3).
La formación de distintos compuestos químicos se representa mediante ecuaciones químicas. Sé que el nombre puede resultar intimidante, pero, en el fondo, estas ecuaciones solo representan cómo interactúan distintas cantidades de átomos y moléculas cuando entran en contacto. A la izquierda de la ecuación aparecen los elementos que reaccionan químicamente entre ellos y, a la derecha, las sustancias que producen al unirse.
En el siguiente dibujo podéis ver las reacciones químicas que dan lugar al carburo de silicio y al óxido de aluminio, junto con las uniones de átomos que representan esas ecuaciones.
No os preocupéis si este concepto no os ha quedado claro del todo ahora mismo. Durante esta transmisión mencionaré muchas reacciones químicas distintas que podréis usar para extraer los elementos que necesitéis de las sustancias que os rodean, así que tendréis ejemplos de sobra para familiarizaros con ellas.
Aproximadamente 1.000 millones de años después del Big Bang, las inmensas nubes de gas que inundaban el espacio habían acumulado una cantidad considerable de granos de polvo sólido compuestos tanto por los elementos pesados forjados por las estrellas como por los compuestos químicos producidos de sus reacciones. Algunos de esos granos estaban hechos de carburos, óxidos y otros compuestos que asociamos al material «rocoso», otros eran diminutas masas metálicas de hierro y níquel y el resto eran partículas congeladas de distintas sustancias volátiles, como el agua, el metano, el nitrógeno y el amoniaco.
A partir de este momento, cuando una nube polvorienta de gas se colapsaba bajo su propio peso y producía una estrella nueva, los incontables granos de polvo que quedaban atrapados dando vueltas alrededor del astro chocaban entre ellos y se unían, formando objetos sólidos cada vez más grandes, que, a su vez, atraían más material de su entorno gracias a su mayor fuerza gravitatoria y crecían aún más.
Este bucle terminó dando lugar a cuerpos celestes compuestos por una mezcla de roca, metal y hielo de miles de kilómetros de diámetro. Habían nacido los primeros protoplanetas (imagen 2 de la «Carpeta de imágenes»). Y, a lo largo de millones de años, la colisión entre protoplanetas acabaría formando objetos aún mayores: los planetas.
Hablaré de los procesos de formación planetaria con más detalle cuando explique cómo extraer metales de las rocas. Lo que nos interesa ahora mismo es que los planetas están hechos de todos esos elementos que se formaron en el interior de las estrellas.
Pero, ojo, porque no todos esos elementos químicos son igual de abundantes en nuestro entorno. Por ejemplo, las rocas que componen la corteza terrestre están hechas de un 46,6 % de oxígeno (O), un 27,7 % de silicio (Si), un 8,1 % de aluminio (Al), un 5 % de hierro (Fe), un 3,6 % de calcio (Ca) y un 2,8 % de sodio (Na). En cambio, el elemento más escaso de la corteza terrestre, el iridio (Ir), se encuentra en concentraciones de alrededor de 50 partes por mil millones.
Entonces, sobrevivir en un mundo hostil es sencillo: basta por deambular por el terreno hasta encontrar el elemento que necesitas. No entiendo por qué os quejáis tanto, humanos.
Parece mentira que lleves cuatro años viéndonos entrar y salir de la base cargados de piedras y haciendo todo tipo de experimentos con ellas, ordenador.
Ojalá fuese tan sencillo, pero los elementos químicos casi nunca se encuentran en estado puro en ningún planeta rocoso porque tienden a reaccionar químicamente y combinarse entre ellos durante los procesos que dan lugar a las rocas. Por ejemplo, cuando una masa de magma o de lava se enfría, los átomos de los diferentes elementos que contiene se empiezan a enlazar y a producir moléculas de distintas sustancias, como el dióxido de silicio (SiO2), el silicato de aluminio y potasio (KAlSi3O8) o el óxido ferroso-férrico (Fe3O4). Pero los átomos no se enlazan de cualquier manera. En su lugar, cada elemento tiende a unirse con los demás siguiendo un patrón muy concreto que depende de cómo estén ordenados los electrones alrededor de los núcleos de los átomos de cada uno, entre otras cosas.
Esta «unión ordenada» de átomos da lugar a unas masas sólidas llamadas cristales. Y, a su vez, los cristales que se forman de manera natural mediante procesos geológicos son los famosos minerales. De hecho, el SiO2 cristalizado es el mineral conocido como cuarzo, el KAlSi3O8 es la ortoclasa y el Fe3O4 es la magnetita.
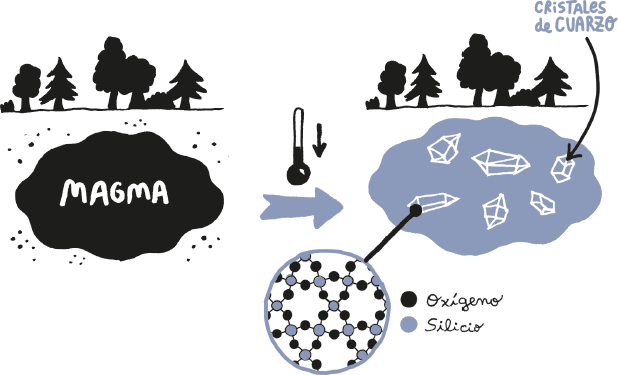
Lo que quiero decir con esto es que todas esas rocas aparentemente inservibles que os rodean están hechas de miles o millones de cristales de muchos minerales diferentes. O, lo que es lo mismo, de incontables granos minúsculos de una gran variedad de compuestos químicos cristalizados.
Y aquí viene lo importante, náufragos espaciales: el truco para sobrevivir en el espacio es aprender a reconocer los minerales de vuestro entorno que contienen compuestos químicos y elementos que os resulten útiles. Por ejemplo, en la imagen 3 de la «Carpeta de imágenes» os he dejado una foto de una roca que mi abuelo, Ciencia de Sofá, encontró en una mina de plomo abandonada.
¿Y para qué guardas una fotografía de una piedra que encontró otro humano hace medio sigl…?
Tu mente robótica nunca lo entendería, ordenador.
La cuestión es que, a primera vista, esto parece una simple piedra corriente. Pero un explorador espacial experimentado no ve una roca, sino una mezcla de distintas sustancias potencialmente valiosas.
Como veis, la roca tiene unas franjas oscuras. Eso son cristales de un mineral llamado galena que está hecho de sulfuro de plomo (PbS) y es una de las principales fuentes de las que se extrae este metal. El plomo (Pb) es un metal muy denso y blando que se funde a solo 327 ºC, así que se puede convertir con facilidad en láminas con las que podríais revestir vuestra base interplanetaria para incrementar la protección que ofrece ante la radiación espacial.
El proceso de extracción del plomo emite un gas llamado dióxido de azufre (SO2) que resulta tóxico. Pero, si tenéis el equipo adecuado, podréis utilizar este gas para producir ácido sulfúrico (H2SO4), una sustancia con la que podréis sintetizar muchos otros compuestos útiles (como medicinas, fertilizantes o pigmentos) o fabricar baterías simples para almacenar energía eléctrica.
Las partes más blanquecinas de la roca anterior son barita, un mineral muy denso hecho de sulfato de bario (BaSO4) que se puede utilizar como agente de contraste para radiografías abdominales o para producir pintura blanca. Esta última aplicación os puede resultar de utilidad si os habéis quedado atrapados en un mundo muy caluroso, ya que, si pintáis el exterior de vuestra base con pintura blanca, las paredes absorberán menos radiación solar y no tendréis que utilizar tanta energía para mantener el interior a una temperatura cómoda.
Por otro lado, el sulfato de bario también se puede convertir en carbonato de bario (BaCO3), un polvo blanco altamente tóxico que, en la Tierra, se utiliza como raticida.
Compuesto innecesario. Mis sensores no han detectado señales de roedores en esta base. Los protocolos de cualquier misión interplanetaria deberían haber evitado la introducción de organismos terrícolas indeseados en la base.
Te recuerdo que nos ha traído aquí una empresa de patatas fritas y que tenemos un cargamento de media tonelada de valiosas e insípidas KrujiChips en la despensa.
Entendido. Seguiré monitorizando la actividad biológica.
Gracias, ordenador.
La muestra de la imagen también contiene un poco de calcita, un mineral blanco muy común que está hecho de carbonato de calcio (CaCO3). Este compuesto químico purificado se utiliza como remedio contra la acidez estomacal, pero, si se calienta a unos 800 ºC durante unas horas, se descompone en óxido de calcio (CaO) y dióxido de carbono (CO2). El óxido de calcio es la sustancia conocida como cal y sirve, entre otras cosas, para producir hidróxido de calcio (Ca(OH)2), que se puede usar para desinfectar el agua.
Como veis, una piedra «corriente» sin ningún tipo de valor ni utilidad aparente puede contener una gran variedad de sustancias útiles. Por tanto, si habéis acabado varados en un planeta inhóspito en el que solo hay polvo y roca hasta donde abarca la vista, no os asustéis excesivamente. No deberíais pensar en todo ese paisaje desolado que os rodea como un montón de piedras inútiles, sino como un gigantesco laboratorio equipado con todo tipo de compuestos químicos que os pueden resultar útiles para sobrevivir. Solo que, en lugar de estar purificados, envasados, etiquetados y ordenados en estanterías, los compuestos químicos de vuestro laboratorio natural están todos desperdigados por el suelo y mezclados dentro de esos mazacotes sólidos que llamamos rocas.
La buena noticia es que vuestra base interplanetaria debería tener una fuente de energía y el equipo necesario para extraer de las rocas todos esos compuestos y elementos que los seres humanos necesitamos para sobrevivir. Si a eso añadimos un poco de perseverancia, suerte y algunas nociones básicas de química, no os resultará difícil manteneros vivos hasta que consigáis reunir los recursos necesarios para escapar hacia un mundo más acogedor en el que la humanidad pueda prosperar.