Proposición 1
Soporte y anatomía funcional del corazón: el miocardio helicoidal
1. Aspectos filogenéticos del aparato circulatorio
El aparato circulatorio de los gusanos (anélidos, nemertinos) está constituido por un sistema cerrado provisto de dos lechos capilares (pulmonar y sistémico) y dos hemicírculos, denominados arterial y venoso. En este sistema de circulación único la sangre se impulsa en forma peristáltica (expresión y succión) ya que carece del impulso de un corazón (figura 1 A).
En la evolución hacia los peces se observa la aparición, en el hemicírculo venoso, de un corazón primitivo constituido por tres dilataciones denominadas seno venoso, aurícula y ventrículo, ubicadas en forma consecutiva. Si bien el circuito continúa siendo único, se produce la aparición de una cámara impulsora (ventrículo) con posibilidad de incrementar las presiones intravasculares (figura 1 B).
En el desarrollo biológico siguiente, constituido por anfibios y reptiles, se producen modificaciones mucho más prominentes. En ese momento evolutivo se distinguen dos circuitos, el sistémico y el respiratorio, mientras que el corazón presenta dos aurículas y un ventrículo, este último generado por un incipiente bucle en el circuito arterial (171, 173, 174). La torsión del tubo circulatorio sobre sí mismo, en un segmento del hemicírculo arterial (circuito sistémico), constituye un paso trascendental en el desarrollo evolutivo de las especies (figura 1 C). Tras este bucle se van a conformar las cámaras ventriculares futuras, morfología que se comprende bien al desplegar la continuidad muscular que ostenta el miocardio.
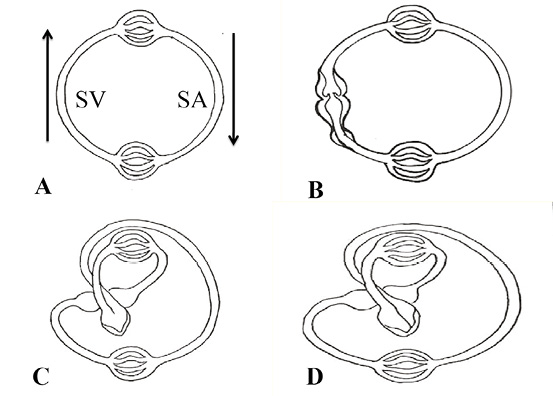
Figura 1. Filogenia del sistema circulatorio. SV: segmento venoso. SA: segmento arterial. Las flechas señalan el sentido de la circulación. A: gusanos. B: peces; se puede observar las tres dilataciones del segmento venoso (seno venoso, aurícula y ventrículo). C: anfibios y reptiles: se inicia, en el segmento arterial, el bucle que dará origen a ambos ventrículos y que se completa definitivamente en D (aves y mamíferos).
El desarrollo del aparato circulatorio en aves y mamíferos permite distinguir dos aurículas y dos ventrículos. En el hemicírculo arterial se completa el bucle iniciado en los anfibios y reptiles con conformación de un sistema miocárdico helicoidal. En ese segmento, en el bucle instaurado en el tubo arterial primitivo, el efecto producido por una hendidura longitudinal da lugar a canales que constituirán los dos ventrículos (figura 1 D) (195, 209). En los orígenes de la arteria pulmonar y de la aorta de los mamíferos se hallan evidencias que se han relacionado con esa hendidura evolutiva producida en el tramo arterial (171). Las mismas corresponderían al espacio entre los trígonos en la parte posterior de la aorta en donde encaja la valva posterior de la mitral (figura 71), mientras que en la pulmonar estaría representado por la división del segmento paraendocárdico (perteneciente al segmento derecho, inicio del miocardio) en dos bandas: pulmonar y del tabique (figura 70). Ambas evidencias guardan la forma de una V invertida, denunciando el inicio de la hendidura que llevó a la constitución del miocardio continuo, y que Torrent Guasp denominó en su investigación con la denominación “banda” (174). Este proceso consigue proveer dos cámaras para impulsar la sangre a la salida del bucle hacia el lecho sistémico, con una energía suficiente y alta velocidad (en el humano alcanza 200 cm/s) a través del ventrículo izquierdo, y a la arteria pulmonar por medio del ventrículo derecho con el desarrollo de presiones del 20% de las sistémicas. Este ardid evolutivo permitió el desarrollo necesario para generar una presión intravascular en el segmento del circuito arterial que impulsase el fluido a una velocidad para lograr irrigar todo el organismo.
Si retrocedemos hacia el estadio primario en la evolución del sistema circulatorio se aprecian los hitos filogenéticos de las distintas especies. Las aurículas pertenecen al segmento venoso y los ventrículos al arterial. Una incurvación subsiguiente más pronunciada del segmento arterial permite poner en contacto las aurículas con los ventrículos respectivos. De esta manera, la disposición en un plano horizontal de ambas aurículas (cámaras originadas en el hemicírculo venoso) se adosa al plano del componente ventricular (hemicírculo arterial).
Definiendo esta audaz idea de Torrent Guasp, en el desarrollo de peces a mamíferos, la aurícula única y el ventrículo único de los primeros se convierten en aurícula derecha e izquierda en los segundos. A su vez los ventrículos provienen en los mamíferos del incipiente enroscamiento del segmento arterial correspondiente al circuito arterial de los anfibios y reptiles.
En la recapitulación que la ontogenia hace de la filogenia (180) puede observarse en el embrión humano la flexión del tubo cardíaco, el que primeramente se lateraliza y luego se tuerce en espiral, rememorando el proceso evolutivo (figura 2). De esta manera el asa bulboventricular se incurva hacia la derecha y adelante. Este movimiento es posible por la desaparición del mesocardio dorsal que deja al corazón totalmente libre y péndulo en el tórax, lo cual le permitirá ejercer las funciones de torsión y detorsión para completar el ciclo cardíaco. Luego veremos la necesidad de que el miocardio quede sujeto a un punto de apoyo, que hemos hallado y denominado “fulcro cardíaco”, para obtener la potencia necesaria en estos movimientos. Esta flexión del tubo cardíaco produce dos consecuencias: 1) la conformación del borde externo izquierdo del corazón que se hallaba recto y de esta manera queda interrumpido por una hendidura denominada surco bulboventricular, y 2) simultáneamente se produce una torsión responsable de los abultamientos del tronco y del cono.
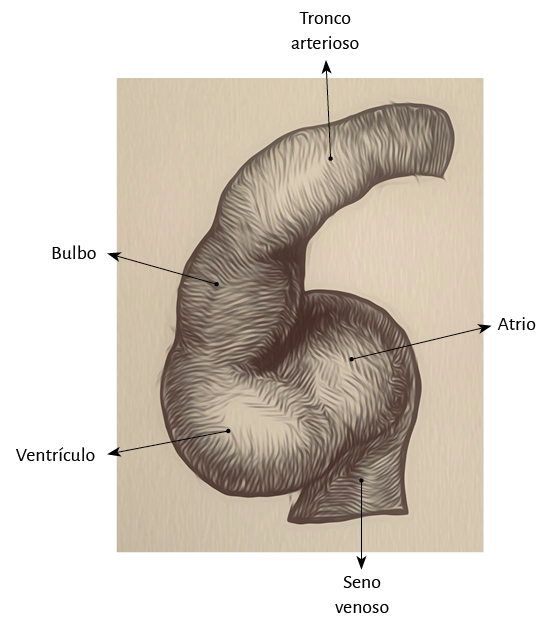
Figura 2. Flexión del tubo cardíaco en embrión humano.
El concepto de trayecto circulatorio lineal imposibilitó la comprensión fidedigna de la unidad anatómica helicoidal. Si bien esta estructura secuencial conforma las cámaras cardíacas donde la sangre circula, la acción dinámica la determina el miocardio helicoidal (120). Del trayecto sanguíneo por las cámaras auriculares y ventriculares se ha hecho históricamente una interpretación que no guarda correlación entre estructura y función. La acción de torsión miocárdica permite generar una presión intraventricular con menor gasto energético y mayor efectividad en el trabajo. Una propulsión lineal por un tubo circulatorio no tendría este efecto. En última instancia, la dinámica miocárdica es el motor de la circulación, debiéndose además considerar las potenciales consecuencias de las fuerzas biomecánicas generadas por el movimiento helicoidal del flujo intracardíaco en la modulación de la morfogénesis cardíaca durante el período embrionario (230).
Esta situación, avalada por la anatomía investigada y en estricta correlación con la función cardíaca, establece una organización helicoidal miocárdica muy distinta del concepto de unidad auriculoventricular que imposibilitó un correcto conocimiento de la fisiología cardíaca. La disposición horizontal de las aurículas (cámaras de dependencia del hemicírculo venoso) se adosó al componente muscular ventricular (cámaras de dependencia del hemicírculo arterial) en donde reside la succión y el impulso eyectivo para producir el ciclo cardíaco y el movimiento sanguíneo.
En realidad, la aurícula y el ventrículo de los peces pasan a ser la aurícula derecha y aurícula izquierda en los mamíferos. Las aurículas actuarían como cámaras compensatorias de volumen impidiendo sobrecargar los ventrículos. Absorben, con la deformidad de sus paredes, los golpes de ariete producidos por el cierre repentino de las válvulas ventriculares. Ambas aurículas representan vestigios estratégicos en la evolución del primitivo tubo circulatorio de los peces
Es necesario considerar el tracto venoso, el ventrículo derecho y la arteria pulmonar como pertenecientes al sistema venoso; y a las venas pulmonares, ventrículo izquierdo y a las arterias como integrantes del sistema arterial (figura 3). Los lechos capilares sistémicos y pulmonares son los que conectan a ambos sistemas. Por lo tanto, las bombas y sus conductos pertenecen a un sistema integrado.
El ventrículo derecho es una cámara abocada a la impulsión venosa del circuito, pero en el marco de las funciones energéticas integradas del corazón, de succión y expulsión, su papel es complementario en la circulación sistémica, ya que corresponde fundamentalmente al ventrículo izquierdo la succión del volumen sanguíneo y su expulsión para irrigar el organismo. De hecho, la salida de volumen del ventrículo izquierdo es siempre aproximadamente igual a la del ventrículo derecho, pero los ventrículos izquierdo y derecho no tienen la misma capacidad energética. Derivado de la evolución del sistema circulatorio es factible aquilatar que el ventrículo izquierdo es el verdadero motor de la circulación, en el cual la succión protodiastólica juega un papel fundamental. Hemos interpretado esta situación en experiencias realizadas en animales anulando el ventrículo derecho (Proposición 3) (208).
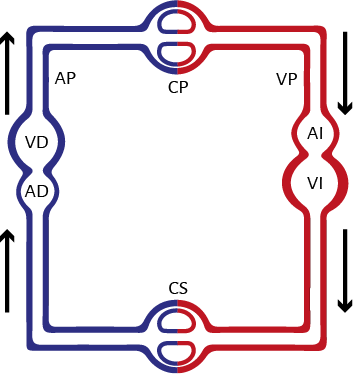
Figura 3. Sistema circulatorio de los mamíferos. AP: arteria pulmonar; CP: capilares pulmonares; VP: vena pulmonar; VD: ventrículo derecho; VI: ventrículo izquierdo; AD: aurícula derecha; AI: aurícula izquierda; CS: capilares sistémicos.
En resumen, el tubo circulatorio de los anélidos funciona en su progresión contráctil con un mecanismo de peristalsis. La propulsión a su largo conserva el patrón de la transmisión longitudinal pero, luego del bucle que sufre el tubo cardíaco en los mamíferos y en las aves, se agrega la transmisión transversal del impulso (Proposición 2) que permite que ambas bandeletas del miocardio (figura 7) tengan un movimiento de hélix indispensable para producir los movimientos concatenados de torsión-acortamiento en la sístole y de detorsión-alargamiento en las fase de succión subsiguiente. Tanto la torsión como la detorsión ventricular generan las fuerzas necesarias para lograr la impulsión del volumen cardíaco como asimismo la succión, respectivamente. La torsión permite la expulsión de la sangre ventricular a una velocidad de 200 cm/s, mientras que la detorsión genera la caída de la presión intraventricular, con el fin de lograr ingresar al ventrículo izquierdo el 80% del volumen en el 20% del tiempo diastólico.
2. Miocardio continuo
La anatomía tradicional del corazón consideró que la estructura muscular que conformaba el miocardio era homogénea y compacta. Debido a este concepto se lo describió habitualmente con una superficie externa y otra interna delimitando una masa muscular sólida y uniforme, que se abría y cerraba en bloque en sístole y diástole, respectivamente. Andrés Vesalio en su obra De humanis corporis fabrica (1543), se refería a la dificultad en discernir las capas que componen el miocardio. Expresaba textualmente: “Sea cual fuese la manera en que realices la disección de la carne del corazón, tanto si está cruda como cocida […] a duras penas puedes arrancar una porción de un solo tipo de fibra, porque tienen direcciones múltiples y distintas, sobre todo transversales”. A esta situación se refería también, más de tres siglos después, J. B. Pettigrew (1864): “De la complejidad de la disposición no necesito hablar más que Vesalio, Haller y De Blainville, todos confesaron su incapacidad para descifrarla” (129, 130, 185).
Esta estructura anatómica se hallaba en relación con lo manifestado por William Harvey en su magno libro Exercitatio anatomica de motu cordis et sanguinis in animalibus (1628) cuando establecía que “el corazón se cierra y abre como un puño” (185). La vigencia de este principio nunca consideró el análisis que hiciese poco tiempo después, en 1669, Richard Lower en su Tractatus de corde: item motu et colore sanguini, et chyli in eum transitu (6), donde consideraba que el miocardio estaba compuesto por dos músculos espiralados y que su expulsión sanguínea era similar a “wringing of a linean cloth to squeeze out the water” (“estrujar un paño de lino para exprimir el agua”) (50).
Este último concepto sin modificaciones se repetiría esporádicamente con Sénac (1749) (149), Wolf (1792), Gerdy (1823) (6) y Weber (1831) (223). Posteriormente MacCallum (1900) (96), Mall (1911) (101) y Lev (1956) (89) volverían sobre lo relatado por Lower (171). Recién Streeter (161-165) entre 1966 y 1979, a la luz de la estructura miocárdica que le fue referida por Torrent Guasp (207), se acercaría a los lineamientos actuales. Más allá de estos aportes, el poder y el prestigio ostentado por Harvey relegó una certeza anatomofuncional que recién se impuso en estos tiempos a través fundamentalmente de los estudios anatómicos, histológicos, la electrofisiología y la incorporación de imágenes con la ecocardiografía y la resonancia magnética cardíaca (112, 209, 221).
A la luz de investigaciones últimas, la concepción estructural clásica no justifica la mecánica cardíaca, por lo tanto es imprescindible poder vislumbrar la verdadera anatomía ventricular, entendiendo que la comprensión de la estructura lleva a entender la función. Históricamente muy poca importancia se le atribuyó a la disposición espacial de los trayectos musculares que componen el miocardio (35), si bien R. F. Shaner en 1923 relataba que “el miocardio está constituido por dos músculos aplanados en forma de 8 […] Dichos músculos se enrollan en dirección opuesta en sístole, vaciando su contenido” (153).
A partir de 1970 el español Francisco Torrent Guasp (9, 171-177, 207) define la anatomía del corazón adaptada a la realidad fisiológica. Esta situación de estudio tiene correlación con una estructura cardíaca que presenta características notables: la de ser una bomba aspirante-impelente de un tamaño equivalente a un puño humano y un peso promedio de 270 gr que impulsa de 4 a 6 litros/minuto a una velocidad de 200 cm/s; tener un consumo de solo 10 vatios; trabajar en continuidad durante ochenta años sin mantenimiento y casi sin ruido. Su tarea es equivalente a extraer desde 1 m de profundidad 1 tonelada de agua diaria con una eficiencia mecánica (relación trabajo/energía) del 50%, no alcanzada por las máquinas construidas por el hombre, las cuales llegan al 30%. Su eficacia permite expulsar el 70% del contenido ventricular izquierdo con solo 12% de acortamiento en su unidad contráctil, el sarcómero.
Torrent Guasp demostró con su investigación anatómica artesanal desde el pueblo de Denia (España) donde ejercía de médico, tras múltiples disecciones en corazones de distintas especies incluida la humana, que el miocardio ventricular está constituido por un conjunto de fibras musculares retorcidas sobre sí mismas asemejando una cuerda (modelo de la cuerda) (figuras 4 a 7), aplanada lateralmente a modo de una “banda”, por lo cual definió con esta palabra al miocardio. Esta, al dar dos vueltas en espiral, define un helicoide que delimita los dos ventrículos y conforma su funcionalidad. Esta estructura topográfica se halla avalada por el proceso evolutivo que sucede desde el primitivo tubo circulatorio de los anélidos hasta los mamíferos en cuyo circuito arterial sucede un bucle o doblez, que se enrosca sobre sí mismo, para constituir las dos cámaras ventriculares (ver apartado 1 de esta Proposición: “Aspectos filogenéticos del aparato circulatorio”). La luz del tubo primario establece una comunicación secundaria entre ambas cámaras adyacentes que quedan conformadas (ventrículos) por el bucle, dando por supuesto que donde se produce la interconexión debió hendirse a todo lo largo para lograr este propósito. La perspectiva tridimensional es fundamental para entender la interacción entre anatomía y función, ya que si pretendemos analizar el movimiento de las fibras miocárdicas a partir de su disposición visualizada en cortes histológicos bidimensionales no llegaremos a ninguna conclusión efectiva.
En el concepto del desarrollo de las ideas sobre la conformación espacial del miocardio, Maclvear y col. (2017) (98, 99) interpretan que las paredes ventriculares se hallan estructuradas por una red intrincada tridimensional de cardiomiocitos. Este modelo en malla implica que los cardiomiocitos se dispongan con angulaciones en forma radial y longitudinal.
Figura 4. Miocardio helicoidal.
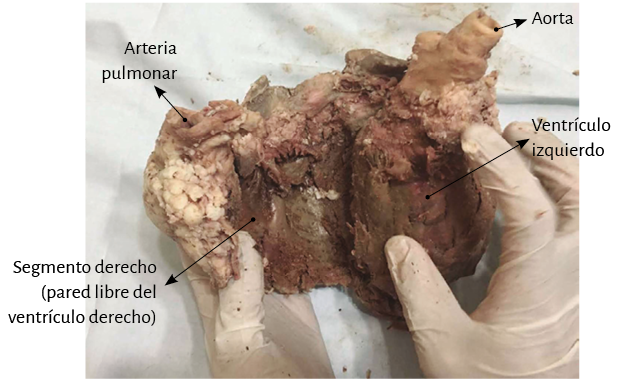
Figura 5. Inicio del desplegamiento del miocardio.

Figura 6. Miocardio en estado previo a su desplegamiento total (ver figura 25).

Figura 7. Miocardio helicoidal en el modelo de la cuerda que simplifica la estructura espacial. Se muestran los diferentes segmentos que la componen. En azul: lazada basal. En rojo: lazada apexiana.
Hasta el momento, dejando atrás la conformación clásica de la anatomía uniforme del miocardio se habían establecido, como se analizó, dos concepciones de su estructura espacial: la de banda (Torrent Guasp) y la de malla (Maclvear). A través de nuestras investigaciones anatomofuncionales consideramos que los términos de banda y de malla no son apropiados. El miocardio como músculo único y enrollado en hélice no está representado fielmente con la palabra “banda”. Este concepto no corresponde a la etimología del vocablo ni a una completa estructura espacial en espiral de su recorrido donde está obligado a superponer los segmentos. Quizá esta nomenclatura haya sido poco afortunada limitando la real comprensión de los trabajos de Torrent Guasp, ya que el vocablo “banda” se define en carácter de una tira alargada que va de extremo a extremo, que se distingue de la superficie en que aparece con límites bien definidos y sin asumir la integridad de la estructura que la soporta. Solo representa una parte de la estructura, situación que no se produce en el miocardio, pues el músculo que lo conforma es un todo, una pieza íntegra.
Asimismo, hallamos que el miocardio no se dispone como una malla. Esta denominación no guarda relación con la anatomía funcional del corazón (214-217). El concepto que se ha esgrimido de malla fue elaborado sin asimilar que la conformación helicoidal de la continuidad miocárdica superpone sus segmentos para lograr la topografía funcional. Hay criterios, como el desplegamiento anatómico del miocardio, que avalan el concepto de secuencia del miocardio como un músculo único, continuo, espiralado y con inserción en sus extremos (ver apartado 5 de esta Proposición: “Disección anatómica del miocardio”). Lo mismo sucede con la ecocardiografía y la resonancia magnética cardíaca al demostrar los movimientos contrapuestos de los segmentos sobrepuestos.
Con lo expresado hallamos que la disposición espacial y el movimiento de rotación de las fibras ventriculares, tanto a nivel de la base como de la región apical, hallan correspondencia con un miocardio helicoidal, fruto de la convergencia entre evolución, estructura y función. Sin embargo, esta anatomía que permite desenrollar el corazón y llevarlo a conformar un músculo continuo no fue considerada con criterios de validez por algunos grupos académicos, luego de su descripción original.
Ante la crítica o indiferencia que ha suscitado desplegar el miocardio helicoidal, por falta de información de la técnica sobre la disección anatómica, actualmente podemos obtener la confirmación de ella a través de lo siguiente:
- La investigación anatómica e histológica del corazón (195, 209).
- El concepto evolutivo que surge desde la filogenia.
- Los nuevos procedimientos de imágenes obtenidas con secuencias de resonancia magnética cardíaca por tensor de difusión (26, 36, 131, 227).
- La ecocardiografía (91, 111, 112).
- Los estudios electrofisiológicos llevados a cabo con el mapeo electroanatómico tridimensional (192-198, 201-203).
Con relación a la dificultad esgrimida en la disección del miocardio, la cual es más aparente que real (195), debemos considerar que nacido el miocardio como un bucle en el hemicírculo arterial de los anfibios y reptiles, con el fin de adaptarse a la fisiología mecánica de la vida aérea, los haces musculares se fueron adhiriendo con intensidad en sus superficies de contacto volviendo un tanto dificultoso lograr los planos de clivaje necesarios para su disección anatómica. El fin evolutivo fue obtener una estructura hemodinámica con la suficiente solidez y energía para generar la succión y la expulsión del volumen sanguíneo cardíaco que abasteciese a todo el organismo con el fin de torsionar y detorsionar el músculo cardíaco sin perder su contextura. Es así que todo intento de estudiar un segmento anatómico del resto del miocárdico en la disección necesita no apartarse de los ejes por donde transcurre la orientación y los planos determinados de la disposición helicoidal continua. Esta imposibilidad, como citamos previamente, era el comentario de Andrés Vesalio en 1543. En síntesis, actualmente existen suficientes datos para comprender que el miocardio es un músculo continuo, único, espiralado y sujeto a una inserción, situación que iremos comprobando a lo largo de esta Proposición.
La disección del miocardio halla una estructura con planos de separación bien definidos donde se suceden en continuidad los segmentos en disposición helicoidal, lo que permite ejecutar los movimientos fisiológicos sucesivos y concatenados de estrechamiento, acortamiento-torsión, alargamiento-detorsión y ensanchamiento del corazón, consecuencia de la propagación del estímulo eléctrico por sus trayectos musculares (199).
No pueden considerarse a las fibras musculares que conforman al miocardio como entidades absolutamente independientes dentro de un determinado espacio. A pesar de lo intrincado que puedan ser los manojos de fibras con apariencias poligonales, que reciben y originan fibras colaterales, queda bien determinado un trayecto predominante de las fibras centrales con planos de deslizamiento que conforman, en conjunto, al miocardio en hélice. No se debe atenuar el concepto de que el miocardio constituye un continuo espiralado en sus fibras, resultado de la conformación helicoidal de sus haces musculares. Esta disposición implica la necesidad de generar un trabajo mecánico que disipe poca energía. Por este hecho las fibras dispuestas en capas van sesgando su dirección muy gradualmente entre ellas, con ángulos más o menos agudos, para evitar que cambios bruscos en la orientación espacial dilapiden el trabajo necesario para la función cardíaca. El abanico de fibras que se conforma reduce el estrés entre ellas (79, 164).
Esta situación que simula un ovillo de fibras le permite al miocardio ventricular izquierdo actuar como una cadena continua de transmisión al adoptar las fibras epicárdicas y las endocárdicas direcciones oblicuas, pero contrarias en su sentido, lo que les permite ejecutar movimientos opuestos entre ellas. El ángulo de ingreso del plano endocárdico y epicárdico, con relación a las fibras transversales, es de unos 60º. La orientación de las fibras determina la función y, así, la fracción de eyección es del 60% cuando las fibras helicoidales normales se contraen y cae al 30% si se acortan solamente las fibras transversas. Esto último sucede al dilatarse el ventrículo izquierdo en la remodelación cardíaca y perder las fibras su orientación oblicua para volverse horizontales con pérdida de la eficiencia muscular y mecánica. Además del cambio de orientación de las fibras, también se produce una merma en su acortamiento, lo que contribuye a las disminución de la fracción de eyección.
De esta forma debe comprenderse que desde las fibras superficiales hacia las profundas se genera un cambio de orientación gradual que componen los distintos segmentos de la continuidad miocárdica. A medida que se progresa de la base al ápex ventricular la cantidad de fibras horizontales disminuye con relación a las oblicuas, demostrando que el corazón se halla organizado en una espiral muscular continua (figura 8). La actividad mecánica ventricular debe ser heterogénea durante la diástole con gradientes de relajación subendocárdico-subepicárdico. En sístole, las capas musculares del miocardio continuo muestran una torsión pronunciada y opuesta en su dirección en el subendocardio, con relación al subepicardio, mientras que en el ápex la rotación de las fibras subepicárdicas adquieren mayor importancia.
Más allá de esta complejidad anisotrópica en la continuidad miocárdica, se debe establecer el concepto de trayectorias lineales y laminares (45). El sincicio corresponde exclusivamente al conjunto de las células miocárdicas que forman un haz y no a la reunión entre ellas. Hay en la estructura miocárdica una integración funcional desde las células, el conectivo intercelular y las fibras musculares hasta los aspectos macroscópicos donde el sentido de los movimientos depende de sus propiedades en determinado tiempo del ciclo cardíaco. Haces y bandas musculares miocárdicas en esencia conforman un eje maestro helicoidal que es de estricta necesidad dinámica, los cuales derivan del desarrollo filogenético (18-20). La estructura muscular espacial adoptada por el miocardio helicoidal tiene una doble función: 1) delimitar las cavidades ventriculares, y 2) cumplir la acción de succión, reservorio e impulsión en su condición de bomba cardíaca.
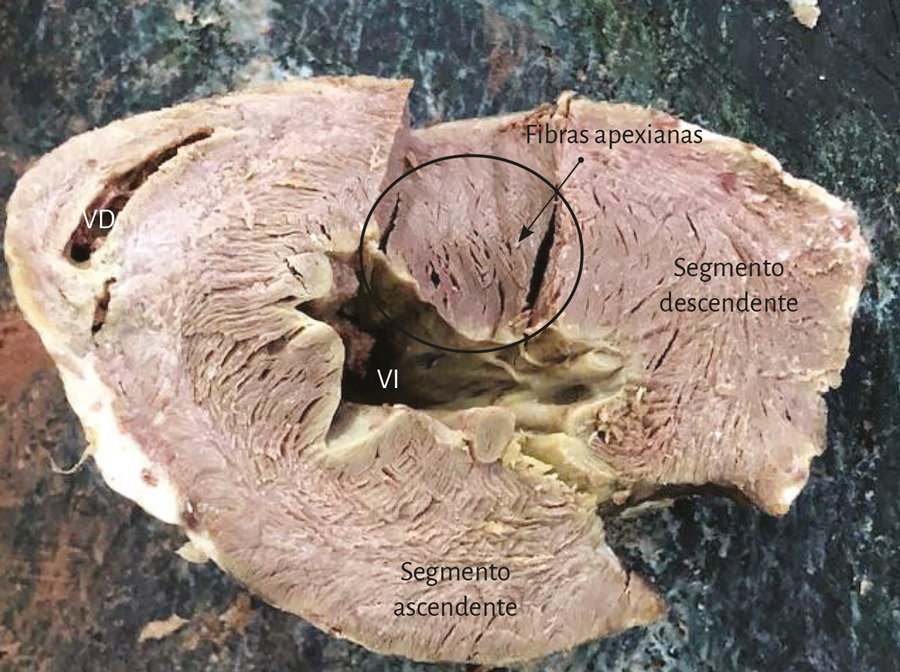
Figura 8. Fibras espiraladas. Los segmentos ascendente y descendente se ven en un corte transversal del corazón, cerca del ápex. Puede apreciarse cómo las fibras toman una conformación en espiral. Las fibras subendocárdicas tienen una dirección de hélice dextrógira. Las fibras subepicárdicas, en un sentido opuesto en un ángulo de 60º, representan una hélice levógira (corazón bovino). VD: ventrículo derecho. VI: ventrículo izquierdo.
3. Arquitectura del miocardio
Ventrículo izquierdo. Con relación al ventrículo izquierdo, el ápex pertenece íntegro a él. En la parte distal de este ventrículo, denominada apexiana, se encuentra una capa muscular de trayecto en espiral que se desplaza desde la periferia hacia el centro, la cual sufre una torsión que hace que las fibras subepicárdicas se vuelvan subendocárdicas, superpuestas como las tejas en un techo (figura 8). De esta forma el extremo distal del ventrículo izquierdo (figura 9), el ápex, contornea un conducto virtual que no posee prácticamente plano muscular en su vértice final, hallándose tapizado por el endocardio en su interior y por el epicardio externamente, sin prácticamente músculo intermedio (figura 13). Lo fundamental a considerar es que en la zona apexiana las fibras sufren un movimiento en remolino helicoidal, con disposición esfinteriana al convertirse de subepicárdicas en subendocárdicas. La orientación de su trayecto corresponde al sentido de las agujas de reloj (corazón en posición anatómica, sobre su cara diafragmática, visto por el ápex) (figuras 10 y 11) (174).
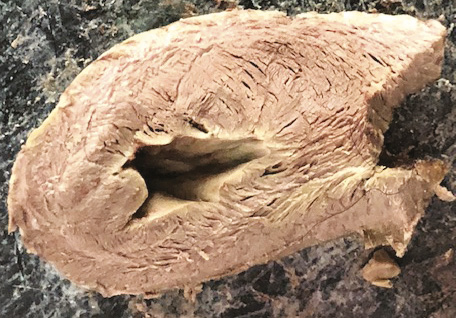
Figura 9. Apex en corazón de bóvido. Se puede observar que su contorno es absolutamente muscular y que corresponde al ventrículo izquierdo en su totalidad.
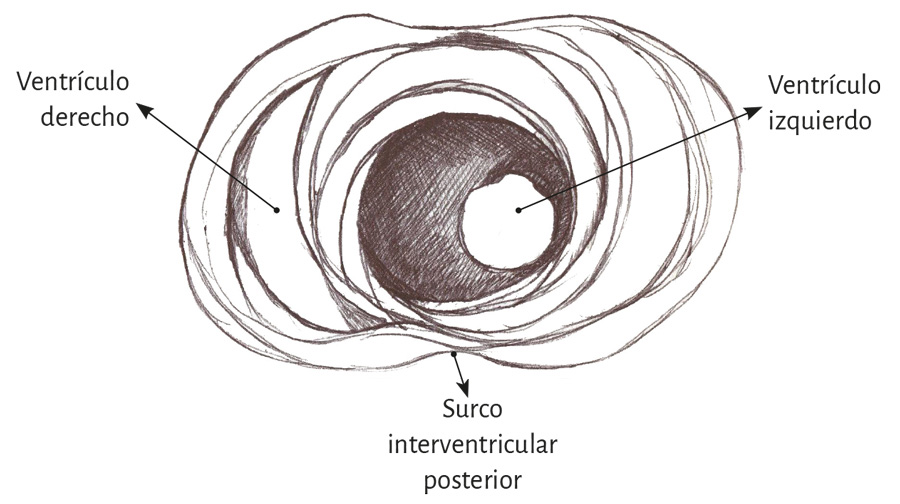
Figura 10. Ventrículos derecho e izquierdo vistos por el ápex.
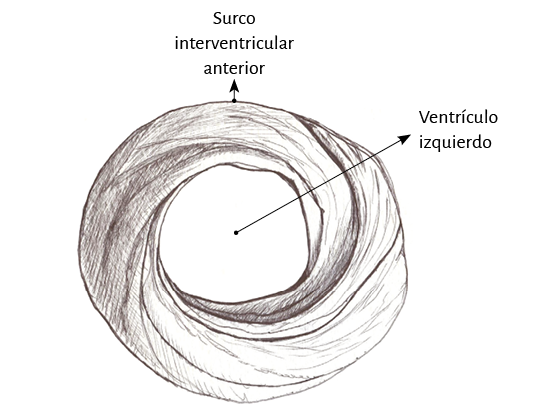
Figura 11. Capas musculares en espiral en el ápex.
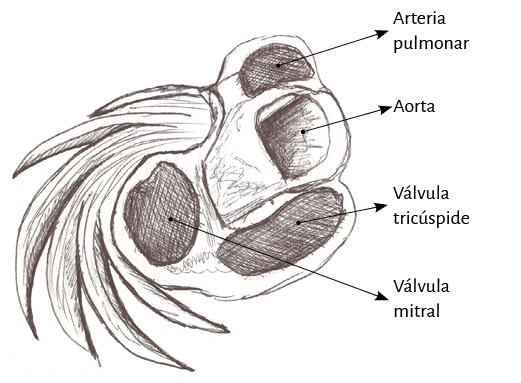
Figura 12. Tercio basal del ventrículo izquierdo. Se observan las capas musculares de la pared libre.
En la mitad basal del ventrículo izquierdo (figura 12), a nivel de su pared libre, el ordenamiento de las fibras es similar a lo mencionado en la mitad apexiana. Se observa una capa muscular de trayectoria en espiral que avanza de la periferia al centro y cuyas fibras se van posicionando desde afuera hacia adentro (de regiones paraepicárdicas a paraendocárdicas). A este nivel la orientación que adoptan es opuesta al ápex. Siguen un trayecto en sentido inverso a las agujas de reloj (corazón en posición anatómica, sobre su cara diafragmática, visto por el ápex). Esta disposición de la capa muscular en su giro delimita una cavidad que en la base del ventrículo es real y no virtual, como sucede en el ápex. La forma del ventrículo izquierdo es una consecuencia de la orientación de sus fibras.
El ápex cardíaco
Debe considerarse el ápex como un túnel con borde muscular en todo su anillo (figura 9), mientras que en la base ventricular este anillo tiene dos partes: una corresponde a la pared libre del ventrículo izquierdo y la otra al septum interventricular (figura 12). Por otra parte las fibras más superficiales de la base contactan, sin insertarse, en el anillo fibroso mitral, situación ausente a nivel del ápex. La diferencia fundamental a nivel funcional que debemos observar entre ambas regiones, basal y apexiana, es el desplazamiento opuesto que tienen sus fibras. Esta particularidad permite un trabajo de torsión miocárdica para lograr la expulsión sanguínea desde el corazón y la detorsión subsiguiente, que genera la succión y el lleno diastólico. Debe efectuarse en este punto una aclaración entre torsión y giro, de acuerdo con los conceptos esgrimidos en la Proposición 4. En realidad la torsión se relaciona con el giro dividido por la distancia base-ápex.
El ápex –conformado únicamente por el ventrículo izquierdo– presenta características diferentes de lo explicitado por el proceso histórico. Clásicamente se lo consideró de naturaleza muscular, similar al resto del miocardio. Esta interpretación no se correlaciona con la definición del miocardio continuo actual, el cual al girar a nivel del fondo de saco apexiano, por la geometría en espiral que adopta, carece prácticamente de músculo, el que presenta un adelgazamiento del 90% con relación al miocardio contiguo a él. Este brusco cambio de dirección implica que la continuidad del segmento descendente se transforme en ascendente y representa la cabal prueba del carácter helicoidal del miocardio (figuras 4 y 8). En el ápex hay fibras remanentes del remolino muscular que se deslizan entre su borde circular. Es un delgado refuerzo. Lo hemos visto en el miocardio de los bovinos y de los humanos, en este caso tanto en el embrión como en el adulto.
En este desplazamiento helicoidal de sus fibras apicales, que de subepicárdicas se transforman en subendocárdicas, se constituye una espiral de capas musculares circularmente imbricadas con disposición esfinteriana, que delimitan un túnel más virtual que real, ya que la contracción sistólica lo estrecha a modo de diafragma, de la misma manera que lo hace con el orificio mitral. La orientación de su trayecto corresponde al sentido de las agujas de reloj (corazón en posición anatómica, sobre su cara diafragmática, visto por el ápex). El fondo de saco apexiano se halla compuesto prácticamente sin capa muscular, por el adosamiento del endocardio con el epicardio. A través de la transiluminación puede comprobarse esta disposición anatómica (figura 13).
Fruto de este proceso anatomofuncional es hallar un ápex que permanece inmóvil tanto durante la traslación de la base a la punta en la sístole (acortamiento) como en la fase subsiguiente de la succión, al alejarse la base de la punta para lograr el alargamiento ventricular (192-198). En este punto consideramos que al pasar dos veces seguidas la bandeleta descendente en forma posterior a la ascendente contribuiría a que parte del volumen cardíaco (el 30% del volumen diastólico total) no se eyecte al final de la sístole y permanezca como volumen residual (39). Este remanente líquido actúa con la función de una “capa límite” para una correcta succión durante la fase protodiastólica, evitando la necesidad de generar un gasto energético importante para lograr la succión ventricular, lo que sucedería si las paredes del ventrículo estuviesen adosadas.
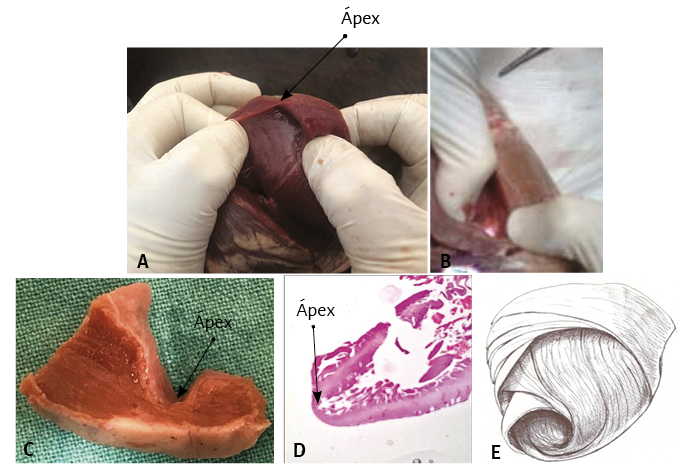
Figura 13. A: se observa el ápex cardíaco. B: la transiluminación positiva en el fondo de saco apexiano demuestra que prácticamente no hay fibras musculares en esta región. C y D: detalle macro y microscópico del ápex que muestra el endocardio adosado al epicardio, casi sin capa muscular, la cual presenta un espesor del 10% con relación al miocardio contiguo. E: el dibujo del miocardio continuo plegado en hélix revela la naturaleza del ápex, el que queda conformado por una zona frágil dado el cambio de orientación del segmento descendente transformándose en ascendente. A y B: corazón bovino. C: corazón humano adulto. D: embrión humano de 16 semanas.
El ápex (espacio entre los segmentos descendente y ascendente constituyentes de la lazada apexiana) cuenta en condiciones normales con poder de estrechamiento anular (mecanismo esfinteriano) para soportar la presión intracavitaria retrógrada que produce la expulsión de la sangre. No efectúa casi desplazamiento mensurable alguno. Permanece prácticamente inmóvil durante todo el ciclo cardíaco ejerciendo tan solo una cierta presión sobre la pared costal (choque de la punta). Es la base del corazón quien efectúa los desplazamientos al descender (sístole) y ascender (succión). El corazón sufre en sístole un movimiento de retropropulsión, principio de acción y reacción enunciado por la tercera ley de Newton, siendo el ápex el mayor tributario de la fuerza retrógrada que sufre la cavidad ventricular al ser expulsada la sangre hacia los grandes vasos. Similar a otras zonas en el organismo de sobrecarga tensional, carece prácticamente de músculo (193). Además, está sometido a una presión final en su fondo de saco al momento del cierre de la válvula aórtica. Esta zona apexiana constituye la localización donde se generan los aneurismas de la pared ventricular en un porcentaje alto junto con la pared anterior, como del mismo modo los aneurismas congénitos. En estos últimos, la zona de unión al ventrículo izquierdo es ancha, histológicamente carece de capa muscular miocárdica y presenta una pared única de tejido fibroelástico, en ocasiones calcificada. (224).
El fondo de saco del ápex puede ser utilizado en la técnica de reconstrucción elipsoidal del ventrículo izquierdo en las cardiomiopatías dilatadas (63, 64, 105-107, 188, 210). La incisión, ingresando por su vértice y de orientación paralela a la izquierda de la arteria descendente anterior, actúa sobre el área limitada por los segmentos descendente y ascendente del miocardio continuo, corrige la distorsión del septum y permite que se realice la cirugía ingresando por la pared avascular prácticamente sin lesionar músculo del ventrículo izquierdo. La técnica de suturar los bordes extremos superponiéndolos genera un efecto de solapa, acerca los segmentos descendente y ascendente restituyendo la geometría y refuerza el ápex, lugar especialmente vulnerable en la dilatación cardíaca. Tanto la incisión original como el tamaño de las solapas deben obedecer a la dilatación que presenta el ventrículo o a la cavidad que se desea conservar, con el fin de reducir los volúmenes ventriculares aumentados (figura 14).
El hecho esencial para la mecánica cardíaca es que las fibras musculares de la base y del ápex del corazón se desplazan en sentido opuesto. Esta disparidad en las direcciones comentadas tiene correlación con las trayectorias alcanzadas por las fibras y el patrón helicoide del miocardio cardíaco de comportamiento anisotrópico que delimitan a los ventrículos (figura 15).
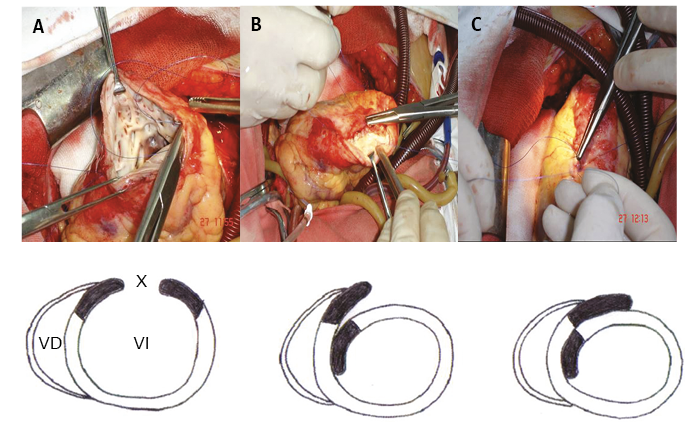
Figura 14. Reconstrucción ventricular epipsoidal. A: incisión longitudinal (X) a lo largo de la arteria descendente anterior en la pared avascular del ventrículo izquierdo (VI). B: el borde izquierdo de la incisión, mediante una sutura continua, es llevado a la pared septal. El borde marginal remanente es suturado constituyendo una solapa a la pared libre del VI. C: la incisión original y el tamaño de las solapas deben obedecer a la dilatación del VI (a la cavidad que se desea conservar) con el fin de reducir los volúmenes ventriculares aumentados. Referencia VD: ventrículo derecho.
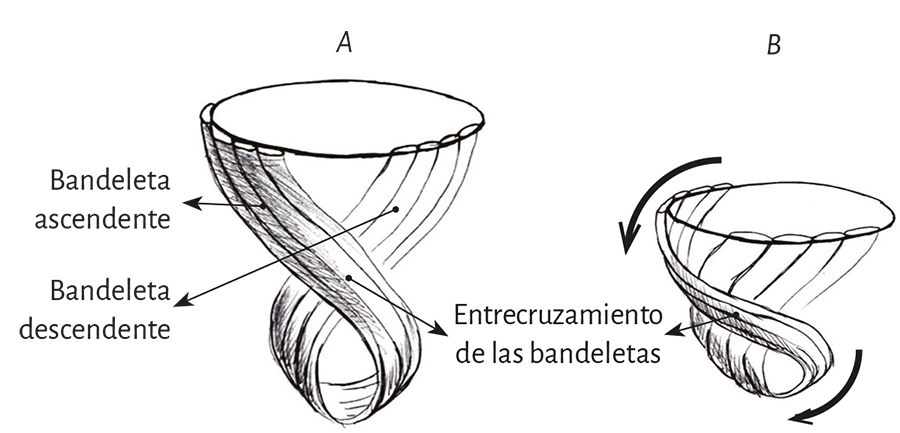
Figura 15. Torsión ventricular. A: luego de la sístole se produce un cambio en la configuración ventricular con alargamiento-detorsión determinando una elevación de la base (fase activa de succión protodiastólica). B: la contracción mecánica en sístole produce una rotación en sentido contrapuesto y acortamiento ventricular entre el ápex y la base ventricular.
Ventrículo derecho. Mientras que el ventrículo izquierdo posee una conformación elipsoidal, el derecho ofrece una topografía en semiluna (figura 4) (66). Se pueden distinguir en su mitad distal en forma conceptual dos tipos de fibras de acuerdo con la orientación. Unas son paraendocárdicas y las otras paraepicárdicas pertenecientes al segmento derecho del miocardio continuo. Las primeras desde la base pulmonar van hacia atrás y abajo a la región de la punta, mientras que las otras se desplazan desde el surco interventricular anterior hacia atrás, acercándose a la base cardíaca. Esta disposición cruzada en equis permite ver en la parte distal del ventrículo derecho que las fibras toman una disposición helicoidal, transformándose de este modo de subepicárdicas en subendocárdicas (figura 16).
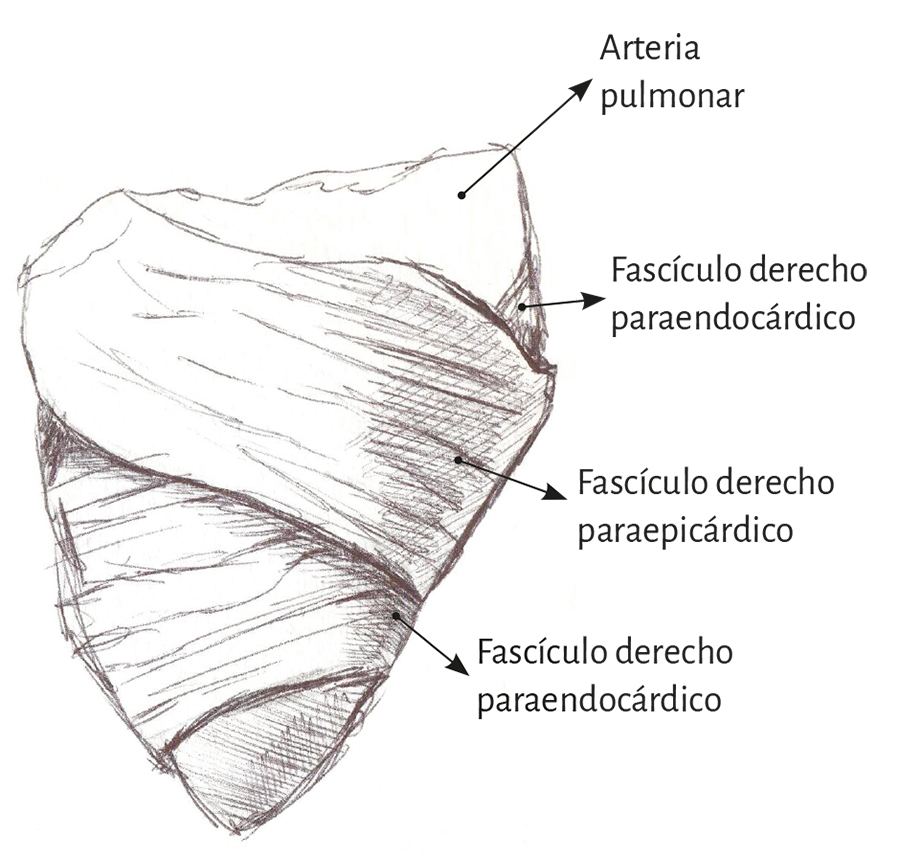
Figura 16. Pared libre del ventrículo derecho.
En la mitad basal del ventrículo derecho (perímetro orificial tricuspídeo) podemos distinguir tres segmentos: la pared libre, la crista supraventricular y el tabique interventricular. En la pared libre se repite el esquema general de las fibras que en sentido espiral van desde posiciones subepicárdicas a subendocárdicas. Del mismo modo como sucede en el ventrículo izquierdo, hay diferencia de sentido de giro entre las fibras de la zona basal con relación a la parte distal. Estas siguen una trayectoria opuesta a las agujas del reloj en la parte basal y a favor de la dirección de las agujas del reloj en la parte distal (corazón en posición anatómica, sobre su cara diafragmática, visto por el ápex). Esta sección del miocardio (segmento derecho) sigue una dirección predominante de base a ápex, la que permite soportar la contracción fundamental del ventrículo derecho de dirección longitudinal. La resonancia magnética con el tensor de difusión, al identificar el movimiento browniano de las moléculas de agua distribuidas anisotrópicamente en los tejidos especialmente en su eje longitudinal, permite ver la disposición tridimensional de estructuras anatómicas en tejidos aparentemente homogéneos (218).
Al comparar el modelo de la cuerda (figura 7) con las regiones apexianas y las bases de los ventrículos (figura 4) se aprecia la analogía entre el modelo abstracto y las fibras del miocardio continuo.
4. Topografía del miocardio continuo
En su trayecto el miocardio toma una disposición helicoidal conformando las dos cámaras ventriculares (79). Esta hélice anatomofuncional se halla constituida por dos bandeletas denominadas descendente y ascendente. La primera incluye los segmentos derecho, izquierdo y descendente, mientras que la segunda queda conformada por el segmento restante, el ascendente (figura 7). La imagen en 8 determinada por este recorrido permite distinguir dos lazadas denominadas basal y apexiana. Resulta interesante que este concepto, representado con el número 8, se halla publicado desde 1923 por R. F. Shaner (153).
La hélice miocárdica describe dos vueltas en espiral con inserción de sus extremos inicial y terminal en un núcleo cuya estructura es ósea, condroide o tendinosa, de acuerdo con los diferentes especímenes animales y humanos estudiados en nuestras investigaciones. Lo hemos denominado fulcro cardíaco (figuras 17 y 18) (216). Esta inserción es el único sitio perceptible de donde se originan y terminan las fibras miocárdicas. Luego, en esta misma Proposición, se detallará en extensión y profundidad adecuadas este importante tema.
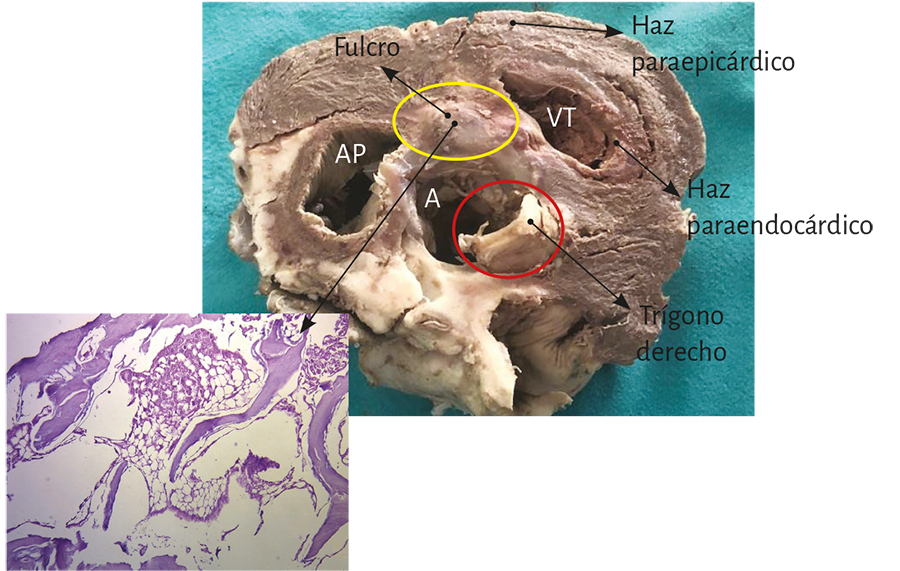
Figura 17. Fotografía aclaratoria de los haces musculares paraepicárdico y paraendocárdico del segmento derecho que forma el ventrículo derecho, los que emergen del fulcro cardíaco. AP: arteria pulmonar. A: aorta. VT: válvula tricúspide. Se observa en el ángulo la histología del fulcro constituida por trabécula ósea madura (corte transversal de un corazón bovino).
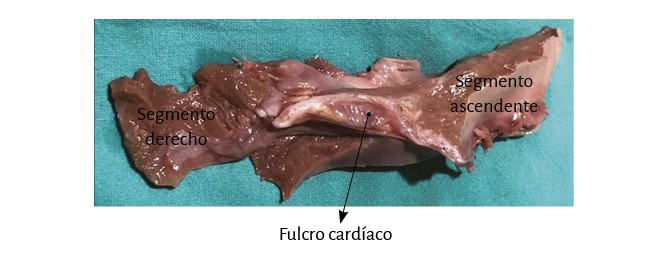
Figura 18. Se observa el fulcro cardíaco con la inserción del inicio (segmento derecho) y del final (segmento ascendente) del miocardio continuo (corazón de bóvido).
La lazada basal, desde su inserción en el fulcro cardíaco, se extiende hasta el doblez central del miocardio continuo. Por su parte la lazada apexiana discurre desde ese punto de inflexión del miocardio hasta la base aórtica. Cada una de ellas consta a su vez de dos segmentos. La basal está constituida por los segmentos derecho e izquierdo. Los pertenecientes a la apexiana tienen el nombre de descendente y ascendente (figura 7). En la disposición integral de las lazadas, la basal abraza a la apexiana, lo cual determina que la cavidad ventricular derecha se presente como una hendidura abierta en el espesor de la masa muscular que conforma a ambos ventrículos (figura 1). Con relación a los segmentos, ellos están definidos por referencias anatómicas, sin perder la continuidad que ostenta el miocardio en carácter de músculo único.
Lazada basal. El surco interventricular posterior ofrece un valle que determina el límite entre los segmentos derecho e izquierdo de la lazada basal. El segmento derecho constituye la pared libre del ventrículo derecho y contornea por fuera el orificio de la válvula tricúspide. El segmento izquierdo ubicado en la pared libre del ventrículo izquierdo define por fuera el orificio de la válvula mitral. Las fibras transcurren en una dirección que va desde el subepicardio al subendocardio siguiendo una trayectoria helicoidal contraria al sentido de las agujas de un reloj (corazón en su posición anatómica, sobre su cara diafragmática, visto de frente por el ápex).
Lazada apexiana. El segmento descendente se extiende desde el doblez del miocardio continuo hasta el ápex. Desde ahí, toma la denominación de segmento ascendente para finalizar fundamentalmente por debajo de la base de la aorta en una estructura en la que se amarran las fibras y que hemos denominado fulcro cardíaco. Estos segmentos constituyen mayoritariamente el tabique interventricular. Igualmente a lo que sucede en la lazada basal, las fibras discurren desde el subepicardio al subendocardio, pero en este caso siguiendo una trayectoria helicoidal en sentido horario al desplazamiento de un reloj (corazón en su posición anatómica, sobre su cara diafragmática, visto de frente por el ápex).
De estos conceptos se deduce que el ventrículo derecho está constituido por una sola lazada (basal) y el ventrículo izquierdo por las dos (basal y apexiana). Además, la pared libre del ventrículo derecho está formada por un solo segmento (segmento derecho), mientras que la pared libre del ventrículo izquierdo se halla constituida fundamentalmente por dos segmentos con una aposición del ascendente (externo) cubriendo al descendente (interno). En relación al segmento izquierdo, lo hallamos formando la parte posterior del ventrículo izquierdo delimitando el orificio mitral. Su porción inferior se halla cubierta por el segmento ascendente.
5. Disección anatómica del miocardio
Material y métodos. Ante la discusión sobre la conformación estructural del miocardio se han utilizado procedimientos de imágenes que han mejorado su resolución, pero que al no actuar sobre la anatomía y la histología en forma directa, no han podido definir detalles primordiales en su organización y función. En esta investigación se ha trabajado con corazones frescos de bóvidos y humanos para obtener descripciones detalladas con el fin de dilucidar la verdadera arquitectura miocárdica espacial.
Se utilizaron 21 corazones provenientes de la morgue y matarifes, a saber:
- Doce corazones bovinos de dos años de edad con un peso de 800-1000 gr.
- Nueve corazones humanos (dos embriones de 16 y 23 semanas de gestación, uno de una persona de diez años con un peso de 250 gr y seis de adultos con un peso promedio de 300 gr).
Fueron realizados estudios anatómicos, histológicos, histoquímicos y radiológicos. La histología se realizó con hematoxilina-eosina, técnica de tinción tricrómica de Masson y secciones de cuatro micras. De buffer se utilizó formalina al 10%. Todas las muestras se sometieron a análisis histoquímico con tinción de azul alcián, marcador fiable para identificar la presencia de ácido hialurónico como mecanismo antifricción e incluso proporcionar una valoración semicuantitativa.
Técnica de disección. El corazón a disecar se sometió a ebullición en agua durante dos horas a la que se agregó ácido acético (15 cc por litro). Este paso permitió que el miocardio quedase libre de las aposiciones grasas, volviendo más fácil y prolija la disección. Luego se seccionó la aorta y la arteria pulmonar a unos 3 cm de sus nacimientos y se las separó del adosamiento que estos vasos poseen entre sí, para luego incidir en forma longitudinal, a nivel del surco interventricular, las fibras superficiales que se extienden por la cara anterior de los ventrículos en forma transversal (fibras aberrantes o interbandeletas) (figura 19) (173, 195, 199). Entre las aurículas y los ventrículos hay simplemente tejido conjuntivo, lo que implicó separar con sencillez dichas cámaras, dada la desnaturalización que establece el calor. Esta aseveración coincide con lo sustentado históricamente por Claudio Galeno en el siglo II d. C. (185) de que las aurículas pueden ser independizadas de los ventrículos sin corte alguno, simplemente separándolas de los ventrículos respectivos. La disposición horizontal de las aurículas (cámaras de dependencia del hemicírculo venoso) en el proceso evolutivo se adosó al componente muscular ventricular (cámaras de dependencia del hemicírculo arterial); por lo tanto, sus orígenes son diferentes. De este modo, la aurícula única de los peces se constituyó en la aurícula derecha en los mamíferos, mientras que el ventrículo único se transformó en la aurícula izquierda. Ambas aurículas representan vestigios estratégicos del primitivo tubo circulatorio de los peces en su segmento venoso.
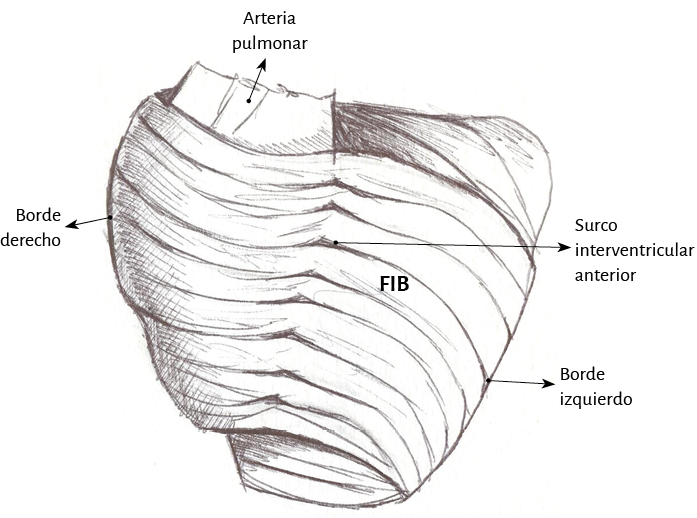
Figura 19. Fibras interbandeletas (FIB).
La maniobra clave para lograr el desenrollamiento miocárdico consiste en introducirse en el surco interventricular anterior (figura 20) en forma roma, lo cual permite dejar en el lado izquierdo del operador el extremo del miocardio que corresponde a la arteria pulmonar y a su contigüidad con la pared libre del ventrículo derecho (segmento derecho). A continuación se ejerce tracción hacia el mismo lado izquierdo, maniobra que deja a la arteria pulmonar totalmente liberada del resto del miocardio (figura 21). Esta disección del miocardio descubre al fulcro cardíaco por debajo y delante de la aorta, en una localización separada del trígono derecho y en un plano inferior al nacimiento de la arteria coronaria derecha, sin continuidad con la válvula aórtica e insertado como un elemento complementario entre la aorta y el miocardio (figuras 21, 31, 48, 49, 51 y 52) (205). Esta estructura, lugar de apoyo del extremo inicial y final del músculo cardíaco, constituye la inserción del miocardio de manera análoga a un músculo esquelético.
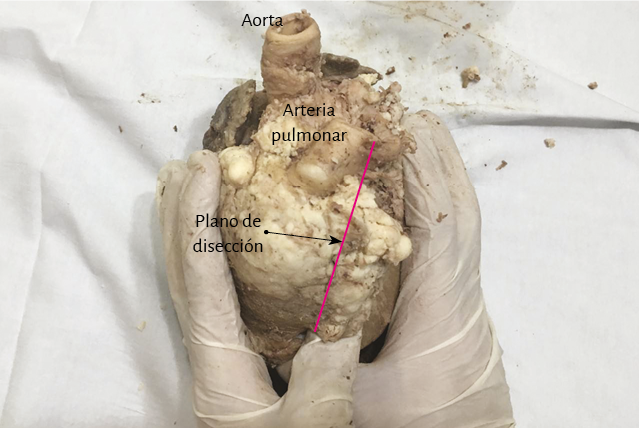
Figura 20. Plano de clivaje (línea roja) para iniciar el desplegamiento ventricular (corazón de bóvido).
Se debe entender que al desplegar el miocardio, separando la arteria pulmonar y el cordón pulmotricuspídeo (anterior) del segmento ascendente (posterior), se pierde la visión de la integridad anatómica, homogénea y funcional, del corazón. Esta conjunción entre nacimiento y fin del músculo cardíaco en el fulcro cardíaco constituye un punto de encuentro entre segmento derecho y segmento ascendente, origen y fin del miocardio. De este modo ambos extremos se hallan ubicados en un mismo punto, estando el origen de las fibras del miocardio en un plano anterior a las de su terminación (figuras 18, 21, 22 y 23).
La prosecución en la disección del miocardio implica encontrarse con toda la extensión del segmento derecho, el inicio del segmento izquierdo, y en el límite posterior de la cavidad ventricular derecha, con el ángulo diedro constituido por el septum interventricular y la pared libre del ventrículo derecho (segmento derecho) (figuras 24 A y B). El próximo paso (el más delicado) consiste en posicionarse en el ángulo diedro mencionado anteriormente, entre las fibras del ventrículo derecho y las intraseptales. Esta separación del ventrículo derecho permite ingresar en la parte ventral del tabique (figura 24 C). Luego se diseca la parte dorsal del tabique entre la banda septal posterior (ventrículo derecho) y el segmento descendente para desmontar y separar la aorta.
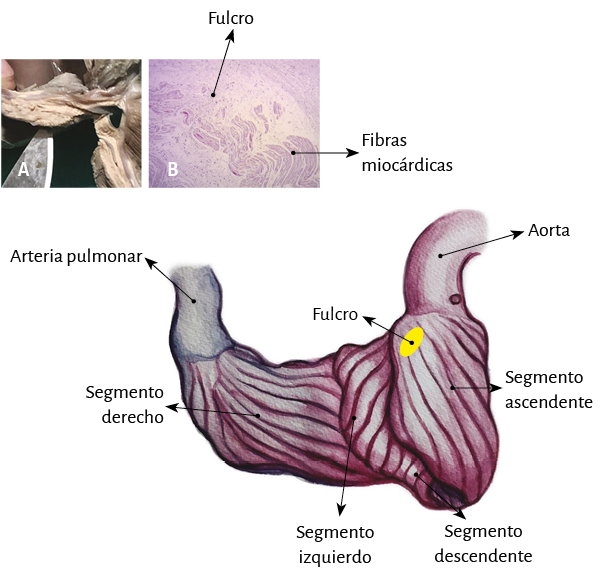
Figura 21. Se observa en este dibujo la disposición del miocardio continuo al inicio de ser desplegado. Es necesario considerar que la arteria pulmonar y el segmento derecho se han separado del fulcro cardíaco con el fin de señalar la ubicación intermedia de este entre el segmento derecho (ubicación anterior) y el segmento ascendente (ubicación posterior). A: macroscopía del fulcro en corazón humano adulto. B: microscopía del fulcro humano. Adviértanse las fibras miocárdicas insertándose en la matriz tendinosa del fulcro.
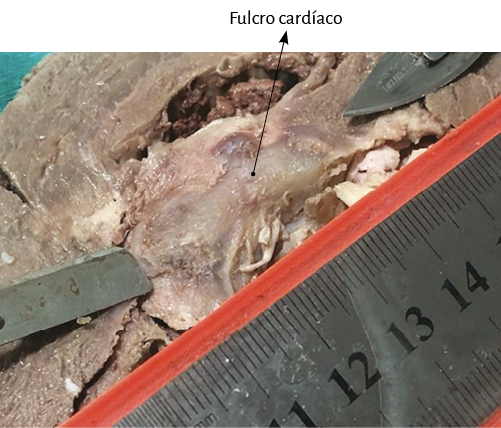
Figura 22. Fulcro cardíaco en corazón bovino.
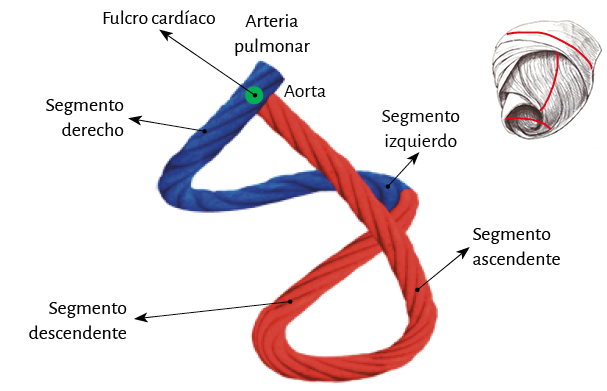
Figura 23. Ubicación del fulcro cardíaco en el miocardio continuo (modelo de la cuerda). En el ángulo derecho se muestra la disposición tridimensional del miocardio continuo.
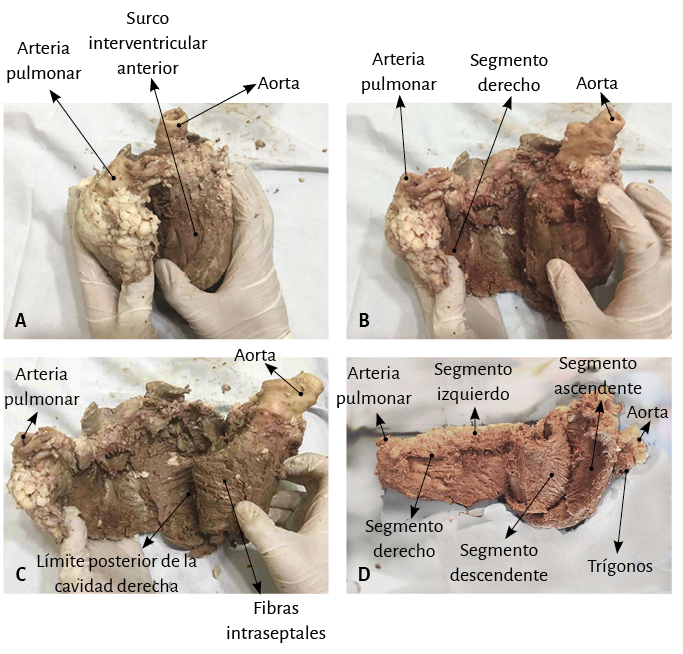
Figura 24. Desplegamiento del miocardio continuo.
Finalmente en forma roma se separa el plano muscular del segmento descendente del correspondiente al segmento ascendente que conduce al fulcro cardíaco en contigüidad con la aorta, a la derecha del operador, permitiendo al rotar sus extremos extender y alinear el miocardio continuo en toda su longitud (figura 24 D). Al poder desenrollar el miocardio en un grosor similar en toda su extensión se evidencia que es único y continuo, y no una construcción heurística (figuras 25-27). En la figura 26 un esquema detalla los distintos segmentos que lo constituyen, así como las inserciones finales que componen respectivamente el inicio y el fin del miocardio, muy próximos entre sí en el corazón helicoidal intacto, antes de ser desplegado.
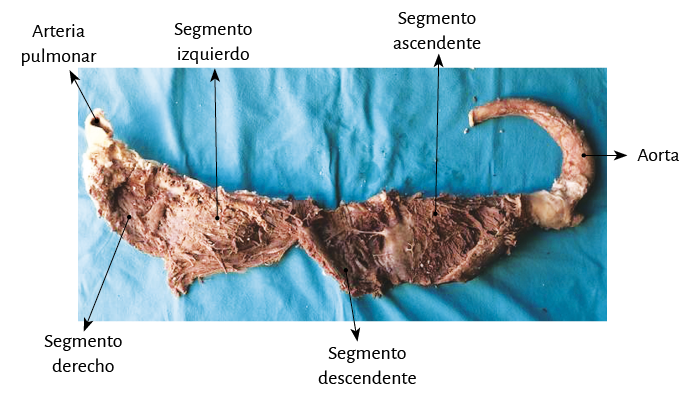
Figura 25. Miocardio desplegado en toda su extensión.
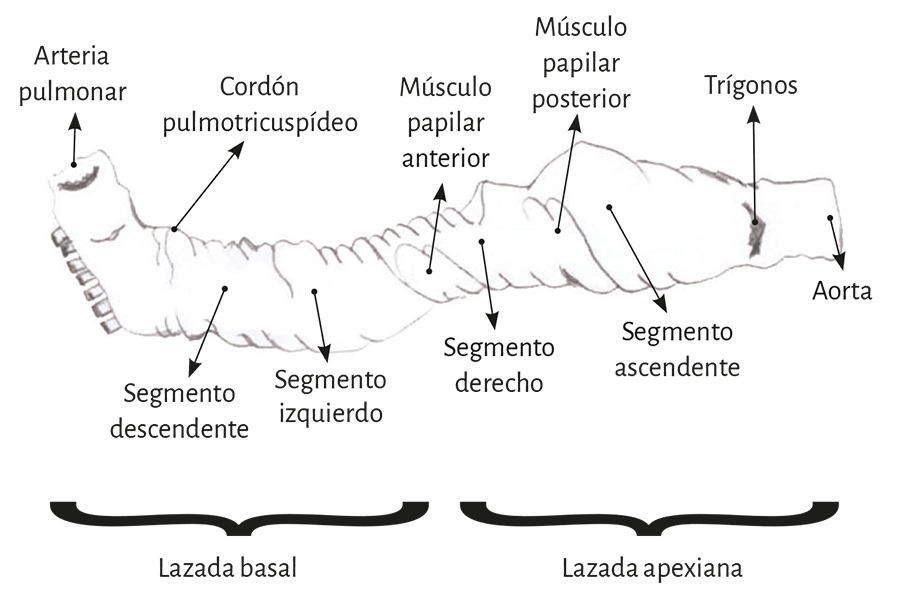
Figura 26. Esquema aclaratorio de los segmentos del miocardio continuo.
Resultados
Análisis anatómico e histologíco del miocardio. En la secuencia del análisis histológico del miocardio desplegado (figura 27) se demuestra la orientación longitudinal, de acuerdo con la continuidad de los segmentos que tiene su conformación espacial, tanto en la cara interna como en la externa en cada uno de ellos. Las fibras tienen direcciones paralelas en ambas superficies (interna y externa) de cada uno de los segmentos. La superposición de los segmentos que implica la conformación helicoidal resulta indispensable para lograr la torsión miocárdica, acción fundamental de la mecánica cardíaca que no sería posible con la estructura de malla (entrecruzamiento de fibras miocárdicas). En esta estructura helicoidal se produce un rozamiento en sus superficies de contacto, lo que implica que presenten un sistema lubricante que facilita la movilidad autónoma de ellos con menor gasto de energía, tema que se analizará en esta Proposición.
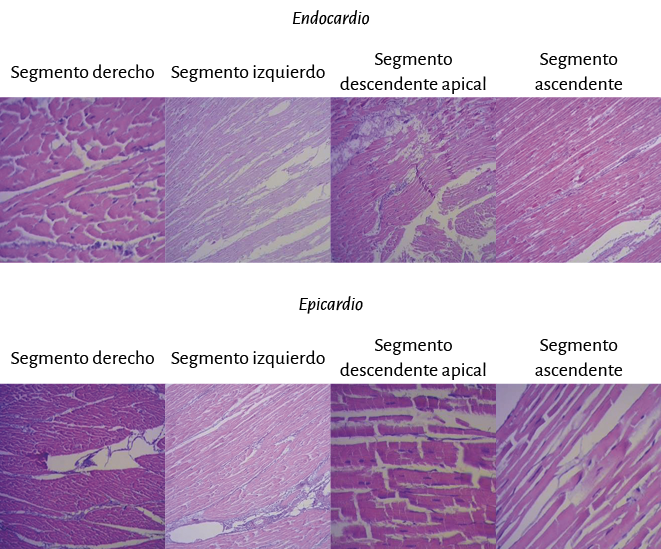
Figura 27. Secuencia segmentaria del análisis histológico del miocardio continuo. Técnica de hematoxilina-eosina (15x).
Ningún segmento de la histología secuencial en la continuidad longitudinal del miocardio en nuestras investigaciones presentó una disposición en malla. En la cara externa de la parte distal del segmento descendente, al girar a nivel del ápex y transformarse en ascendente, los miocardiocitos generan en los cortes planimétricos una arquitectura disímil a la cara interna en su orientación, único sitio donde sucede esta situación. Esta disposición se halla dada en el ápex, en donde el trayecto en espiral de las fibras miocárdicas que se desplazan desde la periferia hacia el centro determinan un cambio brusco de la dirección, ya que las fibras subepicárdicas se vuelven subendocárdicas (figura 27), superpuestas como las tejas en un techo, que es lo que evidencia la imagen comentada. Esta configuración es lógica para la demostración de la disposición helicoidal pues sucede en el sitio donde el miocardio transforma en forma brusca su dirección de descendente en ascendente. En el resto la disposición es siempre paralela. El miocardio continuo se asemeja a la cinta de Moebius dado el cambio progresivo de la angulación en las fibras transformándose de epicárdicas en endocárdicas (164).
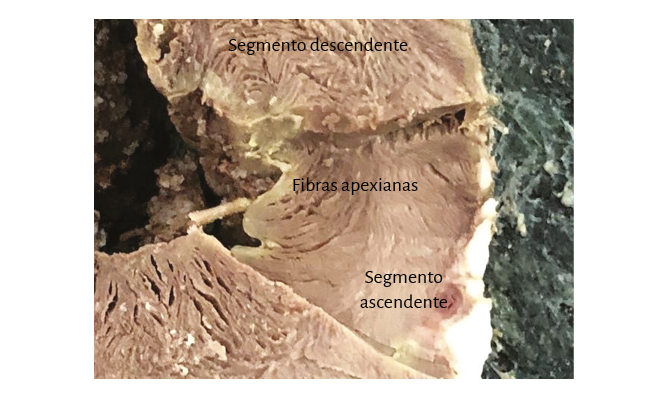
Figura 28. Fibras apexianas (corazón de bóvido).
Esta investigación evidencia que el miocardio no se estructura como una malla sino en forma de músculo continuo en espiral (figura 28) (217). El concepto que se ha esgrimido de malla fue elaborado a partir de la superposición de segmentos a través del plegamiento de la hélice miocárdica. Si se desenrolla el miocardio con la técnica de disección apropiada se obtiene un grosor similar en toda la extensión del músculo, evidenciando que su continuidad es real. Plegado, se encuentra que el grosor del ventrículo derecho es la mitad que la del ventrículo izquierdo, ya que el primero se halla compuesto por solo un segmento del músculo, mientras que el segundo presenta adosamiento de dos segmentos. Su disección, por los planos de clivaje comentados, siempre finaliza en la misma estructura de desplegamiento. La pregunta es la siguiente: ¿cómo es posible repetir disecciones obteniendo siempre el mismo resultado y no concluir en la existencia de una continuidad de las fibras miocárdicas?
Al inicio del desplegamiento miocárdico lo primero que se interrumpe es un núcleo condroide, donde confluyen ambos extremos del miocardio y al cual hemos denominado fulcro cardíaco (211). Discontinuado este punto, se divorcian los extremos del miocardio. El segmento derecho (inicio) se amarra fundamentalmente a la superficie anterior del fulcro. El segmento ascendente, extremo final del miocardio, ingresa al fulcro fundamentalmente por la parte inferior (figuras 18, 21, 33 y 51). En esta maniobra el miocardio pierde la integridad. Desaparece su solidez integral. El sector del segmento derecho que se extiende desde el fulcro hasta la arteria pulmonar es el tronco pulmotricuspídeo simplemente adosado al segmento ascendente ubicado posteriormente (figuras 29 y 30).
El miocardio es un músculo continuo y helicoidal; tal es el resultado de su disección. La función cardíaca no se puede explicar con una conformación en malla. Al respecto, el trabajo de Maclver (98) expresa: “Ninguno de los estudios histológicos del miocardio que conocemos, por el contrario, ha proporcionado ninguna evidencia de un origen e inserción como se describe para la supuesta banda miocárdica única […] Ninguna de estas investigaciones ha proporcionado ninguna evidencia de una alineación de los cardiomiocitos que sigue el curso de la banda miocárdica única”. En primer lugar, el fulcro cardíaco que hemos investigado en corazones humanos y animales describe el apoyo cardíaco, el que a través de las pruebas que requería Maclver daría pie a la disposición muscular única, continua y en hélice que presenta el miocardio. Con respecto a la segunda conclusión de dicho autor, en la secuencia del análisis histológico del miocardio desplegado se demuestra la orientación longitudinal, de acuerdo con la continuidad de los segmentos que tiene su conformación espacial, tanto en la cara interna como en la externa de cada segmento. Dichas orientaciones resultan paralelas en ambas superficies (interna y externa) en cada uno de ellos. Ningún segmento de la histología secuencial en la continuidad longitudinal del miocardio presenta una disposición en malla. En la cara externa de la parte distal del segmento descendente, al girar a nivel del ápex y transformarse en segmento ascendente, los miocardiocitos generan en los cortes planimétricos una arquitectura disímil a la cara interna en su orientación, único sitio donde sucede esta situación dado su cambio brusco de dirección (figura 27), evidencia fundamental del helicoide cardíaco.
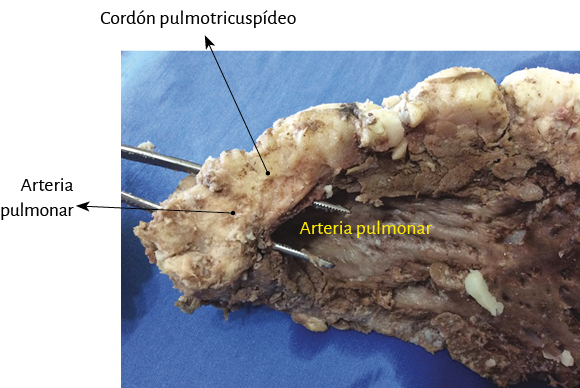
Figura 29. Una visión panorámica del cordón pulmotricuspídeo.
Análisis histológico del fulcro cardíaco. En las investigaciones anatómicas hemos hallado en todos los corazones de bóvidos y de humanos un núcleo cuya estructura histológica es diferente de acuerdo con los especímenes analizados, presentándose como de carácter óseo, condroide o tendinoso. En esta estructura se amarran tanto las fibras musculares del segmento derecho (inserción inicial) como las del segmento ascendente (inserción final). Durante la disección del miocardio, el hallazgo en esta investigación del fulcro cardíaco como núcleo donde se inserta el miocardio nos condujo a otras indagaciones: ¿cuáles eran sus características?, ¿qué ubicación ostenta?, ¿cuál es la histología?, ¿es análoga su presencia en distintas especies?, ¿cómo se inserta el músculo miocárdico en dicha estructura que hemos denominado fulcro cardíaco?
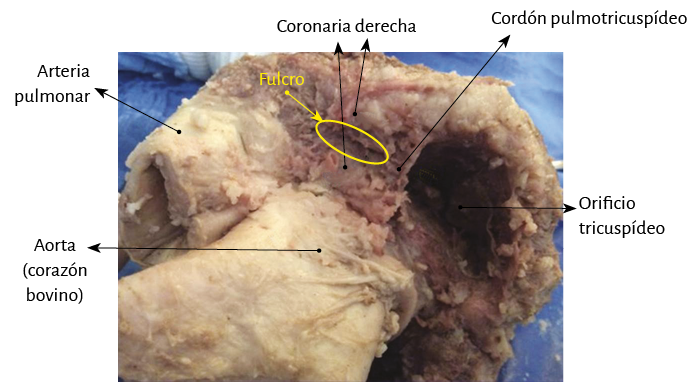
Figura 30. Se observa con detalle el cordón pulmotricuspídeo entre el orificio tricuspídeo y la arteria pulmonar donde se inicia el miocardio continuo. El círculo señala el sitio donde se halla el fulcro cardíaco, que se visualiza al retirar la arteria pulmonar y el cordón pulmotricuspídeo de su aposición al comienzo del desplegamiento (cotejar con la figura 31). Se ha procedido a la sección de la coronaria derecha para hacer evidente el trayecto del cordón pulmotricuspídeo.

Figura 31. Se demuestra la ubicación del fulcro cardíaco.
Este sitio de inserción que hemos denominado fulcro cardíaco se encuentra en las proximidades de la válvula tricúspide (derecha), de la aorta (superior) y del cordón pulmotricuspídeo (anterior) (figuras 30 y 31). Para poder hallarlo es necesario desplazar hacia la izquierda del observador la arteria pulmonar y el segmento derecho, desnudando la raíz de la aorta. Este gesto descubre al fulcro por debajo de la aorta e inferior al trígono derecho, sin ninguna continuidad con este, por debajo del nacimiento de la arteria coronaria derecha, desprendido de la continuidad aórtica y ubicado como un elemento complementario entre aorta y miocardio (figura 21).
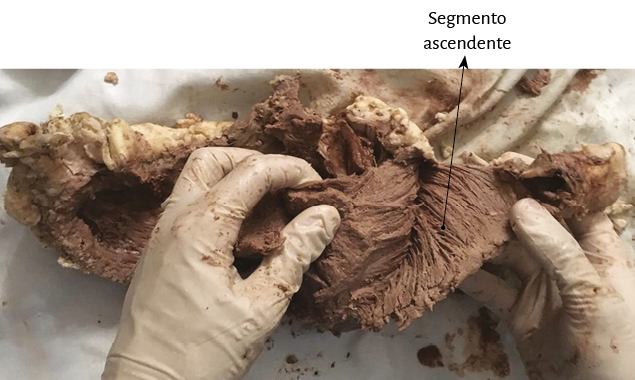
Figura 32. Se aprecia el segmento ascendente, el que se va a insertar en el fulcro cardíaco (corazón bovino).

Figura 33. Fulcro cardíaco por debajo de la aorta (corazón bovino). En el ángulo se observa la pieza resecada.
La existencia de una formación ósea, denominada os cordis, en bóvidos y ovejas es un hecho mencionado en ciencia veterinaria. Con posterioridad a nuestra primera publicación en 2018 sobre su hallazgo en el hombre (205), últimamente también fue ubicado en el chimpancé (109). En estas referencias es situada en el mismo sitio en el que nosotros hemos investigado esta estructura, tanto en bóvidos como humanos. Más allá de su mera alusión, hasta nuestras investigaciones nunca se le asignó ninguna función ni el sentido de su presencia, como asimismo careció de descripción en el ser humano (figuras 32 y 33) (216).
En bóvidos, la consistencia del fulcro cardíaco, óseo a la palpación (figuras 34 y 35), ha sido confirmada por la histología (figuras 36 a 38). Su tamaño, corroborado por disección (figura 39) y tomografía computada (figuras 58 y 59), es de aproximadamente 37 a 45 × 15 mm y de forma triangular. El análisis microscópico del fulcro cardíaco bovino muestra una matriz osteocondral trabecular con líneas segmentarias. Su estructura general asemeja al crecimiento metafisario de los huesos largos. A mayor aumento se pueden observar trabéculas óseas con osteoblastos y líneas segmentarias secundarias a aposición ósea. Los mismos hallazgos histológicos se han encontrado en chimpancés (109). La inserción secuencial de las fibras miocárdicas en el fulcro bovino se puede observar en las figuras 40-42.
En el corazón humano de diez años la descripción histológica del fulcro cardíaco se halla relacionada con esa temprana edad, ya que la muestra evidencia una zona central del fulcro formada por tejido condroide. Dada la edad, es lógico que el tamaño sea más pequeño y se caracterice por mayor tejido condroide que óseo (figuras 43 y 44). Este hallazgo se repitió en el feto humano de 23 semanas con las características áreas azuladas precondroides en un estroma mixoide (figuras 45 a 47).
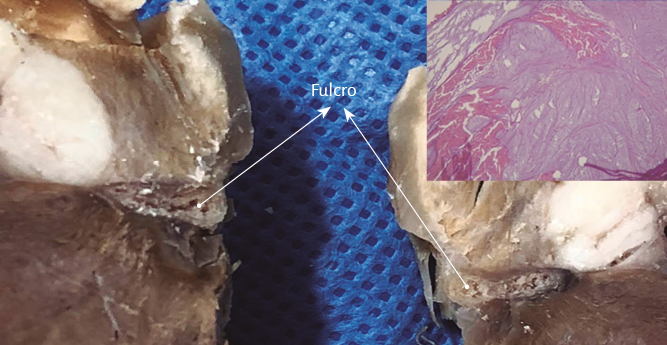
Figura 34. Fulcro cardíaco en corazón bovino. En el ángulo derecho se observa la imagen microscópica de la inserción del miocardio en la matriz ósea.

Figura 35. Fulcro cardíaco resecado (corazón de bóvido).
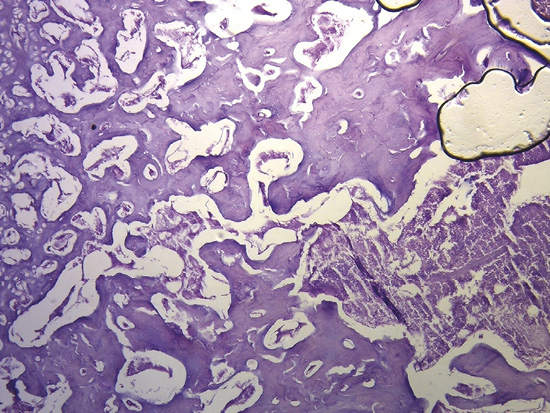
Figura 36. Técnica de hematoxilina y eosina. En el campo se observa tejido óseo trabecular con líneas de segmentación osteológica correspondiente al fulcro cardíaco (corazón bovino). Técnica de hematoxilina-eosina (40x).
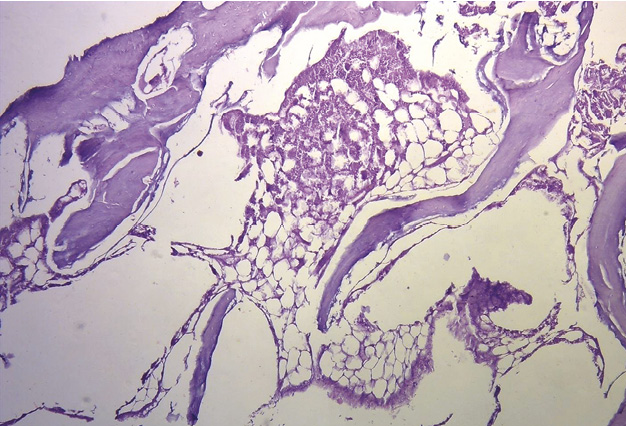
Figura 37. Técnica de hematoxilina-eosina (10x). Trabécula ósea madura que configura el tejido del fulcro cardíaco (corazón bovino).
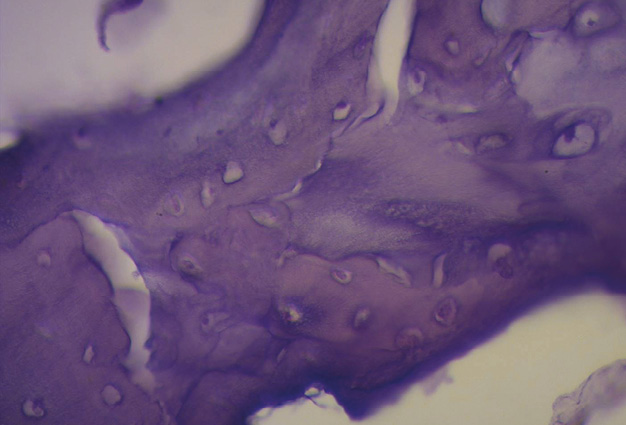
Figura 38. Tinción con hematoxilina-eosina a gran aumento (40x) del fulcro cardíaco. Se observa una trabécula ósea con osteoblastos y líneas segmentarias. La estructura forma el andamiaje del tejido óseo trabecular similar a las zonas metafisiarias de crecimiento de los huesos largos. Se visualizan trabéculas óseas con osteoblastos y líneas segmentarias secundarias a aposición ósea (corazón bovino).

Figura 39. Corazón de bóvido. Se puede observar las fibras miocárdicas en la línea de inserción en el fulcro cardíaco.
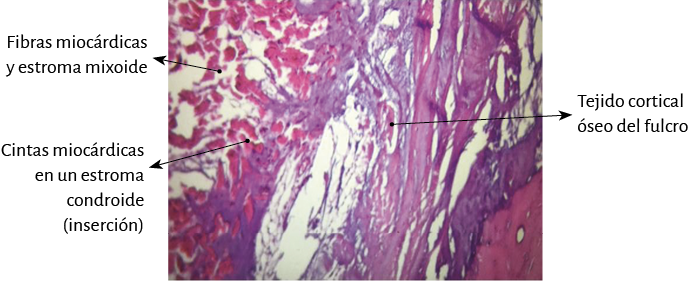
Figura 40. Inserción del miocardio en el fulcro cardíaco (corazón bovino). Técnica de hematoxilina-eosina (15x).
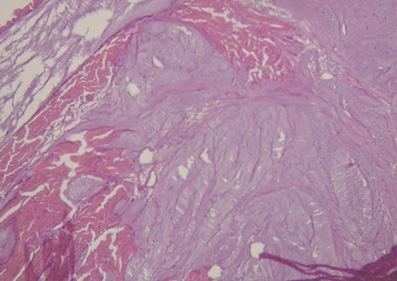
Figura 41. Se observa la inserción de fibras miocárdicas en el tejido condroide (fulcro) en corazón de bóvido. Técnica de hematoxilina-eosina (40x).
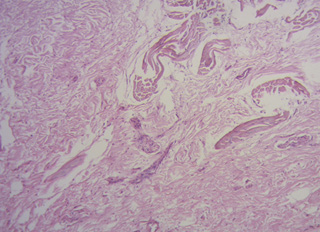
Figura 42. En corazón de bóvido se observa, en medio del fulcro, miocardiocitos del segmento derecho. Técnica de hematoxilina-eosina (40x).
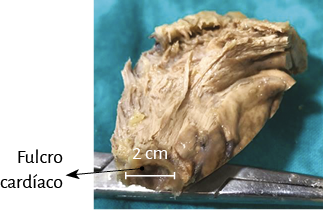
Figura 43. Fulcro cardíaco en un corazón humano de diez años de edad (explante).
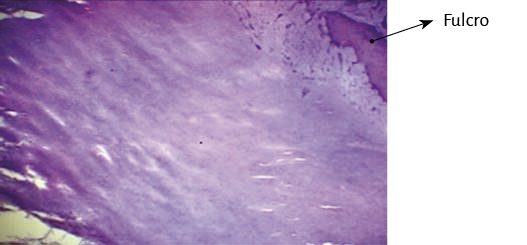
Figura 44. Corazón humano de diez años de edad. Técnica hematoxilina-eosina (15x). Zona central del fulcro formada por tejido condroideo.
Figura 45. Corazón de embrión humano. Línea de corte (23 semanas de gestación).
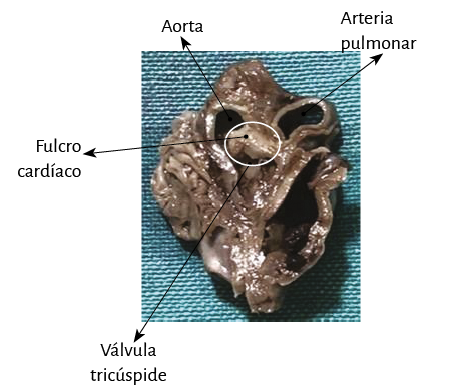
Figura 46. Fulcro cardíaco en corazón de embrión humano (23 semanas de gestación).
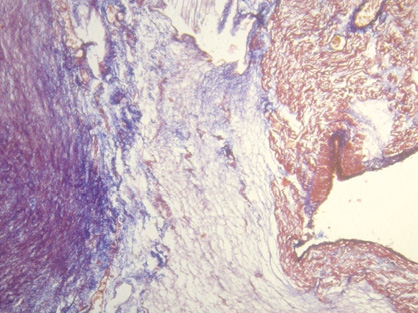
Figura 47. Áreas azuladas precondroideas en un estroma mixoide (feto de 23 semanas de gestación) del fulcro cardíaco. Técnica tricrómico de Masson (15x).
Sin embargo, en el análisis histológico del fulcro en corazones humanos adultos (tamaño aproximado de 25 mm × 15 mm) se encontró una matriz condroide-tendinosa, lo cual necesita una aclaración adicional (figuras 48-50). En principio, existe constancia similar en la detección, localización y morfología del fulcro en todos los corazones analizados. Ellos presentan inserción del miocardio en la estructura rígida del fulcro, integrando una unidad cardiomiocítica-matriz, independientemente de su naturaleza ósea, cartilaginosa o tendinosa en los distintos especímenes estudiados. Este punto de fijación implica que, como en todo músculo, actúe de palanca y también en carácter de cojinete, impidiendo además que en esta situación la fuerza de rotación ventricular, sea por torque o esfuerzo de torsión, se extienda a los grandes vasos, disipando así la energía producida por el movimiento de la hélice muscular.
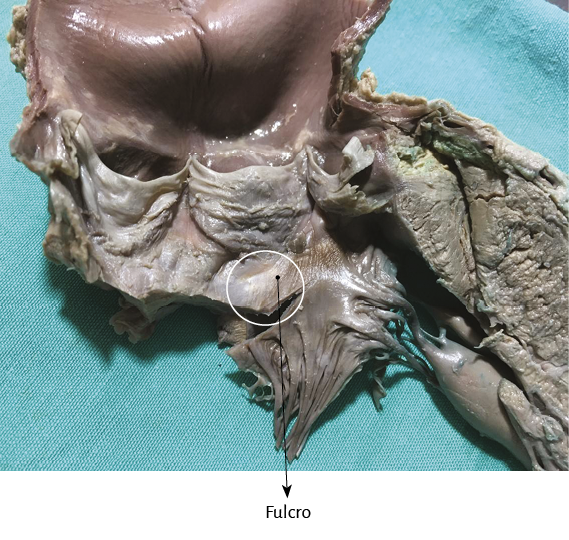
Figura 48. Fulcro en corazón humano adulto.
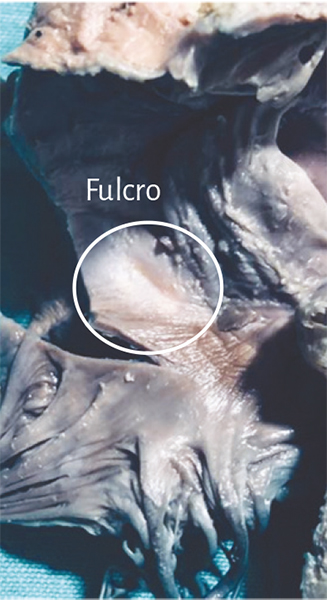
Figura 49. Fulcro en corazón humano adulto.
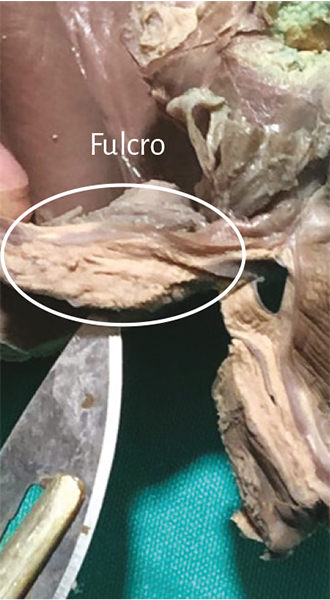
Figura 50. Fulcro resecado de un corazón humano adulto.
El haber encontrado una contextura ósea en el os cordis bovino y su relación con la textura mixoide-condroide en corazones humanos, incluso en embrión, resulta coherente con el análisis interpretativo. Esta diferencia halla correspondencia con la diferente evolución dada por la edad desde el material condroide hacia el osteoide y por el hecho de la potencia superior en los bóvidos que hace necesario contar con un apoyo más rígido.
De modo tal que el análisis histológico del fulcro en corazones humanos adultos evidenció una matriz colágena de naturaleza tendinosa, lo cual determina la necesidad de una elucidación adicional. El haberse hallado en humanos y diferentes especies implica que desde el punto de vista funcional su presencia es sinónimo de la inserción del miocardio, hecho que hemos corroborado en toda la histología analizada, constituyéndose en un punto sólido de razonamiento para cumplir con su acción biomecánica. Y esta demostración la encontramos cuando dirigimos el análisis histológico al punto de inserción del miocardio con el fulcro cardíaco, sea este óseo, condroideo o tendinoso. En todos los corazones analizados se halló este amarre del miocardio como “la hiedra a la piedra”, en la estructura rígida del fulcro, integrando una unidad miocardiocítica-matriz, aunque esta fuese ósea, cartilaginosa o tendinosa, según los estudios que hemos realizado en esta investigación (figuras 51-56).
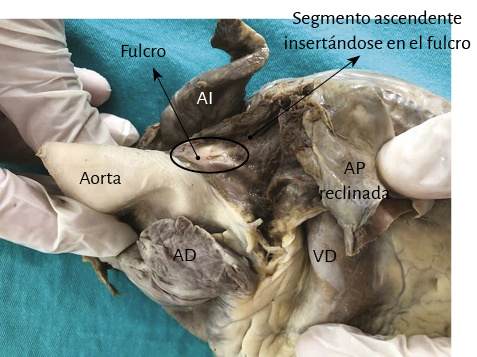
Figura 51. Corazón humano adulto. Se observa el segmento ascendente insertándose en el fulcro cardíaco. AI: aurícula izquierda; AD: aurícula derecha; AP: arteria pulmonar; VD: ventrículo derecho.
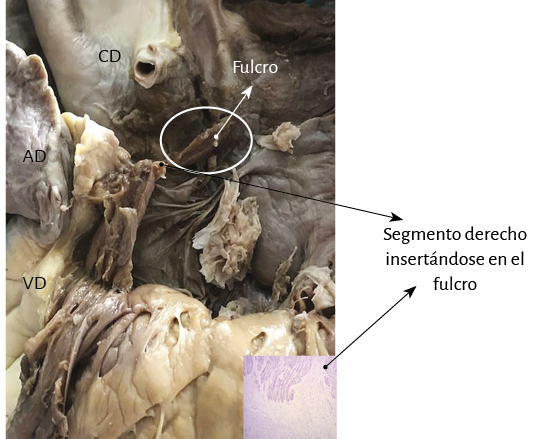
Figura 52. Corazón humano adulto. Se observan fibras musculares del segmento derecho insertándose en el fulcro cardíaco. En el ángulo se observa la microscopía de la inserción. AD: aurícula derecha; CD: coronaria derecha; VD: ventrículo derecho.
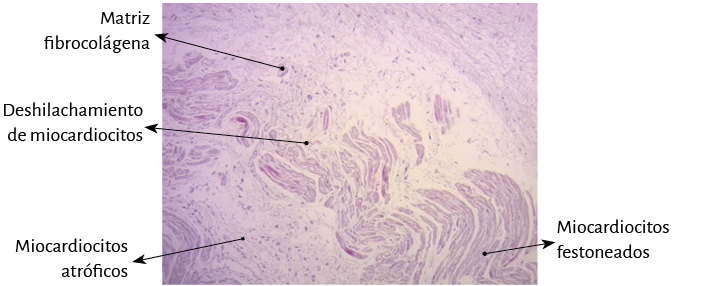
Figura 53. Miocardiocitos festoneados penetrando en matriz fibrocolágena (fulcro cardíaco). Corazón humano adulto. Técnica de hematoxilina-eosina (15x).
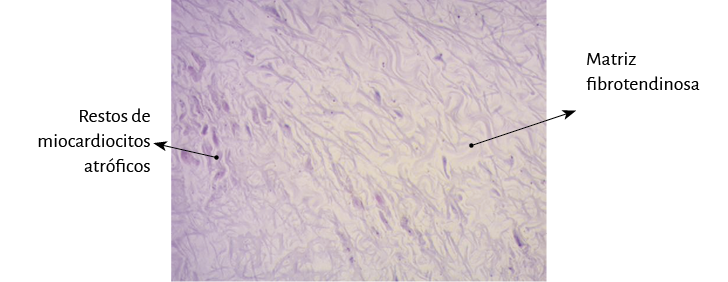
Figura 54. Bandas colágenas festoneadas integrando la matriz fibrotendinosa del fulcro (corazón humano adulto). Técnica de hematoxilina-eosina (15x).
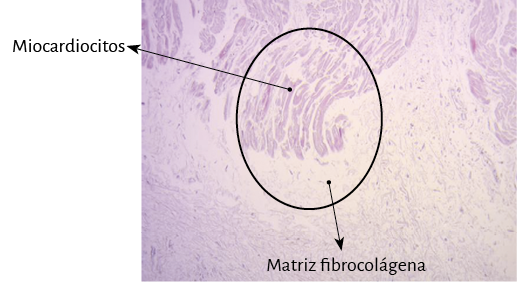
Figura 55. Miocardiocitos penetrando en el tejido de fibrocolágeno del fulcro cardíaco. Corazón humano adulto. En círculo se detalla sitio de inserción. Técnica de hematoxilina-eosina (15x).
En este punto surgen preguntas fundamentales: ¿por qué en corazones humanos adultos hemos hallado que el fulcro cardíaco posee características similares a un tendón, más allá de que cumpla la misma función de amarrar al miocardio helicoidal que tienen las otras especies? ¿Por qué no tiene la misma estructura que lo hallado en el corazón humano en gesta o en el niño?
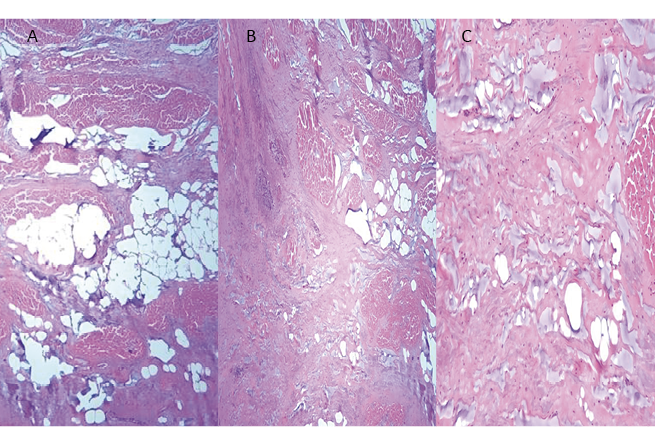
Figura 56. Corazón humano adulto. A: segmento ascendente del miocardio continuo antes de ingresar al fulcro cardíaco. Escaso tejido precondroideo. Se observa tejido adiposo. B: el mismo segmento ingresando al fulcro. Aún escaso tejido precondroideo. C: segmento ascendente en pleno fulcro. Las fibras ya se hallan rodeadas de estroma precondroideo. Técnica de hematoxilina-eosina (15x).
La interpretación que tenemos es que quizá el fulcro cardíaco de característica cartilaginosa-ósea sea un órgano vestigial propio de la evolución de los mamíferos. Se debe entender como estructura vestigial la retención durante el proceso de evolución de atributos genéticamente determinados que han perdido parte o la totalidad de su función ancestral en una especie determinada (71). Debido a este hecho lo hallamos en el proceso inicial de la gesta humana, pero luego desaparece su histología osteo-cartilaginosa, quedando referido a una matriz tendinosa suficiente para conseguir la inserción del miocardio para cumplir con una potencia muscular muy por debajo de mamíferos de mayor envergadura. Recordemos que en los bovinos el fulcro hallado en esta investigación es de naturaleza ósea.
Para establecer fielmente la identidad del fulcro cardíaco se ha realizado también análisis histológico sobre los trígonos tratando de hallar cardiomiocitos en ellos, como posibilidad de la inserción del músculo cardíaco en dichas estructuras. En nuestra investigación solo se observó tejido colágeno sin cardiomiocitos en los trígonos, confirmando que el fulcro es el sostén del miocardio, tanto en su inicio como en la terminación (figura 57).
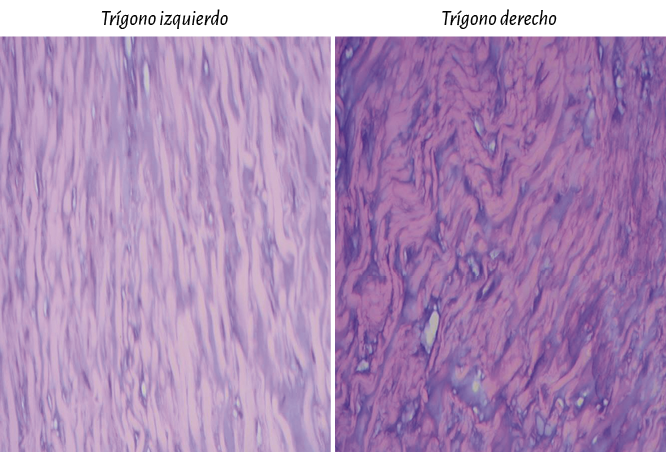
Figura 57. Trígonos. Se observa tejido colágeno festoneado y tejido intersticial elastoideo. No se halla inclusión de miocardiocitos. Técnica de hematoxilina-eosina (15x).
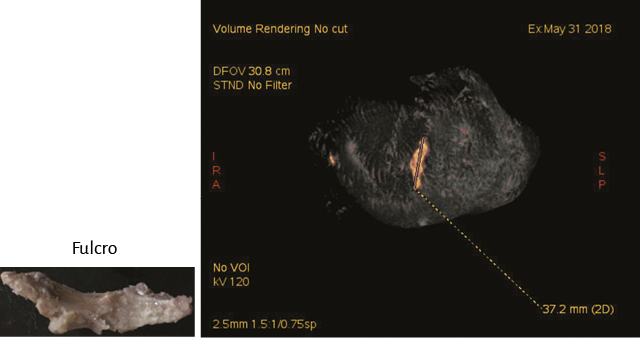
Figura 58. Tomografía computada. Se evidencia imagen hiperdensa en la topografía del septum interventricular adyacente a la raíz de la aorta de aproximadamente 3,7 cm de longitud. Presenta una densidad de aproximadamente de 298 UH (corazón bovino).
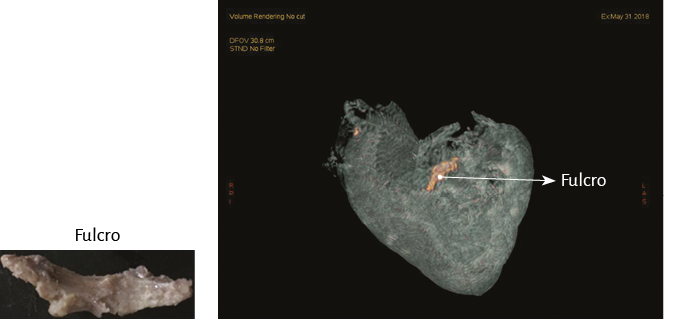
Figura 59. Fulcro cardíaco en tomografía computada (corazón bovino).Al pie se muestra el fulcro resecado.
Imágenes del fulcro cardíaco. Los corazones de bovino, estudiados con tomografía computada (figuras 58-60), resonancia magnética (figuras 61 y 62) y radiología simple (figura 63) evidenciaron el núcleo osteo-condroide hallado en la disección, observándose la misma morfología y tamaño análogo. En la tomografía humana hemos encontrado, en el análisis de la región donde se encuentra el fulcro cardíaco a través de las disecciones realizadas, la presencia de una intensidad en unidades Hounsfield por encima de 110 UH, mientras que el músculo adyacente tiene unidades por debajo de 80 UH. De esta manera, en la imagen, la estructura del fulcro alcanza un promedio de 132 ± 4,5 HU. En las áreas adyacentes, correspondiente al músculo miocárdico, este valor se ubicó entre 47,96 ± 12,5 y 77,59 ± 21,64 HU (figura 64).
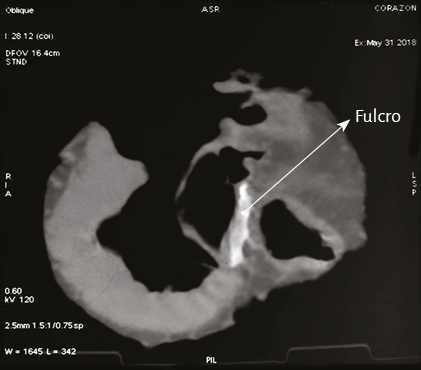
Figura 60. Tomografía computada. En el área señalada con la flecha se observa imagen adyacente a la raíz aórtica sobre el septum interventricular (corazón bovino).
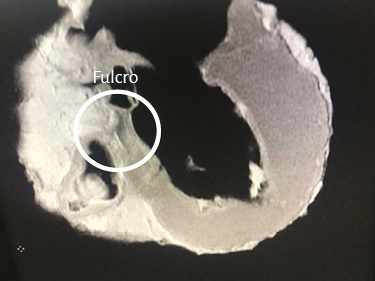
Figura 61. Resonancia nuclear magnética en corazón bovino.
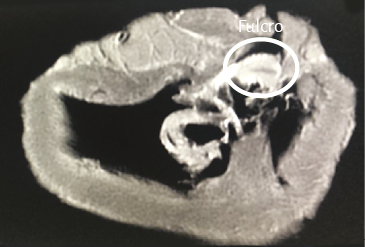
Figura 62. Resonancia nuclear magnética en corazón bovino.
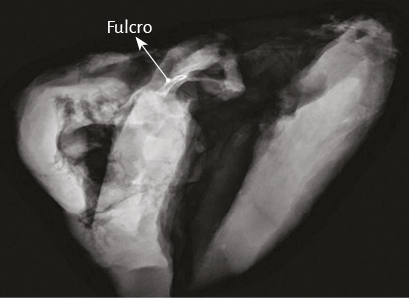
Figura 63. Se observa fulcro cardíaco en imagen radiológica con técnica de mamografía en corazón bovino.
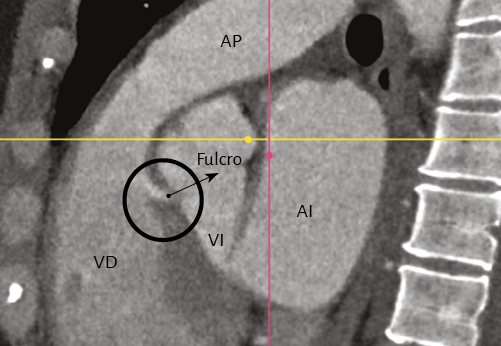
Figura 64. Tomografía computada en un paciente en la que se evidencia el fulcro cardíaco.
Discusión. Este estudio sobre la anatomía e histología del miocardio aporta pruebas de que las fibras miocárdicas constituyen un músculo continuo que describe un doble helicoide para conformar ambos ventrículos y que, para cumplir con su función muscular, necesita de un punto de apoyo que hemos encontrado y denominado fulcro cardíaco. El miocardio tiene las siguientes características derivadas del análisis anatómico e histológico realizado:
- Se halla constituido por un músculo único, continuo y enrollado que conforma un hélix con dos espirales.
- El miocardio está amarrado en su origen y en su final, tal como lo hace cualquier músculo, a un soporte que hemos descripto y denominado fulcro cardíaco.
- La disposición espacial en hélix obliga al músculo a sobreponer segmentos en su conformación espacial.
- Esta situación anatómica tiene profunda correspondencia con los movimientos miocárdicos y con la estimulación que recorre sus segmentos (Proposición 2).
- Las interconexiones transversales entre los tractos no invalidan el concepto de miocardio continuo, entendiéndose esta disposición compacta como resultado del desarrollo evolutivo para obtener solidez en su estructura en estricta relación con la función.
Por lo tanto, el miocardio puede ser definido como un músculo único que en su continuidad longitudinal adopta una conformación espacial espiralada, insertado en sus extremos (origen y fin) en un núcleo osteo-condroide-tendinoso de acuerdo con los especímenes analizados, denominado fulcro cardíaco. Dicha disposición delimita las dos cavidades ventriculares.
El miocardio como músculo único y enrollado en hélice no está fidedignamente representado con la palabra “banda”, término que ha generado discusión desde un punto de vista anatómico estrictamente académico. El concepto “banda” no corresponde a la etimología del vocablo y a una completa individualidad en espiral de su recorrido, donde está obligado a sobreponer los segmentos. En contraposición al concepto de banda algunos autores han propuesto el de disposición de las fibras miocárdicas en malla. Dicho término tampoco es aceptable, ya que esta estructura no guarda relación con la organización anatómica funcional del corazón, tal como fue analizado en este apartado. Hay criterios sólidos que avalan el concepto de continuidad del miocardio como músculo único, continuo y espiralado:
- La homogeneización muscular disimula la continuidad en espiral real de las fibras al sobreponerse sus segmentos. Esto implica considerar que su solidez estructural se halla requerida en las aves y en los mamíferos para lograr que la sangre se eyecte a una velocidad alta en un tiempo acotado, por un órgano que debe abastecer dos circulaciones (sistémica y pulmonar). La investigación anatómica del corazón a través de una disección adecuada, la exploración histológica, el análisis de las imágenes obtenidas mediante el análisis radiológico y ecocardiográfico, estudios electrofisiológicos llevados a cabo con el mapeo electroanatómico tridimensional y con resonancia magnética cardíaca por tensor de difusión muestran el trayecto continuo muscular que circunscriben los dos ventrículos.
- Al poder desenrollar al miocardio y obtener un grosor similar en toda la extensión del músculo se evidencia que su continuidad es real. Enrollado se encuentra que el grosor del ventrículo derecho es menor que el del ventrículo izquierdo, ya que el primero se halla compuesto por una sola lazada del músculo (lazada basal), mientras que el segundo presenta adosamiento de las dos lazadas (basal y apexiana).
- Su disección siempre llega al mismo punto de desplegamiento. La pregunta es la siguiente: ¿cómo se pueden emprender disecciones con un resultado tan reproducible y no aceptar esta prueba anatómica de la continuidad miocárdica dispuesta en hélice?
- Su función lo lleva a tener un punto de apoyo como cualquier músculo esquelético, tanto en su origen como al final. Si el miocardio no tuviese esta conformación anatómica espacial en hélix, si no contase con una inserción en sus extremos situada en la base cardíaca y no permaneciese libre en el ápex, o sea péndulo en el tórax, y además no presentase una estimulación que le permite su torsión y su detorsión, no podría cumplir con su extraordinaria potencia muscular. La ecocardiografía con las técnicas de speckle tracking ha demostrado los movimientos de acortamiento y alargamiento durante las fases sistólica y de succión respectivamente. Para el cálculo del giro o twist el algoritmo de los ecocardiógrafos realiza una resta algebraica (suma el valor de la rotación positiva del ápex al negativo de la base) (ver Proposición 4: “Aportes de la ecocardiografía y de la resonancia magnética cardíaca al estudio del corazón helicoidal”). En sujetos normales en nuestra experiencia es de alrededor de +19 ± 9º, predominando siempre la rotación de la punta.
Richard Lower en 1669 consideraba que el miocardio estaba sometido a un movimiento de torsión relacionado con las fibras helicoidales que componían sus fibras. Expresaba que el corazón ejercía un movimiento similar a “estrujar una toalla”. Este concepto fue posteriormente estudiado y comprobado en humanos y ratones por Henson (61), en estudios electrofisiológicos y por las imágenes (ecocardiografía, resonancia). El corazón logra la expulsión de su contenido mediante la torsión de sus paredes y el inicio de su lleno a través de la detorsión. El movimiento de torsión sincrónico con el acortamiento longitudinal ventricular puede ser explicado a través de la disposición helicoidal y la continuidad del músculo cardíaco. - Los trígonos no presentan inserción de cardiomiocitos, lo cual confirma que el único amarre del miocardio es el fulcro.
- La disección miocárdica, el análisis histológico y la función cardíaca no se correlacionan con una conformación en malla.
En los antecedentes de estas investigaciones se han utilizado procedimientos de imágenes que han cercado su resolución, pero que, al no actuar sobre la anatomía y la histología en forma directa, han postergado definir descripciones primordiales en su conformación y relación con la función. En esta investigación se han utilizado corazones frescos de bóvidos y humanos para obtener descripciones detalladas con el fin de dilucidar la verdadera arquitectura miocárdica espacial.
Conclusiones. En resumen, con lo expresado anteriormente hallamos que la orientación y el movimiento de rotación opuesto de las fibras en el corazón, tanto a nivel de la base como del ápex, justifican el modelo del miocardio helicoidal continuo. Sin embargo, la pregunta que surge desde la lógica del movimiento es que, para lograr la torsión y la consecuente detorsión, los segmentos musculares que conforman en continuidad a las cámaras ventriculares deberían efectuarlo sobre un punto de apoyo al igual que un músculo esquelético lo hace en una inserción firme.
Como se observa en la figura 71, el anillo aórtico no es continuo. En un sector de su circunferencia, ubicado entre los extremos de los trígonos, se halla interrumpido y es aquí donde se inserta la valva anterior de la válvula mitral. El cordón pulmotricuspídeo se halla ubicado por delante de una zona que rodea los dos tercios anteriores de la circunferencia del anillo aórtico en forma de U, cuyo extremo abierto (posterior) está ocupado por la valva anterior de la mitral. En sus extremos este tejido tiene dos trígonos. El trígono fibroso derecho (cuerpo fibroso central) es el más prominente y se localiza entre los orificios tricúspide (derecha), aórtico (posterior) y cordón pulmotricuspídeo (anterior). El izquierdo, menos prominente, se ubica entre el orificio mitral (izquierda) y la aorta. En la continuidad del orificio aórtico con la valva posterior de la mitral no hay tejido conectivo, ya que lateralmente los dos cuerpos fibrosos se continúan por una banda conjuntiva que rodea el orificio de la válvula mitral parcialmente para luego desvanecerse progresivamente. La valva septal de la mitral se halla ubicada entre ambos trígonos como una cuña y puede ser considerada una extensión del endocardio auricular.
Nuestras investigaciones han demostrado, en el trayecto del segmento septal del anillo aórtico que se extiende desde el trígono izquierdo al derecho, la presencia de un núcleo sólido que hemos denominado fulcro cardíaco (por debajo del origen de la arteria coronaria derecha), donde se amarra el miocardio continuo en su inicio y al final, que como todo músculo necesita un apoyo para cumplir con su función.
Se consideró, desde hace tres siglos, que las fibras del miocardio se insertan en el esqueleto fibroso del corazón. El desarrollo de la anatomía expuesto hacia 1970 por Torrent Guasp avizoró que el miocardio se inicia y finaliza en la base de los grandes vasos, pero el anclaje de las fibras no se realiza en los anillos auriculoventriculares, sino que simplemente se adosa, tal como confirman las imágenes obtenidas mediante resonancia magnética por tensor de difusión. En nuestras investigaciones anatómicas encontramos el núcleo denominado fulcro cardíaco donde se inserta en ambos extremos el miocardio helicoidal. Por otra parte, no hemos encontrado inserción de los cardiomiocitos en la matriz colágena de los trígonos, aseverando este hallazgo.
Torrent Guasp consideraba que el miocardio carece de un punto de apoyo fijo como los que ostenta el sistema muscular para cumplir su función de fuerza. En este sentido analizaba que funcionaría como lo hace la musculatura circular de las arterias, y por lo tanto se apoyaría sobre el propio contenido de la cavidad (hemoesqueleto). En nuestra investigación siempre consideramos que debía existir una fijación en el miocardio que le permitiese rotar en hélice para cumplir sus movimientos y la fuerza muscular fundamentales de acortamiento-torsión y alargamiento-detorsión. Esta situación de investigar un apoyo en el miocardio continuo tiene correlación con una máquina orgánica como es la cardíaca que, sin un sólido amarre a un núcleo resistente, carecería de las facultades mecánicas necesarias para su considerable potencia.
La musculatura que conforma el ventrículo derecho corresponde al inicio del miocardio continuo (segmento derecho) que nace en el fulcro cardíaco. Al divergir el segmento derecho en dos grupos principales de fibras, formando los haces paraepicárdico y paraendocárdico, se delimita un rafe entre ellas denominado cordón pulmotricuspídeo, ubicado entre la arteria pulmonar y la válvula tricúspide. Con relación a los haces musculares autóctonos que constituyen el ventrículo izquierdo, el segmento ascendente finaliza en la base de la aorta. Recordemos que el segmento descendente se halla continuo entre los segmentos izquierdo y ascendente, sin ninguna sujeción al fulcro. Antes de fijarse en este, el segmento ascendente se reúne en un haz cuyas fibras más externas forman una curvatura para alcanzar esta sujeción. Las fibras más internas ingresan directamente sin describir ningún sesgo. El fulcro cardíaco constituye un punto sólido en el amarre de dicho segmento en dicha estructura.
Este punto de fijación implica, como en todo músculo, ejercer la función de apoyo de la palanca muscular y además le permite actuar de cojinete o almohadilla, evitando que la fuerza de rotación ventricular, sea por torque o esfuerzo de torsión, se traslade a la aorta, logrando disipar de esta forma la energía que produce el movimiento del hélix muscular e impidiendo generar un estrangulamiento en la arteria o que se acode durante el período de eyección sistólica (205, 211, 216, 217).
En los corazones humanos investigados los hallazgos son sorpresivos desde la interpretación, partiendo de la base de que es lógico considerar su presencia en toda la cadena evolutiva de los mamíferos. Se debe considerar que esta estructura, al analizarse en los distintos especímenes, tiene en común su función de dar sostén al miocardio helicoidal para poder generar la potencia que necesita cualquier músculo, la cual es diferente en los distintos mamíferos. Por lo tanto, su presencia es constante en todos los corazones estudiados tanto de bóvidos como humanos, pero su característica estructural es distinta. Y esta diferencia en el análisis íntimo del fulcro cardíaco está indudablemente relacionada con la resistencia que debe oponer a la acción energética del miocardio en corazones de portes diferentes.
El hecho importante proviene de la observación tanto macroscópica como microscópica que demuestra el amarre de las fibras miocárdicas a ese núcleo sólido, homogéneo. Su conformación fue corroborada por histología. Esta estructura, origen y fin del miocardio continuo helicoidal la hemos denominado fulcro cardíaco, en un paralelismo y homenaje con la designación del punto de apoyo para ejercer una palanca expresada por Arquímedes de Siracusa (Grecia, 288 a. C.-212 a. C.). Es de destacar que para visualizar el fulcro cardíaco resulta de rigor desplegar al miocardio helicoidal. En la figura 23 se puede observar la localización del fulcro cardíaco en el modelo de la cuerda que simplifica la comprensión del miocardio helicoidal.
6. Pared libre de los ventrículos
Ventrículo derecho. La pared se halla constituida por dos contingentes de fibras musculares (figura 16) que se cruzan en su trayecto en equis. Uno es el fascículo derecho paraepicárdico que, procedente del surco interventricular posterior, desciende hacia el ápex. El segundo es el fascículo derecho paraendocárdico que, desde la base de la arteria pulmonar, se extiende hasta el surco interventricular posterior. Entre ambos haces se detallan otras fibras intermedias que van sesgando su dirección gradualmente de acuerdo con el plan espiralado del miocardio en su integridad funcional.
El fascículo derecho paraepicárdico de orientación predominantemente transversal define el orificio tricuspídeo por detrás y lateralmente. Se halla constituido por dos bandas: una, la ventral, llamada banda septal anterior, finaliza en el cordón pulmotricuspídeo; la segunda, dorsal, denominada banda septal posterior, termina en el borde del orificio tricuspídeo y en la pared libre del ventrículo derecho. Entre ambas, en sus inserciones terminales, queda delimitada una pequeña área de base superior tricuspídea que constituye el septum membranoso (figura 65).
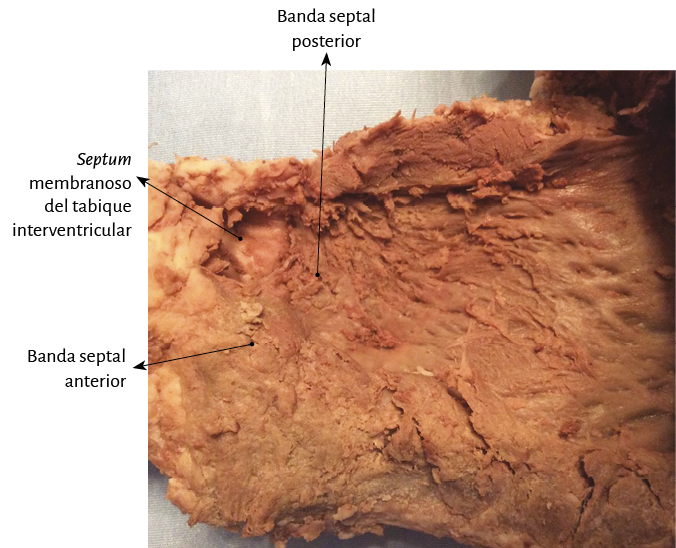
Figura 65. Pertenecientes al segmento derecho, al divergir, estas bandas delimitan junto al borde de la válvula mitral un orificio triangular ocupado por el septum membranoso.
Si se reseca el fascículo derecho paraepicárdico, se observa más profundo el fascículo derecho paraendocárdico, de predominio oblicuo en su dirección, que también consta de dos grupos de fibras: 1) la banda pulmonar, y 2) la banda del tabique (también llamada del puente). Esta última termina en el tabique interventricular constituyendo, además, parte de un rafe, el cordón pulmotricuspídeo, en un trayecto ubicado entre la arteria pulmonar y la válvula tricúspide, determinado por el recorrido divergente del haz paraepicárdico (de nacimiento posterior) y del haz paraendocárdico (de origen anterior), ambos originados en el fulcro cardíaco (figura 17).
Con esto se define que la estructura muscular del ventrículo derecho (segmento derecho), constituido por cuatro contingentes de fibras (pulmonar, del tabique, septal anterior y septal posterior), se origina por delante del segmento ascendente, en la porción anterior del fulcro cardíaco, dando origen al miocardio continuo.
En síntesis, la pared del ventrículo derecho tiene un espesor que llega a la mitad de la del ventrículo izquierdo y no produce un mecanismo de torsión. El componente longitudinal predomina sobre el circunferencial; de hecho, prácticamente todos los métodos de evaluación de la función del ventrículo derecho (salvo el volumétrico tridimensional) se basan en parámetros longitudinales (desplazamiento sistólico del plano del anillo tricuspídeo –TAPSE–, velocidad del Doppler tisular, strain longitudinal de su pared lateral) (160, 169). Hasta en el cálculo de la fracción de acortamiento del área el componente fundamental es longitudinal. Sin embargo, por medio de resonancia magnética cardíaca con secuencias de marcaje miocárdico con técnica DENSE se ha podido comprobar que existe cierta rotación en el ventrículo derecho. ¿Cómo explicarlo si no existen fibras oblicuas, puesto que el ventrículo derecho está conformado a expensas de la lazada basal? Se puede explicar a través de la transmisión de la torsión que ejerce el ventrículo izquierdo sobre el derecho, sobre todo a nivel del septo interventricular. De hecho hay trabajos que ponen de manifiesto la repercusión que la afectación del ventrículo izquierdo ejerce sobre el ventrículo derecho por este mecanismo. Al referirnos a las fibras “interbandeletas” (195) detallamos que la función que posiblemente tengan es el arrastre del ventrículo derecho acompañando el movimiento del segmento ascendente durante la torsión sistólica. Es lo que vemos en cirugía cardíaca.
Ventrículo izquierdo. Al abordar la disección a través de la pared libre en su porción anterolateral se encuentran los segmentos descendente y ascendente adosados (figura 66). En un corte transversal cardíaco (figuras 67 y 68), por debajo de las válvulas auriculoventriculares, podemos observar que el segmento descendente se halla en situación interna rodeado por el segmento ascendente en la pared libre del ventrículo izquierdo y por las bandas septales (anterior, posterior e intraseptal) a nivel del septum. Ambos segmentos cursan movimientos opuestos, tanto en sístole como en diástole, para lograr la expulsión y la succión del contenido hemático ventricular generando una fricción entre sus superficies, tema que después se abordará en detalle. La histología de la figura 66 muestra con claridad la diferente orientación de las fibras del segmento descendente con relación al ascendente, lo que explica los movimientos contrarios que presentan. La disposición de las fibras miocárdicas en el epicardio y endocardio, cuyo cambio de angulación de 180º, hace que las epicárdicas estén dispuestas en sentido opuesto a las endocárdicas.
Además, debemos entender que hay fricción entre dichos segmentos miocárdicos a lo largo de todo el espesor miocárdico y que la rotación en direcciones diferentes del endocardio y el epicardio no es absolutamente simultánea. De modo que la rotación mesocardio-epicárdica se produce con un ligero retraso respecto del endocardio y es la que predomina por su mayor radio.
En la parte posterior del ventrículo izquierdo se encuentra el segmento izquierdo (lazada basal) que contornea a la válvula mitral en forma transversal para continuarse con el segmento descendente (lazada apexiana). Ambos segmentos son intermedios, ya que no corresponden al origen del miocardio continuo (segmento derecho) ni a su finalización (segmento ascendente). El segmento izquierdo es el que cubre la parte posterior de la pared ventricular izquierda.
Esta disposición se observa bien en la modelización lograda en nuestra investigación y en la disección de la pared ventricular izquierda, en donde el segmento descendente es interno (endocárdico) con relación al segmento ascendente (epicárdico). Cuando se hace la investigación con una sección a lo largo del ventrículo izquierdo se puede comprobar que ambos segmentos se cruzan oblicuamente. En el extremo superior de su trayecto el segmento ascendente discurre aislado para amarrarse al fulcro (figuras 66-69).
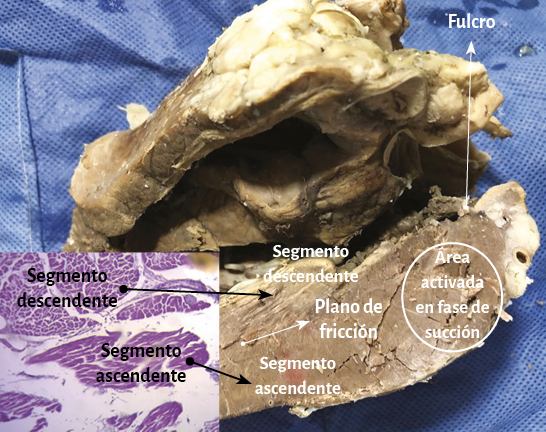
Figura 66. Sección longitudinal del ventrículo izquierdo. Se observan los segmentos descendente y ascendente adosados. En círculo se señala la parte terminal del segmento ascendente, el que discurre aislado para amarrarse al fulcro cardíaco. Esta área se activa en la fase de succión cardíaca. En la histología se muestra la diferente orientación de las fibras longitudinales (segmento ascendente) con relación al descendente (fibras transversales) (corazón de bóvido).
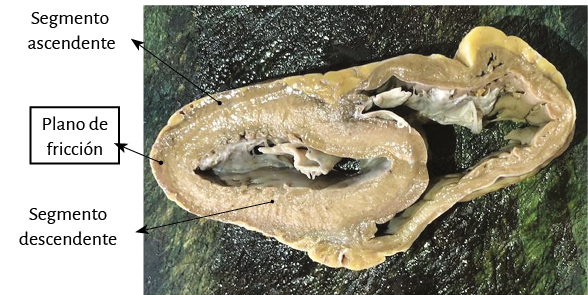
Figura 67. Sección transversa de los ventrículo derecho e izquierdo (corazón humano). Se muestra el plano de fricción entre los segmentos ascendente y descendente.

Figura 68. Sección transversal de ambos ventrículos (corazón humano).Las flechas blancas indican el sentido del movimiento de cada segmento en sístole. La flecha naranja señala el plano de fricción entre ambos segmentos.
Al abordar la disección epicárdica del segmento ascendente (ventrículo izquierdo) se hallan dos grupos de fibras constituidos por haces musculares en sentido ascendente. Un contingente se orienta hacia el trígono izquierdo, tomando la denominación clásica de banda del trígono izquierdo. El segundo grupo de fibras musculares sigue una dirección paralela a la anterior y cuando discurren en el surco interventricular anterior pasan entre el ventrículo derecho y el tabique hasta alcanzar a la aorta, cursando por debajo de un grupo de fibras llamadas transversales. Este fascículo toma la denominación de banda del trígono derecho. En nuestras investigaciones en corazones de bovinos y humanos hemos encontrado, tal como lo hemos visto a lo largo de toda esta investigación, que el segmento ascendente a través de sus dos haces (banda del trígono derecho e izquierdo) se inserta en el fulcro cardíaco. Los trígonos se apoyan en la parte posterior de la aorta, mientras que por debajo de esta y del nacimiento de la coronaria derecha, en su parte anterior, se halla el fulcro cardíaco. Como hemos visto en esta Proposición, los trígonos no tienen ningún amarre con el miocardio.
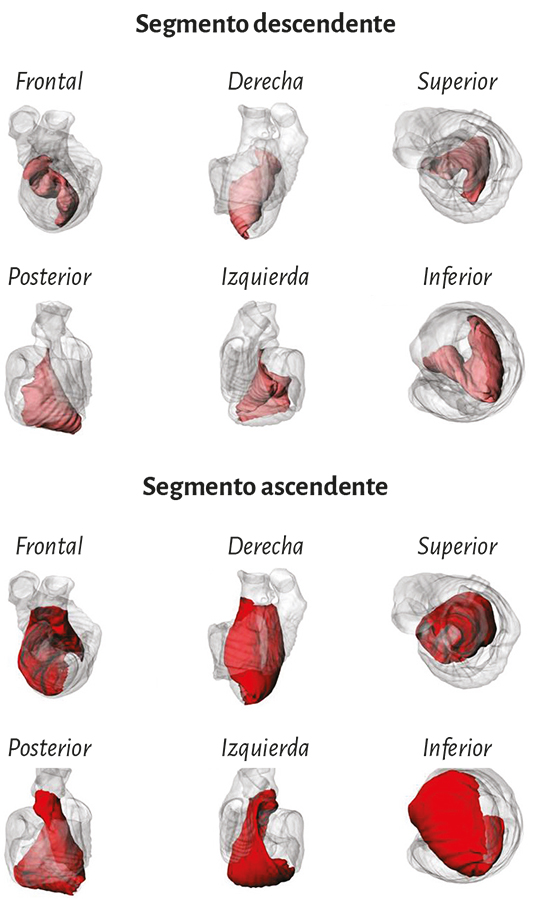
Figura 69. Modelización de la banda miocárdica.
En la figuras 6 y 32 se muestran los segmentos descendente y ascendente diseccionados, observándose las fibras en espiral de acuerdo con la estructura helicoidal. Se advierten en detalle las fibras musculares de los segmentos descendente y ascendente, las cuales se orientan con el fin de lograr el efecto mecánico de torsión ventricular, a través de su dirección espiralada (199). Las fibras del segmento descendente en la cara anterior del ventrículo izquierdo transcurren en profundidad por el mesocardio cruzándose oblicuamente y en posición interna con las del segmento ascendente (figura 66), de ubicación externa. Para una síntesis de los fascículos que componen el miocardio continuo pueden observarse la figura 70 y el cuadro 1.
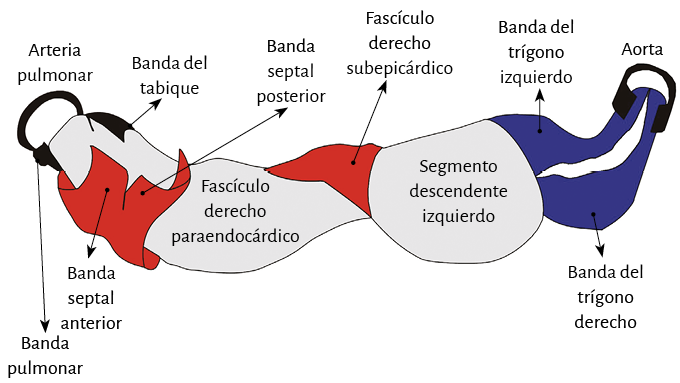
Figura 70. Composición del miocardio continuo.
Cuadro 1
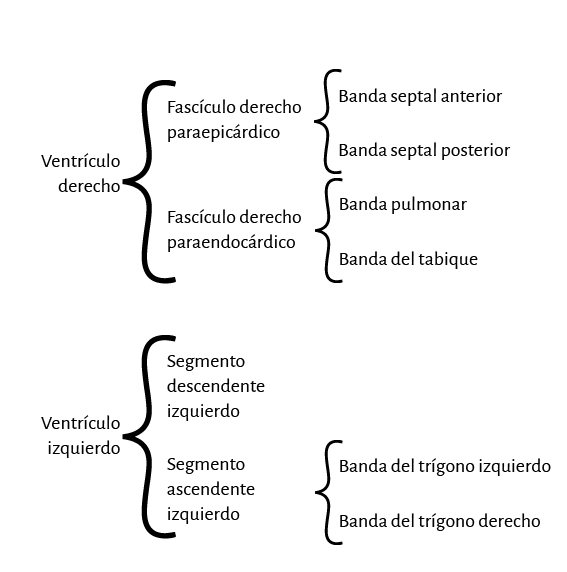
Fibras interbandeletas. No todas las fibras de la banda del trígono derecho, pertenecientes al segmento ascendente, pasan a ser intraseptales. Las más superficiales, saltando el surco interventricular anterior, en vez de continuar su camino intraseptal hacia el final de la banda en la raíz aórtica, concurren a tapizar la pared libre del ventrículo derecho y llegan a la cara anterior del ventrículo izquierdo luego de cruzar por el surco interventricular posterior. Estas fibras quedan limitadas en todo su recorrido por la base ventricular que comprende los anillos de la válvula pulmonar, el tricuspídeo y el mitro-aórtico. Además, un grupo de estas fibras antes de llegar a la aorta, rodean la raíz de la arteria pulmonar (figura 19). Estos haces musculares fueron denominados por Torrent Guasp “fibras aberrantes”. Incluso dejó señalado: “Por su disposición en el espacio recubren a la lazada basal en toda su extensión, envolviendo por tanto a ambos ventrículos” (173, 174). Torrent Guasp creía que la función de estas fibras era lograr el desplazamiento de las paredes de los ventrículos derecho e izquierdo para conseguir el ensanchamiento de las cavidades. Terminaba su relato expresando con cierto escepticismo: “Este ensanchamiento tiene, por su relativa escasa magnitud, menos importancia de la que siempre le ha sido atribuida” (174). Nosotros las hemos denominado “fibras interbandeletas” (195) ya que es posible que cumplan la función de arrastrar al ventrículo derecho tras el movimiento del segmento ascendente durante la torsión sistólica. Esta situación se observa con facilidad en la contemplación del movimiento del corazón durante el curso de la cardiocirugía.
La figura 71 permite distinguir a los trígonos en la raíz de la aorta. Al retirar la valva septal de la mitral, que se halla ubicada entre ambos trígonos, se observa en detalle los trígonos derecho e izquierdo, de carácter fibroso. En cambio, la valva posterior de la mitral se considera una extensión del endocardio ventricular. Sobre la cara anterior de la aorta y por debajo se halla el fulcro cardíaco.
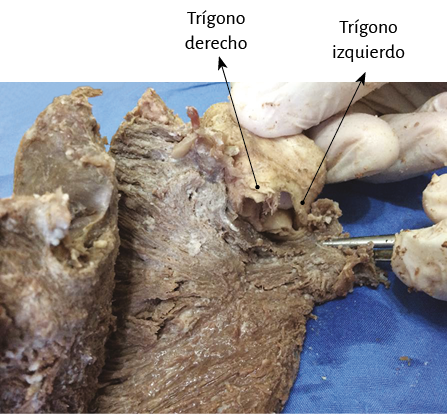
Figura 71. Para una mostración más precisa de los trígonos se ha resecado la valva septal de la mitral, que cabalga entre ambos, quedando bien individualizados los trígonos. En ellos, de matriz colágena, no se amarran cardiomiocitos como queda demostrado por histología en nuestras investigaciones (figura 57).
En síntesis, el miocardio está constituido por tres regiones: 1) pared libre del ventrículo derecho; 2) pared libre del ventrículo izquierdo, y 3) tabique interventricular. La pared del ventrículo derecho la constituye el segmento derecho de la lazada basal, mientras que la del izquierdo la conforman tanto la lazada basal (segmento izquierdo) como los segmentos descendente y ascendente de la lazada apexiana; de ahí el menor espesor en la pared del ventrículo derecho (observación con el corazón plegado).
El tabique interventricular consta de una parte ventral y otra dorsal. La primera porción la componen el segmento descendente izquierdo, la banda intraseptal (segmento final de la banda muscular) y la banda septal anterior. Los dos primeros pertenecen al ventrículo izquierdo y el restante, al ventrículo derecho. La región posterior del tabique está compuesta por el segmento descendente izquierdo (dependencia del ventrículo izquierdo) y la banda septal posterior, correspondiente al ventrículo derecho.
La disposición espacial y el movimiento de rotación de las fibras ventriculares hallan coherencia con el plan arquitectónico del miocardio. Se ha hecho hasta el momento una interpretación funcional cardíaca que no guarda correlación con su dinámica muscular. Y esta, en última instancia, es el motor de la circulación establecida por el miocardio continuo. Esta disposición espacial del corazón, fundamentalmente a nivel de los segmentos descendente y ascendente, es la que le otorga los movimientos de acortamiento-torsión y alargamiento-detorsión, imprescindibles para la función cardíaca.
7. El mecanismo de fricción en la torsión-detorsión miocárdica
Es elemental conjeturar que el movimiento contrapuesto de los segmentos ascendente y descendente (192-198), como asimismo de este último segmento contra la zona septal del miocardio continuo (bandas septales anterior, posterior e intraseptal), debe generar una fricción entre sus superficies de deslizamiento en sus movimientos de torsión (sístole) y detorsión (succión) (figuras 66-68).
Incluso esta disposición de segmentos superpuestos se observa bien en la modelización lograda en nuestro estudio tridimensional (figura 69) (220). El deslizamiento entre segmentos internos y externos del miocardio asume direcciones contrarias en sus movimientos, durante las fases del corazón sistólica y de succión, generando una fricción. Es dable entender que el rozamiento de los segmentos implica desde la física también una oposición al movimiento. Tal como lo expresa la primera ley de Newton, la fricción limita la continuidad temporal del movimiento. El modelo de la malla miocárdica (2, 98, 99) es incompatible con los movimientos opuestos de estos segmentos productores de la torsión ventricular, situación comprobada por la técnica del speckle tracking que ha desarrollado la ecocardiografía (111, 112). Ahora bien, para cumplir con esta dinámica ha sido crucial interpretar que existe un punto de apoyo del miocardio, como lo hemos demostrado en esta Proposición a través de investigaciones anatómicas e histológicas.
Sabemos que la estructura en hélice de la continuidad miocárdica permite ejecutar la dinámica de la torsión-detorsión ventricular. Los trabajos anatómicos, la prosecución del conocimiento de la dinámica cardíaca a través del recorrido del impulso eléctrico y los estudios ecográficos con la rotación ventricular corroboran la relación estructura-función del corazón.
La torsión ventricular representa la necesidad funcional que hace que las fibras del corazón adopten una forma similar al número 8. Se manifiesta en una deformación del miocardio en sus tres radios: longitudinal, circunferencial y radial en dependencia de las fibras orientadas de manera helicoidal. El estudio de esta rotación es un potencial marcador de la severidad de la enfermedad del miocardio cuando sus giros se apartan de los valores normales. La torsión ventricular puede constituirse en un marcador apropiado del estado del corazón, incluso superior a la clase funcional y a la fracción de eyección, en la comprensión de la insuficiencia cardíaca (38, 166).
En sístole se contraen los tres radios cardíacos torsionando a la masa muscular, la cual es “exprimida como una toalla”, para lograr la acción expulsiva. Para analizar esta acción ha sido fundamental la comprensión del recorrido del estímulo en el miocardio continuo, el cual explica los movimientos cardíacos. En la fase de succión, durante los primeros 100 ms de la diástole, se alarga el radio longitudinal y posteriormente con el lleno ventricular se expande y destorsiona, aumentando su radio circunferencial y radial (Proposición 2). La anatomía del miocardio helicoidal, la torsión ventricular, la fricción y el vórtice sanguíneo expulsivo intraventricular se correlacionan en la explicación secuencial de la dinámica cardíaca.
Deslizamiento intramiocárdico. Debe haber un mecanismo de antifricción que evite la disipación de la energía durante el deslizamiento de los segmentos miocárdicos durante los movimientos de torsión-detorsión. ¿Existe una base histológica que explique este hecho? ¿Los conductos de Thebesius y Langer juegan un papel en este mecanismo? ¿Es posible que haya en el miocardio una fuente de lubricante orgánico?
Francisco Torrent Guasp creía que podría hallarse una membrana elástica que limitara la fricción evitando un excesivo gasto de energía. Por su parte, Luis Becú, en una carta personal enviada a Torrent Guasp en 1996, le comunicaba una subyugante idea: “[Los] fascículos de músculo unos sobre otros pero en orientaciones discordantes han sido objetados de diversas maneras, pero una objeción básica es que si fuese cierto la fricción entre ellos sería grande, calorífera y derrochante de energía… lo que nos haría falta un mecanismo lubricante antifricción… [hay] un vasto sistema de espacios sanguíneos planos y lacunares dispuestos útilmente en los resquicios entre láminas y bandas de tejido muscular […] tienen amplia comunicación con las venas coronarias [… ]y lo que es mucho más significativo e interesante con la luz de ambos ventrículos a través de las fantasmales venas de Thebesius” (200, 207).
Durante la investigación emprendida fuimos considerando que el mecanismo de antifricción podría estar generado por el contenido laxo “en esponja” del miocardio con corrientes de sangre transmural (sinusoides), rudimentos del corazón evolutivo y embrionario, en el que las venas de Adam Thebesius (anatomista alemán, 1686-1732) (167) y las descriptas por Karl Langer (Viena, 1819-1887) (85) jugarían un papel fundamental (sistema hidráulico). Estas conexiones coronario-ventriculares estudiadas también por Vieussenius (1715), Minot (1900), Lewis (1904), Grant (1926), Wearn (1928), reducirían el estrés de cizallamiento entre las superficies musculares en los movimientos de torsión-detorsión ventricular (95).
Estos conductillos venosos se originan desde venas intramiocárdicas (Thebesius) o desde tributarias de la vena coronaria mayor (Langer), atraviesan el miocardio y desaguan en las cavidades cardíacas (figura 72). Obviamente las que lo hacen en la cámara ventricular izquierda desoxigenan la sangre que proviene de los pulmones. De hecho, esto determina un mayor tenor de oxígeno en la sangre de la aurícula izquierda que en el correspondiente ventrículo. Aquí surgen preguntas esenciales: ¿por qué esos conductos venosos juegan una función que sería contraproducente para el organismo al desaturar la sangre arterializada?, ¿cuál es su verdadero papel? Se consideró, en los primeros estudios sobre estos conductos, que podrían suplir la oxigenación del miocardio ante la oclusión de las arterias coronarias.
En este aspecto, el hallazgo en las investigaciones que hemos realizado en corazones de bóvidos y humanos de ácido hialurónico (figuras 73-79) en la estructura lacunar entre los haces miocárdicos, aunado a los conductos venosos de Thebesius y Langer como tributarios de la hidratación necesaria a dicho elemento, podría clarificar este aspecto de lubricar y de este modo contrarrestar el rozamiento de las superficies, ejerciendo un mecanismo antifricción. De hecho, entre los distintos segmentos no hay una membrana específica de deslizamiento, sino superficies de fricción (figura 119) atravesada por un sistema esponjoso que cubre todo el miocardio y en donde el ácido hialurónico con su capacidad lubricante facilita el deslizamiento entre ellos (212).
Figura 72. Conductos venosos intramiocárdicos (corazón bovino). Técnica de hematoxilina-eosina (15x).
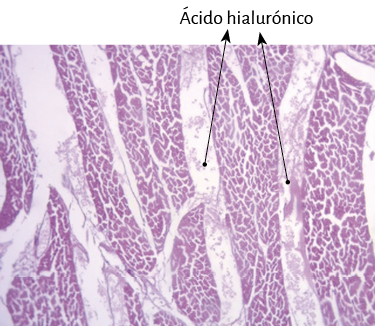
Figura 73. Venas transversales dilatadas en un entorno de relajación muscular con técnica de coloración Alcian blue stain (15x). Las flechas marcan el ácido hialurónico (corazón humano adulto).
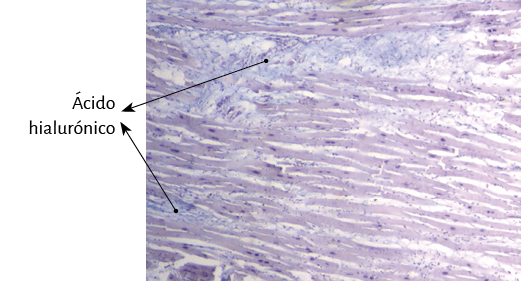
Figura 74. Intersticio entre miocardiocitos marcando el ácido hialurónico teñido de celeste con tinción de Alcian blue (15x) (corazón humano adulto).
Figura 75. Ácido hialurónico teñido con Alcian blue (15x) (corazón humano adulto).
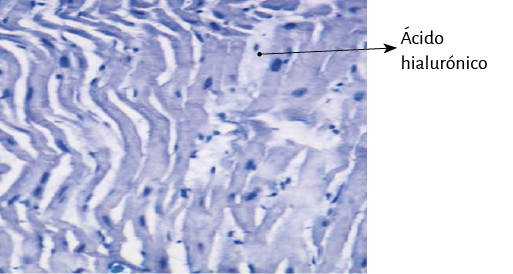
Figura 76. Ácido hialurónico teñido con Alcian blue (15x) (corazón humano adulto).
Aparecido en los primeros animales cordados, el ácido hialurónico es abundante en los tejidos conectivos (93). La mitad del ácido hialurónico se encuentra en la piel y el 25% en los huesos y articulaciones. Debido a su capacidad para unir agua es un excelente lubricante y aporta una gran resistencia a presiones mecánicas (68). Ayuda a crear la trama de la matriz extracelular mediante sus interacciones con los proteoglicanos o el colágeno. Cuando está muy concentrado puede interaccionar consigo mismo creando mallas o entramados que le aportan al tejido propiedades viscoelásticas. Durante el desarrollo ayuda a la morfogénesis de estructuras embrionarias. Por ejemplo, se puede liberar desde la parte basal de los epitelios y producir la curvatura en estos, debido a la gran cantidad de agua que atrae (11).
Esta asociación funcional entre los conductos venosos de Thebesius y Langer, junto a la cantidad apreciable de ácido hialurónico encontrado en nuestras investigaciones en corazones humanos y de animales, conociendo además el papel lubricante que posee en el resto del organismo, podría ser crucial en la comprensión de la dinámica del corazón. De esta manera se correlaciona la torsión ventricular con un mecanismo de lubricación que facilita el deslizamiento de los segmentos miocárdicos para evitar una pérdida de energía. A través de estos conductos venosos y por la contracción helicoidal, el fluido plasmático con ácido hialurónico sería impulsado en forma continua a través de una rica trama capilar. Hemos hallado en la investigación, entre los miocardiocitos, espacios con malla capilar y un fluido plasmático rico en ácido hialurónico.
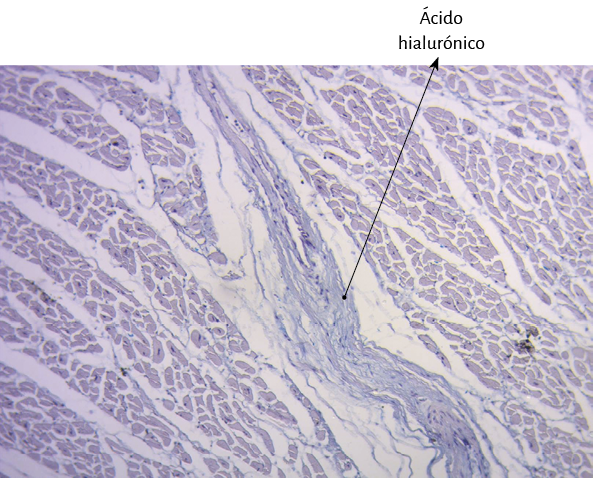
Figura 77. Vena transversal contraída con intersticio perivenoso edematoso Alcian blue positivo. Obsérvese en el intersticio entre los miocardiocitos el ácido hialurónico teñido con Alcian blue (15x) (corazón bovino).
Figura 78. Miocardiocitos embebidos o rodeados por plasma con tinción positiva para Alcian Blue que indica ácido hialurónico (15x) (corazón bovino).
Figura 79. Miocardiocitos con intersticios teñidos de celeste con técnica de Alcian Blue (15 x) (corazón bovino).
8. Proposición 1: resumen
Se presenta la investigación anatómica del miocardio helicoidal a través de disecciones adecuadas que logran desplegarlo en toda su extensión con análisis macroscópico e histológico. Esta Proposición hace mención en primer término a los aspectos filogénicos del aparato circulatorio, un tema que permite comprender de alguna manera por qué el miocardio se encuentra representando fundamentalmente por el ventrículo izquierdo, pero además qué lugar ocupan el ventrículo derecho y las aurículas. El patrón de organización del sistema cardiocirculatorio implica la configuración de la interrelación entre sus partes intervinientes, lo cual define su esencialidad.
Posteriormente es analizada la estructura espacial tridimensional del músculo miocárdico como único, continuo y helicoidal, clarificando sus segmentos y la disposición de sus fibras. De manera conjunta se investiga la concordancia entre su estructura anatómica y los movimientos fisiológicos sucesivos y concatenados de estrechamiento, acortamiento-torsión, alargamiento-detorsión y ensanchamiento.
El ápex cardíaco es análisis de evidencias fundamentales sobre su organización helicoidal. Conformado únicamente por el ventrículo izquierdo, es una zona ubicada en el giro de los segmentos en el miocardio continuo. Lo atractivo de este análisis es que en el desplazamiento se constituye un espiral de capas musculares circularmente imbricadas, que permite ver cómo se delimita un túnel más virtual que real.
Entre los hallazgos que muestra la investigación se encuentra que la arquitectura del miocardio presenta un punto de soporte que es de la mayor importancia, denominado fulcro cardíaco. Es el apoyo del músculo cardíaco, el amarre en el comienzo y al final de las fibras del miocardio continuo. El fulcro es un núcleo cuya estructura histológica es diferente de acuerdo con los especímenes analizados en la investigación, ya que puede presentarse de carácter óseo, condroide o tendinoso. Sin este apoyo sería imposible para el corazón lograr su función de alta potencia al punto de eyectar la sangre a una velocidad de 200 cm/s.
Dentro del funcionamiento del miocardio aparece el mecanismo de fricción en los movimientos entre las capas musculares plegadas. Este proceso conlleva direcciones contrapuestas de los segmentos musculares y de estos contra la zona septal. El deslizamiento entre estos segmentos asume sentidos contrarios durante las fases del ciclo cardíaco (sístole y succión), generando una fricción. Para poder efectuar dicho trabajo existe un mecanismo lubricante de antifricción representado por los conductos venosos de Thebesius y Langer junto a la presencia de ácido hialurónico. Sin este mecanismo no podría ser posible la fricción entre los músculos ya que implicaría una gran merma de energía.
De esta manera esta Proposición 1 concluye que el estudio de la anatomía e histología del miocardio determinan un músculo continuo que describe un doble helicoide y que para cumplir su función muscular necesita de un punto de apoyo, el fulcro cardíaco. Pero, además, debe contar con un mecanismo de antifricción.