Capítulo I
Pinceladas del funcionamiento del sistema nervioso
«Los hombres deben saber que el cerebro es el responsable exclusivo de las alegrías,
placeres, risa y diversión, y la pena, aflicción, desaliento y las lamentaciones.
Y gracias al cerebro, de manera especial, adquirimos sabiduría y conocimientos, y
vemos, oímos y sabemos lo que es repugnante y lo que es bello, lo que es malo y lo
que es bueno, lo que es dulce y lo que es insípido... Y gracias a este órgano nos
volvemos locos y deliramos, y los miedos y terrores nos asaltan... Debemos soportar
todo esto cuando el cerebro no está sano... Y en este sentido soy de la opinión de
que esta víscera ejerce en el ser humano el mayor poder».
Hipócrates (siglo IV a. C.). Sobre las enfermedades sagradas.
Hoy en día sabemos que el sistema nervioso controla y regula la mayoría de las actividades
del organismo. La información de nuestro entorno es captada por diferentes tipos de
receptores sensoriales distribuidos ordenadamente por nuestro cuerpo, que recogen
y envían la información para que sea procesada e integrada por nuestro sistema nervioso
central. De igual modo, constantemente se están poniendo en marcha los cuidadosos
planes motores que se desarrollan en nuestro cerebro y que finalmente llevan a la
coordinación de diversos grupos musculares para permitir un determinado movimiento.
El cerebro recibe, integra, procesa la información y envía diferentes señales para
regular múltiples funciones en el organismo, desde la puesta en marcha de la propia
conducta hasta la regulación de distintos mecanismos homeostáticos y de los sistemas
endocrino e inmunológico. El sistema nervioso no solo establece un puente de unión
entre la información proveniente del medio y la respuesta que el organismo da para
adecuarse a las demandas cambiantes del entorno, sino que nos convierte en lo que
somos, subyace a nuestras emociones, a la resolución de problemas, a la inteligencia,
al pensamiento, a capacidades tan humanas como la motivación y el placer, el lenguaje,
la atención, o los mecanismos de aprendizaje y memoria.
En primer lugar, vamos a hacer una recorrido general por las células que conforman
el sistema nervioso para, finalmente, esbozar unas pinceladas de su organización anatomofuncional.
1. Las neuronas
«[Las neuronas son] células de formas delicadas y elegantes, las misteriosas mariposas
del alma, cuyo batir de alas quién sabe si esclarecerá algún día el secreto de la
vida mental».
Santiago Ramón y Cajal
Las neuronas son células especializadas que reciben, procesan y transmiten la información
con gran especificidad y exactitud, permitiendo la comunicación entre diferentes circuitos
y sistemas. Para ello, estas células nerviosas deben tener propiedades químicas y
eléctricas determinadas que puedan posibilitar los procesos de transmisión de la información.
A lo largo de este apartado veremos que se conjugan dos tipos de señales: a) los mecanismos
eléctricos de comunicación y señalización que sirven para transmitir la información
de una parte a otra dentro de la misma neurona (potenciales locales y potencial de
acción), y b) los mecanismos químicos que son utilizados para transmitir la información
entre células diferentes (liberación de la sustancia trasmisora o neurotransmisor).
En las neuronas, los mecanismos de señalización son eléctricos y químicos: las señales
eléctricas se utilizan para transmitir la información de una parte a otra de la neurona,
mientras que las señales químicas se utilizan para trasmitir la información de una
neurona a otra.
En relación con su estructura interna, se ha podido comprobar que las neuronas comparten
los mismos elementos y la misma información genética que el resto de las células del
organismo, además de llevar a cabo las funciones básicas celulares, al igual que sucede
en las células hepáticas o las musculares, por ejemplo.
¿Es cierto que el encéfalo gasta más energía que cualquier otra parte de nuestro cuerpo?
Las células nerviosas tienen requerimientos energéticos muy elevados. El encéfalo
utiliza el 20 % del total del oxígeno corporal y una fracción comparable de glucosa.
Además, las reservas energéticas en el encéfalo son limitadas y resulta de cardinal
importancia asegurar su aporte de una manera continua. Por ese motivo, se dispone
de estrategias diferenciales para las células nerviosas que no se utilizan en otro
tipo de células. Por ejemplo, en este sentido las células del sistema nervioso son
las únicas células que pueden utilizar la glucosa en situación de ayuno. Durante el
ayuno, el descenso de glucosa es detectado por las células del páncreas y del encéfalo,
se deja de liberar insulina y se empieza a secretar glucagón (dos hormonas del páncreas
endocrino). El glucagón estimula la formación de glucosa a partir del glucógeno que
tenemos almacenado. Asimismo, el glucagón también facilita que las reservas de grasa
se descompongan en ácidos grasos y glicerol para ser utilizadas por las células de
nuestro cuerpo. Las únicas células que no utilizan los productos derivados de las
reservas de grasa son las cerebrales, ya que necesitan glucosa. ¿Cómo es posible que
las células de fuera del sistema nervioso sean tan «benévolas» que cedan la poca glucosa
que hay en el organismo para que sea utilizada exclusivamente por las células nerviosas?
El caso es que no tienen más remedio: las células de fuera del sistema nervioso necesitan
la insulina para transportar la glucosa dentro de la célula, y en situaciones de ayuno
el páncreas endocrino libera glucagón para aumentar los niveles de glucosa en sangre,
y los niveles de insulina son mínimos. Por este motivo, las células del sistema nervioso
son las únicas que pueden utilizar la glucosa en situación de ayuno, dado que no necesitan
la insulina para transportar la glucosa al interior de la célula.
Se calcula que existen en torno a ochenta y seis mil millones de neuronas en el encéfalo
humano. Hay neuronas de diferentes formas y tamaños, pero todas comparten unas características
estructurales comunes. En la mayoría de las neuronas podemos distinguir tres partes
(ved la figura 1):
1) el soma,
2) el axón y
3) las dendritas.
Figura 1. Representación de una neurona con un axón mielinizado
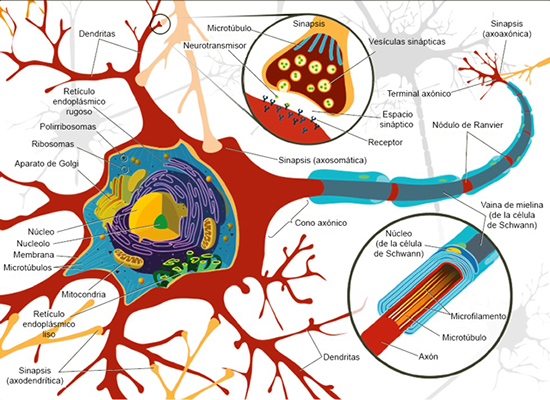
En la imagen se representan las diferentes partes de una neurona. El soma, o pericarion,
contiene la maquinaria para la transcripción, la traducción y el procesamiento posterior
de las proteínas. El cuerpo de las neuronas contiene, además, diferentes orgánulos,
como el aparato de Golgi, las mitocondrias, el retículo endoplasmático (liso y rugoso),
endosomas, estructuras del citoesqueleto, lisosomas, perixomas, etc. Se trata del
centro metabólico en el que se fabrican las moléculas y se realizan las actividades
fundamentales para mantener la vida y las funciones de la célula nerviosa. De manera
añadida, el soma contiene el núcleo de la célula y en este se encuentra el nucléolo,
que es donde se fabrican las proteínas ribonucleares que conformarán los ribosomas.
En la figura se muestra cómo en su parte más distal el axón se divide y ramifica;
en el extremo de las ramificaciones, se encuentran pequeños engrosamientos denominados
botones terminales. Asimismo, se muestran las ramificaciones dendríticas que emergen
del cuerpo celular. Fuente: Mariana Ruiz Villarreal (autora de la imagen).
El soma, o cuerpo celular, es el centro metabólico en el que se fabrican las macromoléculas
y se realizan las actividades fundamentales para mantener la vida y las funciones
de la célula nerviosa. El cuerpo de las neuronas suele ser de mayor tamaño en comparación
con otras células del sistema nervioso y es rico en orgánulos (ved la tabla 1).
Tabla 1. Partes de una neurona prototípica
|
Parte
|
Principales orgánulos y componentes
|
Aspectos funcionales
|
|
Soma
|
Núcleo, sistema endomembranoso (retículo endoplasmático, aparato de Golgi, lisososomas,
endosomas), cuerpos de Nissl, filamentos del citoesqueleto, mitocondrias.
|
Centro metabólico en el que se fabrican las macromoléculas y se integran las señales
eléctricas.
|
|
Axón
|
Filamentos del citoesqueleto, mitocondrias, vesículas de transporte.
|
Conducción de la información.
|
|
Terminal axónico
|
Mitocondrias y vesículas sinápticas.
|
Transmisión de la información a otras neuronas.
|
|
Dendritas
|
Filamentos del citoesqueleto, mitocondrias, cuerpos de Nissl en la región proximal
y parte del aparato del Golgi.
|
Recepción de la información de otras neuronas.
|
El cuerpo celular es el lugar en donde se sintetizan la mayoría de las enzimas de
la neurona, las proteínas estructurales, los componentes de la membrana y los orgánulos,
así como algunos de los mensajeros químicos que utiliza la neurona para comunicarse.
El axón es una única prolongación larga que sale del soma. El diámetro de los axones
varía entre 0,2 y 25 μm. Su principal función es la de conducir información codificada
de forma eléctrica (potenciales de acción), lo que permite que la información pueda
viajar desde el soma hasta el final del axón. En su parte más distal se divide y ramifica,
y en el extremo de las ramificaciones se encuentran pequeños engrosamientos denominados
botones terminales (ved la tabla 1). Estos botones tienen la función de secretar determinadas sustancias, denominadas
neurotransmisores. El número de conexiones que establece un axón de una neurona refleja
el grado de divergencia de la información.
El término dendrita proviene de la palabra dendron, que en griego significa ‘árbol’; de hecho, las dendritas de las neuronas se dividen
como las ramas de un árbol. Las dendritas son ramificaciones que salen del cuerpo
celular o soma y cuya principal función es la de recibir información de otras neuronas
(ved la tabla 1); contienen las espinas dendríticas, que son unas pequeñas protuberancias que aumentan
el tamaño de la superficie receptora de la neurona (ved la figura 2). El número de conexiones que recibe una neurona concreta depende de la complejidad
de su arborización dendrítica y refleja el grado de convergencia de la información.
Figura 2. Espinas de una dendrita en una neurona estriatal

En la imagen se muestran las principales partes de una espina dendrítica (cabeza y
cuello). Las regiones postsinápticas de las dendritas se emplazan a lo largo de los
procesos principales, aunque con mayor frecuencia se dan en las espinas dendríticas.
Tanto su estructura como su número resultan altamente dinámicos y van modificándose
en función de la actividad neural. Se cree que las dinámicas acaecidas en las espinas
dendríticas podrían reflejar modificaciones en la función sináptica que podrían subyacer
como sustrato a procesos cognitivos como el aprendizaje y la memoria.
Las dendritas son ricas en microtúbulos y microfilamentos. Una parte del ARN mensajero
neuronal es transportado a las dendritas para poner en marcha procesos de síntesis
y procesamiento proteico en respuesta a la actividad sináptica (ved la tabla 1).
Podemos distinguir a las neuronas por su especialización en la comunicación celular.
Dicha especialización funcional resulta aparente en la morfología de la neurona. Una
neurona prototípica presenta tres regiones morfológicamente definidas: el soma, las
dendritas y el axón con los terminales presinápticos. El soma o pericarion constituye
el centro metabólico de la neurona y contiene la maquinaria necesaria para la síntesis
de proteínas. Las dendritas contienen especializaciones postsinápticas (principalmente
en las espinas), con lo que constituyen la principal región de la neurona para la
recepción de las señales. El axón contiene los terminales presinápticos y la maquinaria
para la liberación de las sustancias transmisoras, con lo que desempeña un papel cardinal
para transmitir las señales a otras neuronas.
1.1. Orgánulos
Las neuronas y las células de la glía se desarrollan de células neuroepiteliales del
sistema nervioso embrionario y comparten los orgánulos que podemos encontrarnos en
otras células de nuestro cuerpo. No obstante, dichos orgánulos a menudo son más prominentes
en regiones concretas de estas células. En este sentido, por ejemplo, los orgánulos
relacionados con la síntesis de proteínas, como el retículo endoplásmico rugoso, no
aparecen en las dendritas y el axón (ved la figura 3), mientras que las mitocondrias tienden a concentrarse en el botón terminal de las
neuronas.
Figura 3. Representación de los principales componentes del sistema endomembranoso

Fuente: Mariana Ruiz Villarreal (autora de la imagen).
1.2. Citoesqueleto
Como otras células, las neuronas también cuentan con un citoesqueleto que les da consistencia
y les proporciona un mecanismo de transporte de moléculas en su interior. Este es
el responsable de la distribución asimétrica de los orgánulos y de la conformación
de una matriz intracelular que determina la forma de la neurona. Asimismo, su organización
distintiva (si la comparamos con otras células de nuestro cuerpo) resulta de cardinal
importancia para la función y la estabilidad de los procesos neuronales y de las uniones
sinápticas.
En las células nerviosas, el citoesqueleto está conformado por tres tipos de filamentos:
1) los mirotúbulos (25 nm de diámetro),
2) los neurofilamentos (10 nm de diámetro) y
3) los microfilamentos (3-7 nm de diámetro).
El citoesqueleto es el andamiaje celular que da forma a las neuronas y células gliales.
Facilita el transporte de materiales celulares y regula la migración y maduración
celular durante el desarrollo.
1.3. Mielinización
Las vainas de mielina son membranas plasmáticas que rodean el axón de manera concéntrica
(ved la figura 4).
Figura 4. Axón mielinizado. Imagen de microscopia electrónica que muestra un axón mielinizado

Fuente: Imagen proporcionada por el Servicio de Microscopia Electrónica del Trinity
College. Creative Commons Attribution-Share Alike 4.0 International license.
Dichas membranas se originan y forman parte de dos tipos de células gliales que se
describirán en el siguiente apartado (los oligodendrocitos en el sistema nervioso
central –SNC– y las células de Schwann en el sistema nervioso periférico –SNP–). Un
oligodendrocito es capaz de producir vainas de mielina en diferentes segmentos de
diversos axones (ved la figura 5), mientras que una célula de Schwann produce una única vaina de mielina para un segmento
de un axón (ved la figura 6).
Figura 5. Oligodendrocito

Tal como se puede observar en la figura, un único oligodendrocito (al contrario de
lo que sucede con las células de Schwann en el SNP) puede mielinizar varios segmentos
de un mismo axón y segmentos de axones diferentes. En el SNC la formación de las vainas
de mielina se produce de manera progresiva, por lo que resulta ser muy similar al
proceso de mielinización de los nervios periféricos, con la salvedad de que los axones
del SNC se encuentran rodeados por un menor número de capas que los axones del mismo
diámetro del SNP. Fuente: Andrew C (autor de la imagen).
Figura 6. Representación del proceso de mielinización por parte de una célula de Schwann

En la imagen puede observarse cómo una única célula de Schwann forma la mielina de
un segmento de un axón. En el SNP, la mielina se produce en fases tempranas del desarrollo
al unirse las células de Schwann a los axones durante el proceso de crecimiento. El
proceso de mielinización tiene lugar en varias fases. En primer lugar, el axón del
nervio periférico queda envuelto por completo por el citoplasma de la célula de Schwann,
al yuxtaponerse las láminas externas de su membrana. La estructura conformada se denominada
mesoaxón. Dicha estructura se va alargando progresivamente para rodear el axón en
espiral. Cuando la mielina es madura podemos observar cómo el citoplasma de la célula
de Schwann está marcadamente comprimido, formando unas finas capas concéntricas. Fuente:
CFCF (autor de la imagen). Creative Commons Attribution-Share Alike 3.0 Unported.
Los segmentos de los axones que están recubiertos de mielina se denominan internodos,
mientras que los que quedan al descubierto se denominan nodos de Ranvier. La mielina
es un aislante eléctrico, con lo que facilita la conducción a lo largo del axón. En
los axones mielinizados, la membrana excitable es expuesta al espacio extracelular
solo en los nodos de Ranvier. Cuando se excita la membrana del axón en el nodo, el
circuito local generado no puede fluir a través de la vaina debido a su alta resistencia
y fluye hacia adelante para despolarizar la membrana en el siguiente nodo (se trata
de la denominada conducción saltatoria). La baja capacitancia de las vainas de mielina
posibilita un menor gasto energético necesario para despolarizar la membrana axónica
que se encuentra entre dos nodos, lo que contribuye a un aumento de la velocidad de
conducción del potencial. El número de capas de mielina es proporcional al diámetro
del axón, de manera que los axones con diámetros muy pequeños no suelen estar mielinizados.
La conducción de los potenciales de acción en este tipo de axones es mucho más lenta.
De todos modos, la oligodendroglía lleva a cabo una función protectora de estos axones
no mielinizados en tanto que los mantiene fijos. Lo mismo ocurre en el SNP, las células
de Schwann también dan soporte y protección a los axones amielínicos.
La mielina es una estructura laminar concéntrica construida a base de membrana celular
que envuelve al axón en patrones interrumpidos por espacios no mielinizados denominados
nodos de Ranvier. La mielina está presente solo en vertebrados.
La importancia de la mielina ha quedado dramáticamente evidenciada en algunas patologías
cuyo rasgo distintivo es un defecto en la mielinización. Las más comunes de dichas
patologías son las enfermedades desmielinizantes caracterizadas por una pérdida de
mielina en axones previamente mielinizados. Ya sea por causas genéticas, procesos
inflamatorios o defectos metabólicos, la pérdida de mielina conduce invariablemente
a fallos en la capacidad conductiva de los axones, degeneración nerviosa y a una buena
cantidad de síntomas neurológicos. De estas enfermedades, la mejor comprendida es
la esclerosis múltiple, una patología con fuerte asociación inmunológica (aparentemente
autoinmune) que produce lesiones en diferentes regiones del encéfalo acompañadas de
síntomas como pérdida de la visión, debilidad muscular, dolor y alteraciones cognitivas
que suelen remitir por periodos de tiempo más o menos largos.
Evidencias recientes sugieren que la velocidad de la conducción nerviosa podría modificarse
a través de cambios en la mielina para optimizar el tiempo de la transmisión de la
información a través de los circuitos neuronales. Este concepto emerge de la confluencia
de las técnicas de neuroimagen que han mostrado cambios en la sustancia blanca del
encéfalo humano durante el aprendizaje, con los estudios celulares que han puesto
de manifiesto que los procesos de mielinización pueden verse influidos por los patrones
de los potenciales de acción que tienen lugar en los axones. Algunos trabajos han
mostrado que los cambios que tienen lugar en la sustancia blanca podrían contribuir
a los mecanismos de aprendizaje y consolidación de la memoria en tanto que la mielina
madura se puede modificar para alterar las demoras en la conducción del impulso nervioso
y mejorar el rendimiento de la transmisión de la información en algunos circuitos.
El dogma de que la mielina no se puede modificar fuera del contexto de algunos trastornos
está cambiando con evidencias recientes que provienen de estudios de neuroimagen y
de estudios con modelos celulares. Distintos factores del ambiente y de la actividad
funcional que tiene lugar en los axones pueden influir sobre el proceso de mielinización.
La mielina puede regularse por actividad funcional y constituirse como uno de los
mecanismos de plasticidad del sistema nervioso. Dicha regulación dependiente de la
actividad podría ser especialmente relevante para el funcionamiento encéfalo humano
y su implicación en los procesos de aprendizaje y memoria.
1.4. Clasificación de las neuronas
Las neuronas son las células más polimórficas del cuerpo y se pueden clasificar según
sus características morfológicas, su localización, la sustancia transmisora que utilizan
y su función, entre otras. Se estima que existen unos cien tipos diferentes de neuronas.
Dicha diversidad citológica está relacionada también con los genes que se expresan
en cada tipo de neurona. A lo largo de apartados posteriores iremos describiendo las
características de las neuronas ligadas a la neurotransmisión y a renglón seguido
atenderemos a su forma y su función.
A grandes rasgos, según sus características morfológicas se distinguen neuronas unipolares,
bipolares y multipolares.
Las neuronas unipolares son las neuronas más simples, dado que del soma sale una sola
prolongación o proceso (neurita). Se trata de células que son comunes en el sistema
nervioso de invertebrados. En mamíferos, un tipo particular de célula unipolar son
las denominadas neuronas seudomonopolares, seudounipolares o neuronas en «T» (ved
la figura 7). Se trata de células cuyo proceso se ramifica. Una de las ramificaciones sirve de
axón, y las demás funcionan como estructuras dendríticas de recepción. Son neuronas
de tipo sensorial que no tienen dendritas que salgan directamente del soma: la arborización
que queda fuera del SNC constituye las dendritas.
Figura 7. Clasificación de las neuronas según la polaridad

En la imagen se representan cuatro tipos de neuronas que se pueden clasificar en función
de la cantidad de procesos que emergen del soma. La neuronas A y D son neuronas unipolares,
en tanto que del soma emerge un solo proceso. La diferencia entre ambas radica en
que en la neurona D dicho proceso se bifurca, por lo que también se la denomina neurona
seudomonopolar o neurona en forma de «T». Durante el desarrollo, los dos procesos
de estas neuronas seudomonopolares se fusionan y emergen del cuerpo como un solo proceso
que presenta dos segmentos funcionalmente diferentes. La neurona B es una neurona
bipolar, dado que del soma emergen dos procesos en sentidos opuestos: el axón y el
proceso dendrítico. La neurona C es una neurona multipolar, pues de su soma surgen
múltiples procesos dendríticos y un axón. Dentro de las neuronas multipolares, es
posible distinguir dos tipos: aquellas que presentan un proceso axonal muy largo que
proyecta a largas distancias (neurona multipolar de Golgi I) y aquellas que presentan
un proceso axonal mucho más corto que proyecta localmente (neurona multipolar de Golgi
II). Un ejemplo de las neuronas de Golgi I lo constituyen las neuronas piramidales,
las células de Purkinje y las neuronas del asta anterior de la médula espinal. Por
otro lado, como ejemplo de las neuronas de Golgi II destacan las neuronas granulares.
Fuente: Jonathan Haas (autor de la imagen).
Un segundo tipo son las neuronas bipolares. Del cuerpo celular de esta clase de neuronas
salen dos neuritas o procesos. En algunas ocasiones es difícil saber cuál de las prolongaciones
es el axón y cuáles constituyen las dendritas. Sin embargo, desde un punto de vista
funcional, las dendritas están especializadas en recibir información de otras neuronas,
y el axón, en conducir esta información en forma de impulsos nerviosos hasta los botones
terminales. Estas neuronas se encuentran principalmente en los sistemas sensoriales,
como es el caso de las células bipolares de la retina.
En tercer lugar, están las neuronas multipolares. Se trata del tipo más común de neuronas
en el sistema nervioso de los vertebrados. Del soma de este tipo de neuronas salen
el axón y varias ramificaciones dendríticas. Según la longitud del axón, se clasifican
en tipo Golgi I y tipo Golgi II. Las de Golgi I son neuronas multipolares con el axón
largo, como las células piramidales (ved la figura 8) y las células de Purkinje (ved la figura 9A), mientras que las de tipo II son de axón corto, como las células granulares (ved
la figura 9B).
Figura 8. Célula piramidal

Las células piramidales presentan un cuerpo celular triangular y las dendritas emergen
de la base (dendritas basales) y del vértice apical (dendritas apicales). Se trata
de un tipo de células que podemos encontrar en el hipocampo y en la corteza cerebral.
En la imagen se muestran unas pequeñas protuberancias a lo largo de las dendritas
que constituyen las principales regiones postsinápticas: las espinas dendríticas.
Los terminales axónicos presinápticos establecen contacto con dichas espinas, cuya
estructura y número puede presentar gran dinamismo, modificándose en función de la
actividad neuronal. Algunos investigadores sugieren que la dinámica de las espinas
dendríticas podría constituir el sustrato para procesos como el aprendizaje y la memoria.
Fuente: David Beeman (autor de la imagen).
Figura 9. Diferentes tipos de neuronas multipolares

Dibujos realizados por Santiago Ramón y Cajal (1899) de células de Purkinje (A) y
de células granulares (B). Fuente: Instituto Santiago Ramón y Cajal, Madrid.
De acuerdo con el número total de neuritas (dendritas y axones) que se extienden desde
el soma, las neuronas se pueden clasificar en unipolares (una única neurita), bipolares
(dos neuritas) y multipolares (tres o más neuritas).
¿Es cierto que hay neuronas con axones que miden más de un metro de longitud?
En el sistema nervioso, además de la gran variedad que muestran las neuronas en sus
formas, también hay gran diversidad en cuanto a su tamaño. En este sentido, nos podemos
encontrar con neuronas cuyos axones miden apenas unos milímetros y otras con axones
que pueden llegar a medir más de un metro de longitud, como es el caso de aquellas
neuronas de la corteza cerebral que envían sus proyecciones a la parte sacra de la
médula espinal.
De manera genérica, según su función es posible distinguir entre tres tipos de neuronas
claramente diferenciados: neuronas sensoriales primarias, neuronas motoras e interneuronas
(ved la tabla 2).
Tabla 2. Tipos celulares en el SNC
|
Tipos celulares
|
Ubicación
|
Aspectos funcionales
|
|
Astrocitos protoplasmáticos
|
Sustancia gris
|
Soporte mecánico y metabólico, respuesta a las lesiones.
|
|
Astrocitos fibrosos
|
Sustancia blanca
|
|
Oligodendrocitos
|
Sustancia blanca y algunas células en sustancia gris
|
Mielinización axones del SNC.
|
|
Microglía
|
Sustancia gris y algunas células en sustancia blanca
|
Respuesta a las lesiones y fagocitosis.
|
|
Neurona (axones)
|
Predominantemente en sustancia blanca
|
Conducción y emisión de la información.
|
|
Neurona (dendritas y somas)
|
Predominantemente en sustancia gris
|
Recepción e integración de la información y síntesis de macromoléculas.
|
Las neuronas sensoriales conducen la información desde la periferia hasta el SNC,
por lo que podemos decir que constituyen las fibras aferentes al SNC. Normalmente,
este tipo de neuronas presenta las características morfológicas de una neurona seudomonopolar.
Las neuronas motoras conducen información desde el SNC hasta la periferia (músculos
y glándulas), por lo que podemos decir que constituyen las fibras eferentes del SNC
(ved la figura 10). Desde el punto de vista morfológico, suelen ser neuronas multipolares Golgi I.
Figura 10. Aferencias y eferencias

En la imagen se han representado las aferencias al sistema nervioso central (SNC)
y las eferencias del SNC en relación con la función neuronal (neuronas sensoriales
y motoras).
Por último, las interneuronas constituyen el tipo neuronal más abundante, que está
constituido por todas aquellas neuronas que no pertenecen ni al tipo de las sensoriales
ni al de las motoras. Se trata del tipo de neuronas más numeroso (se estima que abarca
a más del 99 % de todas nuestras neuronas), y se puede dividir en dos clases: interneuronas
de proyección e interneuronas locales. Estas últimas presentan axones cortos y se
encargan de conectar neuronas entre sí en circuitos locales, mientras que las de proyección
cuentan con axones más largos para poder transmitir las señales de una región a otra
del encéfalo, recorriendo distancias considerables.
Otros criterios de clasificación de las neuronas
Las neuronas también pueden clasificarse según otros criterios. Por ejemplo, las arborizaciones
dendríticas que muestran las neuronas pueden variar bastante de una célula a otra.
De este modo, en la corteza cerebral nos podemos encontrar con células estrelladas
(cuya arborización dendrítica, como su nombre indica, se extiende de tal forma que
su cuerpo recuerda al de una estrella) y con células piramidales (que muestran un
conjunto de dendritas apicales y dos conjuntos de dendritas basales que delimitan
una forma triangular o de pirámide). Las neuronas también pueden clasificarse en función
de la presencia o ausencia de espinas dendríticas, en función de los genes que se
expresan o en función del neurotransmisor que utilizan, entre otros criterios.
Las neuronas sensoriales primarias y motoras se ubican entre el SNP y el SNC, mientras
que las interneuronas se encuentran solo en el SNC y se interconectan con otras neuronas.
1.5. Comunicación entre las neuronas
Las neuronas forman parte de circuitos neurales que procesan diferente tipo de información.
Las conexiones sinápticas tienen lugar fundamentalmente en las regiones ubicadas entre
los cuerpos neuronales que se denominan neuropilo. De este modo, el neuropilo está
constituido por densas marañas de dendritas, terminales axónicos y procesos de las
células gliales.
El tejido nervioso es un conjunto de cuerpos neuronales y gliales rodeados por un
complejo entramado de prolongaciones celulares que constituyen el neuropilo.
La capacidad de comunicación entre las neuronas se da gracias a la generación y trasmisión
de señales eléctricas. La potencialidad para originar señales eléctricas se debe a
las particulares propiedades que presentan las membranas celulares de las neuronas.
Las neuronas utilizan dichas señales eléctricas para comunicarse entre sí, dado que
sus membranas son capaces de transformar estas señales de manera que puedan ser trasmitidas
a otras neuronas. Los contactos funcionales entre las neuronas se denominan sinapsis
(ved la figura 11). El espacio extracelular que separa físicamente a las dos neuronas que establecen
contacto se denomina espacio o hendidura sináptica.
Figura 11. Simulación tridimensional de una sinapsis

La figura ilustra en el componente presináptico (elemento superior) una cantidad discreta
de vesículas sinápticas listas para ser liberadas. Las vesículas contienen a su vez
un paquete de neurotransmisores denominado quantum, que será expulsado al espacio
extracelular después de que un potencial de acción invada el terminal sináptico (exocitosis).
Una vez liberados, los neurotransmisores se unirán de manera específica a su receptor
postsináptico (figura flotante en el elemento inferior de la imagen) y rápidamente
serán recapturados o inactivados para iniciar un nuevo ciclo sináptico. Fuente: Fernando
Jáuregui Huerta (autor de la imagen). Departamento de Neurociencias. Universidad de
Guadalajara.
Gracias a las sinapsis, las neuronas se activan, se inhiben o sufren modificaciones
de su actividad. La mayoría de los contactos sinápticos en el sistema nervioso de
los mamíferos son de naturaleza química, de modo que se libera una sustancia química,
denominada sustancia neurotransmisora, desde el botón axónico de una neurona para
que se una en sitios especializados de otra neurona, denominados receptores. Las neuronas
que liberan el neurotransmisor se denominan neuronas presinápticas, mientras que las
neuronas que reciben la información (es decir, el neurotransmisor se une a ellas en
los receptores) se denominan neuronas postsinápticas. Obviamente, las neuronas postsinápticas
pueden convertirse en presinápticas si, a su vez, transmiten información a otras (es
decir, si liberan la sustancia transmisora desde sus terminales axónicos).
¿Es cierto que el cerebro humano es más complejo que nuestra galaxia?
Puede decirse que el encéfalo humano es más complejo que una galaxia repleta de estrellas:
se estima que un encéfalo humano adulto contiene entre cien y quinientos trillones
de conexiones. Préstese atención, por un momento, a esta descomunal y vasta cuantificación.
En 1998, el astrónomo Paul S. Butterworth estimó en cien billones las estrellas de
nuestra galaxia. Las últimas estimaciones sobre el número de estrellas en la vía láctea
sugieren que podrían existir entre doscientos y cuatrocientos billones. Con trillones
de conexiones sinápticas entre las células del encéfalo, las posibilidades son ingentes.
A grandes rasgos, puede afirmarse que cuando una neurona (la neurona presináptica)
se activa, libera al exterior (a la hendidura sináptica) una sustancia química. Este
neurotransmisor se difunde rápidamente a través de la hendidura sináptica y se une
a un receptor de la neurona con la que establece contacto (la neurona postsináptica).
La unión entre el neurotransmisor y el receptor es específica, de modo que el primero
«encaja» en el segundo como si se tratase de una llave y una cerradura. ¿Qué hacen
las llaves al unirse a la cerradura? La respuesta a esta cuestión resulta muy simple:
abrir la puerta. Pues en el caso de la neurona postsináptica sucede algo parecido,
se abren puertas. En la membrana de las neuronas existen unas proteínas especiales
que la atraviesan. En algunos casos la estructura tridimensional de dichas proteínas
forma un canal central con una compuerta (estas proteínas se denominan canales iónicos).
Dicha compuerta puede estar cerrada. Ocurre que el receptor para la sustancia transmisora
se encuentra acoplado al canal iónico, de manera que al unirse el neurotransmisor
se genera un cambio conformacional de la proteína, lo que permite que el canal se
abra y deja paso a unas partículas cargadas eléctricamente denominadas iones. En este
caso, se dice que se produce una modificación en la permeabilidad de la membrana postsináptica,
como consecuencia de la apertura de un canal iónico y del paso de iones a través de
este. ¿Qué implicación funcional puede tener todo esto? Las neuronas mantienen una
diferencia de potencial eléctrico entre el interior y el exterior celular. Esta diferencia
de potencial o de carga eléctrica se debe a la diferente distribución de moléculas
existente a ambos lados de la membrana neuronal. Las principales moléculas con carga
que operarán en el caso de las neuronas son los iones. Aquellos iones con carga positiva
se denominan cationes, mientras que los que tienen carga negativa se denominan aniones.
La distribución a ambos lados de la membrana de la neurona de las cargas positivas
y negativas determinará la carga eléctrica neta tanto del interior como del exterior
celular. Esta diferencia de potencial recibe el nombre de potencial de membrana. Cuando
una neurona está inactiva, el potencial de membrana se denomina potencial de reposo.
En estado de reposo, una neurona prototípica presenta una diferencia de potencial
a través de su membrana de aproximadamente 60 o 70 milivoltios (mV). Esta diferencia
de potencial refleja una distribución desigual de la carga eléctrica a ambos lados
de la membrana, de modo que se concentra un exceso de cargas negativas en el interior
celular y un exceso de cargas positivas en el exterior celular, por lo que se dice
que el potencial de reposo es negativo (–60 o –70 mV). Volviendo al canal iónico,
si este canal deja pasar al interior de la neurona a un ion que tiene una carga positiva
(p. ej., el calcio), el interior de la neurona se hace menos negativo (se dice entonces
que se despolariza). Si, por el contrario, el ion que pasa al interior a través del
canal es un ion con carga negativa (p. ej., el cloro), el interior de la neurona se
hace todavía más negativo (se hiperpolariza).
La hiperpolarización hace que la neurona se vuelva todavía más inactiva y sea más
difícil que pueda responder y transmitir la información (liberar el neurotransmisor)
a la siguiente neurona. La despolarización, por su parte, aumenta la probabilidad
de que la neurona responda y pueda transmitir la información a otras neuronas. Si
este es el caso, el potencial de membrana adopta un valor diferente, que recibe el
nombre de potencial de acción o de impulso nervioso. Estas hiperpolarizaciones y despolarizaciones
de la membrana reciben el nombre de potenciales locales. Las hiperpolarizaciones son
potenciales locales que se denominan potenciales inhibitorios postsinápticos (PIP),
mientras que las despolarizaciones son potenciales locales que se denominan potenciales
excitatorios postsinápticos (PEP). El potencial de acción se origina en el segmento
del axón que se encuentra próximo al soma (denominado cono axónico). Cada neurona
tienen un umbral a partir del cual el potencial de membrana se convierte en potencial
de acción; dicho umbral se denomina umbral de excitación. El potencial de acción es
una rápida inversión del potencial de membrana, de manera que este adopta un valor
positivo de aproximadamente +50 mV, siguiendo la ley del todo o nada (se produce o
no se produce). ¿Qué es lo que hace que salten las alarmas y se genere un potencial
de acción? Resulta que una misma neurona puede recibir conexiones con cientos de neuronas.
Estas conexiones harán que su membrana se haga más negativa (se hiperpolarice) o menos
negativa (se despolarice), disminuyendo o aumentando la probabilidad de que se produzca
el impulso nervioso, respectivamente. Cuando muchas de estas señales eléctricas tienen
lugar en la membrana postsináptica, pueden producir cambios notables en el potencial
de membrana. El cono axónico presenta el umbral de excitación más bajo de la neurona,
de modo que cuando las señales eléctricas alcanzan esta parte del axón, si la suma
total en un mismo momento hace que se sobrepase el umbral de excitación (–55 mV),
es entonces cuando se genera un potencial de acción.
Suponed que una neurona recibe información en sus dendritas a través de varias sinapsis
excitatorias (ved las figura 12 y figura 13), de modo que el flujo de un ion con carga positiva (p. ej., el sodio) entra en la
neurona despolarizando la membrana postsináptica de la región dendrítica (ved la figura 14). La corriente eléctrica (en este caso, un potencial local excitatorio) fluye hacia
el cuerpo neuronal hasta llegar al segmento inicial del axón o cono axónico. Si el
valor de la despolarización es suficiente para sobrepasar el umbral de excitación
de dicha neurona, entonces se pondrá en marcha el potencial de acción. En el cono
axónico se produce un proceso de integración neural de las señales excitatorias e
inhibitorias que le llegan a la neurona de otras neuronas. La integración, por lo
tanto, consiste en un proceso de sumación de todos los potenciales locales que alcanzan
el segmento inicial del axón. Este proceso de sumación tiene lugar simultáneamente
en los planos espacial y temporal. Dicho de otro modo, se produce una sumación de
todos los potenciales locales (excitatorios e inhibitorios) que le llegan al mismo
tiempo y lugar a una neurona. Si el resultado de la suma de estos potenciales locales
hace que el potencial de membrana en el segmento inicial del axón esté por encima
del umbral de excitación, entonces y solo entonces se pone en marcha el potencial
de acción.
Figura 12. Tipos de sinapsis

En la parte superior izquierda de la figura se observa una representación esquemática
de dos neuronas y del contacto que se establece entre ambas (sinapsis). En la parte
inferior derecha de la imagen se representan diferentes tipos de sinapsis en función
del lugar de contacto. Sinapsis axosomática: un axón hace contacto sobre el soma de
la neurona postsináptica. Las sinapsis de este tipo suelen ser inhibidoras. Sinapsis
axodendrítica: un axón establece contacto con una dendrita postsináptica. La sinapsis
puede darse en la rama principal de la dendrita o en zonas especializadas de entrada,
las espinas dendríticas. Con frecuencia las sinapsis de este tipo son excitadoras.
Sinapsis axoaxónica: un axón establece contacto con un axón postsináptico. Las sinapsis
de este tipo suelen ser moduladoras de la cantidad de neurotransmisor que liberará
el axón postsináptico sobre una tercera neurona.
Figura 13. Representación esquemática de una sinapsis glutamatérgica y el componente glial (tripartita)
de la sinapsis

La sinapsis glutamatérgica es uno de los elementos funcionales que mejor ilustran
la interacción entre neuronas y células gliales. El glutamato que se libera tras un
estímulo nervioso actúa sobre sus receptores ionotrópicos y metabotrópicos produciendo
generalmente excitación en la neurona postsináptica. Dado que las concentraciones
excesivas de glutamato en el espacio extracelular pueden ser tóxicas, existen mecanismos
que regulan sus concentraciones y moderan de este modo su acción postsináptica. Uno
de los mecanismos más importantes para regular las concentraciones extracelulares
de glutamato es el sistema de captura localizado en las células gliales. Los astrocitos
son particularmente eficientes capturando glutamato, puesto que expresan transportadores
específicos que les permiten ingresarlo y posteriormente metabolizarlo y utilizarlo
en la formación de glutamina (sustrato que utilizan las neuronas para producir glutamato
nuevamente), o entrar en el ciclo del ácido tricarboxílico para servir como fuente
energética. Así, los cambios en la actividad glial repercuten en la capacidad excitatoria
de las neuronas y viceversa. Fuente: Fernando Jáuregui Huerta (autor de la imagen).
Departamento de Neurociencias. Universidad de Guadalajara.
Figura 14. Liberación del neurotransmisor

Cuando el potencial de acción llega hasta el botón terminal, se abren canales iónicos
dependientes de voltaje que dejan pasar calcio al interior de la neurona presináptica.
El calcio hace que las vesículas sinápticas se fundan con la membrana presináptica
y vacíen, de esta forma, su contendido en la hendidura sináptica. La liberación de
la sustancia neurotransmisora de la vesícula requiere que cinco iones de calcio se
unan a proteínas específicas de las vesículas sinápticas que son sensibles a dicho
ion. Las células nerviosas contienen cinco tipos de canales de calcio dependientes
de voltaje: canales de tipo L, canales de tipo P/Q, canales de tipo N, canales de
tipo R y canales de tipo T. Cada uno de estos tipos se encuentra codificado por diferentes
genes o familias de genes y presenta diferentes funciones fisiológicas y propiedades
farmacológicas. Todos estos canales, a excepción del canal de tipo T, necesitan una
fuerte despolarización del botón terminal para abrirse. El canal de tipo T, por el
contrario, se puede activar en respuesta a pequeños cambios en el potencial de membrana.
Las vesículas sinápticas liberan el neurotransmisor fusionándose con la membrana neuronal
mediante un proceso denominado exocitosis. Después de unos segundos de la fusión de
la vesícula, esta se recupera por un proceso denominado endocitosis, manteniéndose
las proteínas originales de su membrana e incluyendo otras capturadas del medio externo.
Tanto la exocitosis como la endocitosis se encuentran reguladas por diferentes conjuntos
de proteínas (sinapsinas, sinaptotagmina, sinaptobrevina, sintaxina, SNAP-25, Rab3,
Munc13, Munc 18, RIM, etc.). Fuente: F. Jáuregui Huerta (autor de la imagen).
¿Es cierto que una neurona puede recibir información de cientos de neuronas?
El número de contactos sinápticos que puede recibir una neurona en el sistema nervioso
humano puede variar de 1 a 100.000. Esto resulta especialmente importante para determinar
la función de una determinada neurona.
El potencial de acción se propaga a lo largo del axón de la neurona de una manera
activa, a través de canales iónicos que se abren y se cierran en función del voltaje
(son los denominados canales dependientes de voltaje), de modo que este llega hasta
el botón terminal (segmento final del axón). Se ha de tener presente que las moléculas
de neurotransmisor se encuentran almacenadas en el interior de vesículas en el botón
terminal, esperando a que llegue un potencial de acción para que sean liberadas a
la hendidura sináptica. Una vez que el potencial de acción llega al botón terminal,
en la membrana de este se abren canales iónicos dependientes de voltaje que dejan
pasar calcio dentro del botón. El calcio hace que las vesículas sinápticas se fundan
con la membrana presináptica y vacíen, de este modo, su contendido en la hendidura
sináptica (ved la figura 14).
Bajo circunstancias fisiológicas normales, las neuronas son células que se encuentran
anatómica y funcionalmente polarizadas, de manera que las señales eléctricas viajan
en una única dirección.
Los potenciales de acción son las señales mediante las cuales el cerebro recibe, analiza
y transmite la información. El cerebro analiza e interpreta los patrones de estas
señales eléctricas y las vías y redes por las que se transmiten para crear, en último
término, aspectos como las percepciones que tenemos del mundo exterior o para generar
las cogniciones.
2. Las células gliales
Hasta el momento se ha analizado qué es una neurona, cuáles son sus partes constitucionales
y cómo se comunican entre sí. Se abordarán ahora las células gliales.
Desde un punto de vista morfológico, las células gliales difieren de las neuronas
en que no presentan axón ni dendritas. Asimismo, también difieren desde un punto de
vista funcional. En este sentido, las células gliales se encargan sobre todo de regular
el ambiente interno del sistema nervioso y de ayudar en los procesos comunicación
entre las neuronas. De entrada, puede afirmarse que se trata de células que constituyen
el principal soporte estructural de las neuronas, participan activamente durante los
procesos de desarrollo y formación del encéfalo, parecen desempeñar un papel importante
en el aporte nutricional de las neuronas a través de la circulación sanguínea, participan
en los mecanismos de defensa inmunológica y en los procesos de reparación y regeneración
nerviosa después de una lesión, participan en el mantenimiento del equilibrio químico
en el interior del sistema nervioso, separan y aíslan las células nerviosas, recubren
partes de estas para acelerar los procesos de comunicación neuronal, etc.
¿Es cierto que hay más células gliales que neuronas en el sistema nervioso?
Durante muchos años se ha creído que las células gliales son las células que se encuentran
en mayor proporción en el tejido nervioso. Los primeros estudios estimaban que en
el sistema nervioso humano había diez veces más células gliales que neuronas. No obstante,
en los estudios más recientes se ha podido comprobar que el número de neuronas y de
células gliales es similar en el sistema nervioso humano.
A pesar de que las neuronas y las células gliales provienen de las mismas células
precursoras embrionarias, una diferencia fundamental entre estos tipos de células
radica en la excitabilidad eléctrica y en las propiedades de la membrana. De este
modo, las neuronas son capaces de responder a una estimulación externa generando una
respuesta a modo de potencial de acción, capaz de propagarse a través de una red neural.
Las células gliales son incapaces de generar un potencial de acción en su membrana
plasmática. No obstante, se ha de tener presente que no todas las neuronas generan
potenciales de acción y que algunas células gliales pueden participar en los mecanismos
eléctricos y químicos de comunicación y señalización que sirven para transmitir la
información (p. ej., se ha podido comprobar que pueden expresar canales dependientes
de voltaje en sus membranas, así como receptores para neurotransmisores). Diferentes
experimentos han demostrado que, tanto en regiones centrales como en regiones periféricas,
la actividad de las neuronas es capaz de inducir corrientes en la membrana y/o señales
citosólicas de calcio en las células gliales que se encuentran localizadas cerca de
los contactos entre las neuronas. Además, las células gliales también envían señales
a las neuronas, ya que son capaces de liberar sustancias neurotransmisoras como, por
ejemplo, el glutamato y el adenosintrifosfato (ATP).
El término glía
El término glía proviene del griego y significa ‘pegamento’. Este término fue introducido por el
patólogo Rudolf Ludwig Karl Virchow, quien caracterizó a este tipo de células como
una especie de pegamento neural, dado que para este médico prusiano las células gliales
eran más bien elementos estáticos cuya función principal era la de proporcionar soporte
estructural a las neuronas.
Las células gliales constituyen un grupo de células de naturaleza muy diversa. En
el SNC dentro de las células gliales podemos distinguir a los astrocitos, a los oligodendrocitos
y a las células de microglía, entre otras. En el SNP nos encontramos con células de
Schwann y otras células derivadas de estas (ved la tabla 3 y la figura 15).
Tabla 3. Tipos celulares en el SNP
|
Tipos celulares
|
Ubicación y partes de las células que se ubican en el SNP
|
Aspectos funcionales
|
|
Células de Schwann
|
Se encuentran asociadas a los axones de las neuronas del SNP y a los cuerpos de las
neuronas de los ganglios autonómicos y de la raíz dorsal (células satélite).
|
Mielinización de axones del SNP, envoltura de axones amielínicos, células satélite.
|
|
Neuronas del sistema nervioso autónomo
|
Los axones de las neuronas preganglionares (el soma está en el SNC) y los cuerpos
y procesos de las neuronas posganglionares.
|
Control de la actividad visceral.
|
|
Neuronas sensoriales
|
Cuerpos y procesos de las neuronas sensoriales (los botones terminales establecen
sinapsis con neuronas en el SNC).
|
Conducen la información desde la periferia hasta el SNC (fibras aferentes al SNC).
|
|
Neuronas motoras
|
Los axones de las motoneuronas (el soma se localiza en el SNC).
|
Conducen información desde el SNC hasta la periferia (fibras eferentes del SNC).
|
Figura 15. Resumen de las células del SNC y del SNP
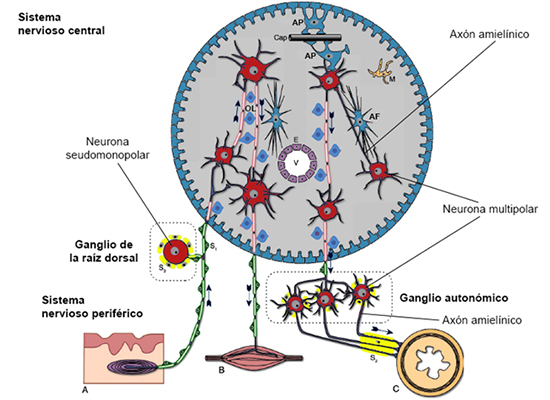
En la figura puede observarse cómo los astrocitos protoplasmáticos (AP) se ubican
en la sustancia gris del SNC y forman una membrana que recubre la superficie del SNC
separándolo del SNP. Asimismo, los AP establecen sus pies terminales hacia los capilares
(Cap) y hacia las neuronas. Por otro lado, los astrocitos fibrosos (AF) se encuentran
en la sustancia blanca del SNC intercalándose con los axones de las neuronas. Los
oligodendrocitos (OL) mielinizan los axones del SNC. En el SNC también podemos encontrar
células de microglía (M). Estas células desempeñan un importante papel en la fagocitosis
y en las respuestas inflamatorias, en tanto que son células inmunocompetentes. El
SNC se desarrolla a partir del tubo neural. La cavidad de dicho tubo persiste en el
SNC adulto conformando el sistema ventricular (V) con un revestimiento epitelial de
células ependimales (E) que limitan sus paredes. En algunas localizaciones, las células
ependimales se han especializado como epitelio secretor para producir el líquido cefalorraquídeo.
Las neuronas que observamos dentro del SNC son morfológicamente multipolares y funcionalmente
son interneuronas (locales y de proyección). En el SNP nos encontramos con células
de Schwann y sus variantes: se puede observar en la figura células de Schwann que
mielinizan axones del SNP (S1), células de Schwann que envuelven a los axones amielínicos
(S2) y, por último, células de Schwann que rodean como células satélite los cuerpos
de las neuronas sensoriales que se ubican en el ganglio de la raíz dorsal y de las
neuronas autonómicas que se encuentran en el ganglio autonómico (S3). Con relación
a las neuronas y a las partes de las neuronas que encontramos en el SNP, en la figura
se muestra una célula sensorial seudomonopolar que recoge información de un receptor
somatosensorial de la piel (corpúsculo de Pacini). El cuerpo de dicha célula sensorial
se ubica en el ganglio de la raíz dorsal y se encuentra rodeado por células satélite.
Los botones terminales de la neurona sensorial llegan al SNC para establecer sinapsis
con neuronas multipolares. También se puede observar en el SNP el axón de la neurona
motora (el soma y las dendritas de dicha neurona están en el SNC) que inerva un músculo
estriado. Por último, se representan en la figura tres neuronas multipolares cuyo
soma se ubica en un ganglio autónomo y sus axones amielínicos son enviados a la musculatura
lisa y a las glándulas. La dirección del flujo de la información queda representada
por las flechas. Fuente: Imagen modificada de Krstic RV (1985).
Las células gliales tradicionalmente se han relacionado con el soporte estructural
del tejido nervioso y con el equilibrio químico, pero hoy se sabe que desempeñan funciones
mucho más complejas, como, por ejemplo, ayudar en los procesos de comunicación entre
las neuronas y participar en la maquinaria implicada en los procesos de plasticidad
cerebral y en el funcionamiento cognitivo.
3. Principios básicos de la organización del sistema nervioso
Por lo general, resulta fácil distinguir en el SNC la sustancia gris de la sustancia
blanca. La sustancia gris corresponde fundamentalmente a las zonas del sistema nervioso
donde predominan los somas neuronales y las dendritas, mientras que la sustancia blanca
corresponde a las zonas donde predominan las proyecciones axónicas (ved la figura 16). El lector se podría estar preguntando por la razón de que los axones tengan una
apariencia blanquecina, mientras que las dendritas y los somas carecen de ella. Tal
como hemos comentado en el apartado anterior, la mayoría de los axones se encuentran
envueltos por vainas de mielina. Esta, que es de naturaleza lipídica, le proporciona
el color blanco brillante característico (de hecho, esta envoltura está constituida
por células gliales que se enrollan a modo de «capas de una cebolla» a lo largo del
axón).
Figura 16. Imagen de resonancia magnética que muestra la sustancia blanca del encéfalo

En la sustancia blanca del SNC predominan los axones. Los vóxeles de sustancia blanca
se han resaltado de acuerdo con sus valores de anisotropía fraccional. Fuente: Reproducida
con autorización de Kubicki et al. (2007).
Los somas de las neuronas y los axones se encuentran ampliamente segregados dentro
del sistema nervioso.
Dentro de la sustancia gris podemos observar los núcleos, que son grupos funcionalmente
relacionados de somas celulares en el SNC. Cuando nos referimos, por ejemplo, a la
superficie cortical hablamos de áreas funcionalmente homogéneas. También en el SNC
encontramos diferentes grupos de cuerpos neuronales en forma de columnas funcionales
(perpendiculares en la corteza cerebral y longitudinales en la médula espinal). Otro
nivel de organización en el SNC son las capas constituidas por grupos celulares funcionalmente
relacionados y orientados en un eje paralelo al área donde se encuentran ubicadas.
Tal como veremos más adelante, la corteza cerebral está compuesta por seis capas celulares
claramente diferenciadas dispuestas en paralelo. En el SNP, los somas celulares se
ubican en ganglios.
Por lo que se refiere a la sustancia blanca, en el SNC podemos distinguir los haces,
los fascículos, los tractos, los lemniscos (axones que siguen una estructura paralela
y asociados funcionalmente) y los cordones o sistemas (grupo de diferentes fascículos
u haces paralelos). En el SNP hablamos de axones paralelos que constituyen los nervios
espinales y craneales.
3.1. Principales divisiones del sistema nervioso
En líneas generales, podemos dividir el sistema nervioso en dos partes claramente
diferenciadas: el SNC y el SNP.
El SNC está organizado de manera simétrica y está compuesto por encéfalo y médula
espinal (ved la figura 17).
El encéfalo, por su parte, se puede dividir en prosencéfalo, cerebelo y tronco del
encéfalo. Este último se divide en mesencéfalo, protuberancia y bulbo raquídeo, mientras
que el prosencéfalo (o también denominado encéfalo anterior) incluye las dos divisiones
que se ubican en una posición más rostral: los hemisferios cerebrales y el diencéfalo
(ved la figura 18).
Figura 18. Principales subdivisiones dentro del sistema nervioso central

El diencéfalo presenta una ubicación central en el prosencéfalo dado que se encuentra
cubierto dorsal y lateralmente por los hemisferios cerebrales. Con relación al sistema
ventricular, el diencéfalo se posiciona debajo de los ventrículos laterales y alrededor
del tercero, extendiéndose en sentido antero-posterior desde el agujero interventricular
(de Monro) y el límite del tercer ventrículo (la lámina terminal) hasta el tronco
del encéfalo (mesencéfalo). En el próximo capítulo veremos sus dos componentes principales:
el tálamo y el hipotálamo.
¿Cuántas neuronas hay en la corteza cerebral?
Son sorprendentes los datos derivados de la cuantificación de la corteza cerebral,
ya que se estima que la sustancia gris de los hemisferios cerebrales contiene aproximadamente
veinticinco billones de neuronas, interconectadas por más de cien mil kilómetros de
axones y estableciendo en torno a 1014 contactos sinápticos. De este modo, se estima que en un milímetro cúbico de sustancia
gris cortical podamos encontrarnos con unas cincuenta mil neuronas.
Los hemisferios cerebrales, por su parte, se pueden dividir en corteza cerebral y
estructuras subcorticales (ved la figura 18). Con relación a la corteza cerebral, esta se encuentra constituida por capas celulares
dispuestas de manera horizontal. No todas las regiones de la corteza cerebral presentan
la misma disposición citoarquitectónica. En general, se distinguen tres tipos de corteza:
la neocorteza, la paleocorteza y la arquicorteza. Si se mira la superficie de un cerebro,
la mayor parte de la corteza que se observa es neocorteza, es decir, aquella que aparece
en etapas más tardías de la evolución filogenética del sistema nervioso. La paleocorteza
cubre partes restringidas de la base del telencéfalo, mientras que la arquicorteza
está conformada por regiones del sistema límbico, como el hipocampo.
Dentro de la neocorteza, podemos encontrar neuronas que se encargan del procesamiento
de la información que nos llega de los sentidos (áreas sensoriales). Asimismo, también
encontramos neuronas que planifican, programan y envían las órdenes para llevar a
cabo el movimiento voluntario de los músculos de nuestro cuerpo (áreas motoras). Además
de ello, existen las áreas de asociación, que ponen en marcha una integración de nivel
superior al procesamiento que llevan a cabo las áreas sensoriales y motoras, por lo
que se convierten en el nexo de unión entre la neocorteza motora y la sensorial. Se
trata de áreas que modifican su respuesta en función de diferentes circunstancias
y que se han relacionado con las funciones cognitivas superiores, como la atención,
el lenguaje, el razonamiento o la toma de decisiones. Por otro lado, las neuronas
que forman parte de la paleocorteza y arquicorteza se ubican en el lóbulo temporal
medial y resultan de cardinal importancia para la consolidación de la memoria.
Puedo ver con mi lengua
«La suave y cálida brisa marina acariciaba la piel de María y le inducía una placentera
y reconfortante sensación que evocaba recuerdos de su más tierna infancia, cuando
pasaba los veranos con sus padres en la playa de San Sebastián». Esta podría ser la
forma de comenzar una novela, en la que nos imaginamos a la protagonista, María, tumbada
en la playa, tomando el sol en un día no excesivamente cálido, recibiendo en su cuerpo
la estimulación de una agradable brisa y experimentando una amalgama de olores provenientes
del agua del Cantábrico. La información que recibe María por el choque de la brisa
sobre su propia piel es detectada por receptores especializados que responden a cambios
mecánicos en la superficie del cuerpo y es enviada hacia el sistema nervioso central.
Lo mismo ocurre cuando alguien nos acaricia una mano o cuando algo nos toca en la
espalda para avisarnos. En nuestra piel tenemos receptores especializados que no solo
detectan las caricias o el contacto de estímulos sobre nuestra piel, sino que también
nos pueden informar de la temperatura e incluso de los elementos nocivos que generan
una percepción de dolor.
Toda la información que recibimos en la superficie de nuestro cuerpo es enviada a
través de
diferentes conexiones a la neocorteza[]. Esta es una fina lámina de neuronas con sus interconexiones que forma una capa de
pocos milímetros de grosor, que cubre la superficie irregular de los hemisferios cerebrales.
En la neocorteza, diferentes poblaciones de neuronas se encargan de procesar la información
sensorial que llega de diferentes partes de nuestro cuerpo. Si nos fijamos en uno
de los múltiples dibujos o imágenes existentes de la región de la neocorteza que se
encarga de procesar la información sensorial, podremos observar que se representan
las diferentes partes del cuerpo en la corteza de tal modo que no guardan las mismas
proporciones que en el cuerpo (ved la figura 19). Hay una gran desproporción, por lo que el tamaño del área cortical dedicada a una
determinada región del cuerpo no obedece a su tamaño real, sino que depende de la
importancia funcional de esta parte y de la necesidad de precisión en lo relativo
a la sensibilidad de esa zona.
Figura 19. Esquema de la disposición topográfica de la corteza responsable de procesar la información
del tacto, la temperatura y el dolor, la denominada corteza somatosensorial primaria

En la década de 1930, Wilder Penfield llevó a cabo un análisis de la corteza de diferentes
pacientes que iban a someterse a cirugía cerebral. Este neurocirujano descubrió que
la región de la corteza que procesaba la información sensorial y la región que se
encargaba de poner en marcha las órdenes motoras se organizaban de una forma topográfica,
como si se tratara de mapas. Lo que hizo Penfield fue registrar la actividad eléctrica
que mostraba la corteza tras la estimulación mecánica de diferentes zonas del cuerpo.
Asimismo, estimuló eléctricamente diferentes zonas de la corteza somatosensorial y
analizó las sensaciones táctiles que provocaba dicha estimulación en diferentes zonas
del cuerpo. Fuente: Adaptado de Penfield y Rasmussen (1950).
En definitiva, en la región de la neocorteza cerebral que se encarga de procesar la
información sensorial que recibimos de las diferentes partes de nuestro cuerpo,
podemos representar un mapa de estas[]. Dicho mapa resulta muy desproporcionado, ya que la extensión del cuerpo no se encuentra
equitativamente representada, dado que es más grande para aquellas regiones de nuestra
piel que desempeñan una función crítica en la discriminación táctil y de las que necesitamos
obtener una cantidad ingente de información sensorial de gran precisión para posibilitar
un control exacto de su movilidad.
Seguro que el lector tiene presente que no todas las partes de su cuerpo tienen la
misma sensibilidad sensorial. Las yemas de nuestros dedos o nuestros labios presentan
una capacidad muy alta de discriminación sensorial. Por ello, cuando besamos otros
labios o cuando acariciamos otra piel con nuestros dedos somos capaces de experimentar
sensaciones muy ricas en cuanto a estimulación sensorial se refiere. Lo mismo ocurre
con el movimiento. No es la misma precisión necesaria para llevar a cabo el movimiento
de nuestros dedos cuando tocamos un piano o una guitarra que el movimiento que podemos
inferir a nuestro tronco para girarnos noventa grados. Invito al lector a llevar a
cabo un pequeño experimento de discriminación sensorial. Pídele a alguien que te vaya
tocando la espalda con varios dedos de su mano, de tal modo que entre los dedos no
exista una separación superior a dos centímetros y las puntas de todos los dedos toquen
al mismo tiempo la superficie de su espalda. Pídele a la persona que vaya variando
aleatoriamente el número de dedos que tocarán su espalda e intenta adivinar cuántos
son después de cada prueba. Lo que seguramente sorprenderá al lector es que en muchas
de las ocasiones percibirá un solo dedo aun cuando le estén tocando con dos o tres
dedos. Si este mismo experimento lo lleváramos a cabo en otra parte de nuestro cuerpo
con mayor capacidad de discriminación sensorial, la detección de los dedos sería más
certera.
La representación desmedida en la corteza sensorial de las distintas regiones de nuestro
cuerpo se encuentra proporcionalmente relacionada a la densidad de las conexiones
sensoriales que recibe de cada una de ellas. Las regiones que presentan mayor capacidad
de discriminación sensorial, en términos generales, envían mayor cantidad de información
que aquellas con baja resolución. No obstante, hemos de tener presente que el espacio
que ocupa una parte del cuerpo en la corteza no es inmutable o estático. Además, tampoco
se explica únicamente por la densidad de las conexiones sensoriales que recibe. Si
una parte del cuerpo no se puede utilizar, su representación cortical disminuye de
tamaño, y también a la inversa. Por este motivo, el tamaño de la representación cortical
puede variar en función del uso y de la experiencia. Lo mismo ocurre en caso de lesiones.
Cuando hay una lesión en alguna de las vías o los sistemas que llevan la información
a la corteza, la región que queda desprovista de entrada de información pasa a ocuparse
de procesar la información de otras regiones que sí que envían información a la corteza
sensorial. Por ejemplo, en un experimento clásico Pons y colaboradores (1991) analizaron
la corteza que recibía información sensorial en macacos adultos. Diez años antes de
la evaluación habían seccionado las conexiones sensoriales que llegaban a la corteza
provenientes del brazo. Estos autores demostraron que la representación en la corteza
de la cara se había dilatado claramente ensanchándose hacia la región de la corteza
que se encargaba de recibir la información del brazo. De igual modo, a principios
de los años noventa, Kaas y colaboradores pusieron de manifiesto la reorganización
de la corteza visual de los animales adultos después de una lesión en la retina, de
manera que las regiones de la corteza que recibían la información de la zona de la
retina lesionada procesaban ahora la información de las zonas de la retina contiguas
a las lesionadas. Asimismo, Jenkins y Merzenich, a finales de los ochenta, le quitaron
a un macaco adulto la región de la corteza sensorial que recibía la información sensorial
de la palma de la mano. Estos investigadores observaron que tiempo después de la lesión
las neuronas contiguas a la región extirpada recibían ahora información de la palma
de la mano.
Estos son algunos de los ejemplos que podemos encontrarnos en la literatura científica
sobre la reorganización de la corteza sensorial después de una lesión del tejido.
No obstante, la experiencia también desempeña un papel crítico. Imaginemos una persona
ciega que comienza a leer textos en Braille. A medida que va incrementando su experiencia
con este método de lectura, su capacidad de discriminación a través de las yemas de
los dedos aumenta notablemente, de manera que termina por ser capaz de leer páginas
escritas con este sistema.
En la corteza que recibe la información sensorial de las diferentes zonas de nuestro
cuerpo, la región que ocupa la mano o el área que ocupa la cara es similar a la superficie
cortical ocupada por el tórax y los brazos. Si analizamos de una manera específica
la región ocupada por la mano, podemos observar que un 30 % aproximadamente corresponde
al dedo pulgar. Si hacemos lo mismo con la cara, el 30 % del área responde al contacto
de los labios. En definitiva, tal como hemos ido viendo a lo largo del apartado, se
da una representación en la corteza muy desproporcionada con relación a la superficie
real de nuestra piel. Esta desproporción responde a importantes implicaciones de tipo
funcional. De este modo, las regiones de nuestro cuerpo que requieran gran cantidad
de conexiones y que proporcionen información detallada necesaria para llevar a cabo
ciertas funciones contarán con más superficie cortical. No es de extrañar, por lo
tanto, que las manos, que se encuentran implicadas en la manipulación y el reconocimiento
de los objetos, la piel de la cara, que resulta importante para la expresión facial,
y los labios y la lengua, que se encuentran relacionados con el habla, queden representados
en grandes áreas de la corteza, ya que la manipulación, la expresión facial y el habla
constituyen funciones de gran importancia para nuestra especie.
Por consiguiente, los mapas de la corteza sensorial no representan el cuerpo en proporción
real. Las zonas con mayor representación cortical son aquellas partes del cuerpo que
desempeñan un papel fundamental en la discriminación táctil y de las que se debe tener
información sensorial precisa. Lo mismo ocurre con la corteza motora. En ella se da
una representación desproporcionada de las diferentes regiones del cuerpo.
La visión, la audición y los receptores situados en la superficie corporal informan
de la situación de los objetos en el espacio y de nuestro cuerpo con respecto a estos.
La musculatura y las articulaciones, así como nuestro sentido del equilibrio (el sistema
vestibular), nos informan de la longitud y tensión de los músculos y de la posición
del cuerpo con relación al espacio. El sistema motor utiliza esta información para
seleccionar la respuesta apropiada y para llevar a cabo los ajustes necesarios mientras
se realiza el movimiento. Las órdenes motoras se elaboran en la corteza motora y llegan
a las neuronas, que se encargarán de enviar la información a los músculos por medio
de diferentes vías de conexión. Si queremos mover un dedo de la mano, primero se deberá
planificar el movimiento en la corteza con respecto a qué vamos a mover, cómo y cuándo
se llevará a cabo ese movimiento. Después se enviará desde la corteza la orden de
movimiento y se codificará la fuerza de la contracción muscular y la dirección de
los movimientos durante su ejecución.
El mapa motor representado en la neocorteza motora también resulta desproporcionado,
como el mapa de la corteza somatosensorial (ved la figura 20). De esta manera, la musculatura utilizada en tareas que requieren un control muy
fino ocupa mucho más espacio que la representación de la musculatura que requiere
un control motor relativamente menos preciso.
Figura 20. Organización topográfica de la corteza motora primaria

Fuente: Adaptado de Penfield y Rassmussen (1950).
Al igual que sucedía con la corteza sensorial, la representación tampoco es fija ni
inmutable, puede variar con la experiencia o después de una lesión del tejido. En
los años noventa, Sanes y colaboradores seccionaron las neuronas motoras que controlan
los músculos de los bigotes de la rata[]. Tiempo después de la intervención, cuando se activaba la región de la corteza motora
que antes de la lesión provocaba el movimiento de los bigotes ahora inducía el movimiento
de la cara.
Imaginad a un paciente que ha sufrido un accidente cerebrovascular. Durante unos breves
momentos su cerebro se ha quedado sin oxígeno y eso ha dañado la región de la corteza
sensorial responsable de recibir y procesar la información proveniente del brazo izquierdo.
Para llevar a cabo un movimiento determinado, necesitamos recibir información sensorial
sobre la posición del cuerpo con relación al espacio, el estiramiento de nuestros
músculos, la situación de nuestras articulaciones, etc. Este paciente, después del
episodio, es incapaz de mover su brazo izquierdo debido a que no recibe la información
sensorial necesaria para llevar a cabo el movimiento. Para intentar solventar este
grave problema clínico, el equipo de Edward Taub puso en marcha un procedimiento experimental
en monos hace más de treinta años. La investigación consistía en seccionar los nervios
sensoriales que llevan la información de uno de los brazos del primate y en inmovilizar
con un cabestrillo el brazo intacto. La hipótesis de Taub era que los pacientes que
habían sufrido este tipo de episodios no se recuperaban debido a que utilizaban el
brazo intacto, lo que imposibilitaba la aparición de los mecanismos plásticos que
reorganizarían funcionalmente el sistema. Y así fue, los monos terminaron moviendo
los brazos a los que se les habían seccionado los nervios que llevaban la información
sensorial hacia la corteza. Este hallazgo sugería la presencia de programas motores
autónomos en el cerebro, preparados para poner en marcha de manera voluntaria los
movimientos del brazo desdiferenciado. Si no hubiera plasticidad en el cerebro, la
reorganización funcional de la corteza sensorial y motora sería difícilmente explicable.
Por lo que se refiere a las estructuras subcorticales, estas se ubican inmersas en
la sustancia blanca por debajo de la corteza cerebral (tal como indica su nombre)
y dispuestas circundando el diencéfalo y alrededor de los ventrículos laterales. Dentro
de las estructuras subcorticales destaca el cuerpo estriado, que abarca el núcleo
caudado, el putamen y el globo pálido. El putamen y el globo pálido conforman el núcleo
lenticular, mientras que los núcleos caudado y putamen constituyen el neoestriado
(el globo pálido corresponde al paeloestriado). De manera añadida al cuerpo estriado,
en la porción ventral de los hemisferios encontramos los núcleos basales del encéfalo
anterior. De entre todos estos núcleos, merece especial mención el núcleo basal de
Meynert por su relación con la memoria, el sistema de neurotransmisión colinérgico
y la enfermedad de Alzheimer. Otras estructuras subcorticales (ved la figura 18) son la amígdala (localizada en el interior del lóbulo temporal), los núcleos septales
(ubicados en la cara medial del ventrículo lateral, adyacentes al fórnix) y el núcleo
de la estría terminal (ubicado en la región ventral del ventrículo lateral).
¿Es verdad que la experiencia puede modificar la forma de trabajar de nuestro cerebro?
El arquitecto, pintor y escritor italiano Giorgino Vasari (1515-1574) recoge en su
célebre obra Vida de los mejores arquitectos, pintores y escultores italianos una colección extensa de biografías de diferentes artistas italianos. En esta obra
Vasari explica cómo Miguel Ángel llevó a cabo la realización del techo de la Capilla
Sixtina durante casi dos años seguidos de pintura: «El trabajo se llevaba a cabo en
condiciones muy fatigosas, dado que Miguel Ángel tenía que estar de pie con la cabeza
tendida hacia detrás, y su vista se debilitó de tal modo que durante varios meses
solo fue capaz de leer y mirar sus bocetos en dicha posición». Esta narración constituye
un claro ejemplo de cómo la experiencia puede llevar a inducir una reorganización
del cerebro adulto.
Desde un punto de vista anatómico, el SNP está compuesto fundamentalmente por los
ganglios y los nervios craneales y espinales, que se imbuyen en casi todas las partes
del cuerpo transportando información hacia el SNC y llevando la proveniente de este
hacia la periferia. Los nervios espinales tienen dos componentes claramente diferenciados:
por una parte, el componente aferente, que envía la información sensorial de los receptores
distribuidos en la piel, músculos, articulaciones y órganos internos hacia el SNC,
y por otra, el componente eferente, que transmite la información elaborada en el SNC
a los mecanismos eferentes, como músculos y glándulas. El soma de las neuronas sensoriales
se localiza en el ganglio de la raíz dorsal, mientras que el soma de las neuronas
eferentes se localiza en la propia médula espinal (ved la figura 21). Un esquema conceptual similar se puede extrapolar a la organización de los nervios
craneales.
Figura 21. Nervio espinal y médula espinal
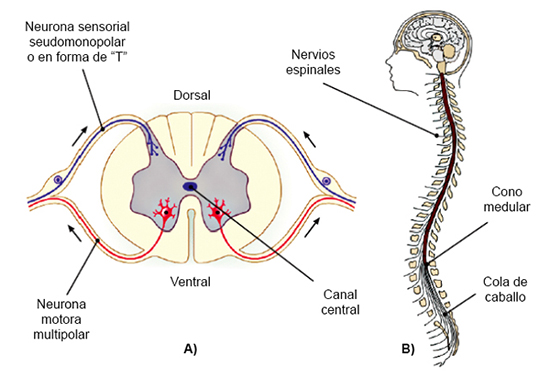
A) Nervio espinal con los aferentes sensoriales y los eferentes motores. La neurona
sensorial que llega a la médula espinal tiene el soma localizado en un ganglio que
queda posicionado cerca de la propia médula, el ganglio de la raíz dorsal. Esta neurona
sensorial establecerá sinapsis con interneuronas de la sustancia gris de la médula
espinal y con neuronas motoras que abandonaron la médula para formar parte del nervio
espinal y poder inervar el músculo diana. B) Médula espinal en relación con los nervios
espinales.
Desde un punto de vista funcional, es importante tener claro que el SNP tiene dos
componentes principales. Por un lado, el sistema nervioso autónomo (SNA) y, por otro,
el sistema nervioso somático (SNS).
En términos generales, podemos resumir que el SNS nos permite interactuar con el entorno,
mientras que el SNA nos permite interactuar con el interior del organismo. Para poder
interactuar con el entorno necesitamos recibir información de este. La información
la recibimos a través de los órganos de los sentidos. Asimismo, toda interacción implica
una respuesta y en el caso del SNS la respuesta está vinculada al control motor voluntario,
que es la que nos permite desplegar una serie de acciones hacia el entorno (ved la
figura 22A). De esta manera, el SNS recoge la información sensorial, mediante neuronas sensoriales
cuyo soma se localiza en ganglios cercanos a la médula espinal y al tronco del encéfalo,
de los diferentes receptores dispersos por la superficie del cuerpo, los órganos de
los sentidos y la musculatura. Asimismo, el sistema nervioso somático también proyecta
los axones de las neuronas motoras, cuyo soma se localiza en el SNC, para inervar
la musculatura esquelética.
Figura 22. Comparación de las fibras eferentes de los A) sistemas somático y B) autónomo

Las fibras eferentes del sistema nervioso somático quedan constituidas por los axones
de las neuronas motoras, cuyo soma se localiza en el sistema nervioso central (asta
ventral de la médula espinal o núcleos en el tronco del encéfalo, dependiendo de si
se trata de un nervio espinal o craneal, respectivamente) para inervar la musculatura
esquelética. Las fibras eferentes del sistema nervioso autónomo envían proyecciones
a las diferentes glándulas, a la musculatura cardiaca, a la musculatura lisa de la
piel (musculatura que inerva los folículos pilosos), a la musculatura lisa de los
ojos (que regula la acomodación del cristalino y la dilatación y contracción de la
pupila), a la musculatura lisa de los vasos sanguíneos y a la musculatura lisa de
las paredes de los órganos internos (el tracto gastrointestinal, el hígado, el páncreas,
el sistema respiratorio, los órganos reproductores, la vejiga, etc.). Estas fibras
eferentes se organizan en dos sistemas claramente diferenciados: el sistema nervioso
simpático y el sistema nervioso parasimpático. Asimismo, implican dos neuronas: una
neurona cuyo soma se encuentra en el SNC (neurona preganglionar) y otra neurona cuyo
soma se encuentra en un ganglio autónomo (neurona postganglionar).
El SNA, por su parte, nos permite interactuar con el interior del organismo. De este
modo, podemos decir que el SNA está implicado en la regulación interna del cuerpo,
estableciendo un equilibrio entre la respuesta de los órganos internos, las glándulas
y la vasculatura en función de las condiciones en las que se encuentre el organismo.
Para ello, el SNA cuenta con axones aferentes que informan al SNC del estado del interior
del organismo. Los cuerpos de las neuronas de dichas fibras aferentes se ubican en
los ganglios de las raíces dorsales y en los ganglios de los nervios craneales, entrando
los axones en la sustancia gris intermedia de la médula espinal y en el núcleo del
tracto solitario del tronco del encéfalo, respectivamente. Por otro lado, los axones
eferentes inervan la musculatura cardiaca, la musculatura lisa y glándulas endocrinas
(ved la figura 22B). Las fibras eferentes implican dos neuronas: una neurona cuyo soma se encuentra
en el SNC (neurona preganglionar) y otra neurona cuyo soma se encuentra en un ganglio
autónomo (neurona posganglionar). El soma de la neurona preganglionar se localiza
en el asta lateral de la médula espinal (segmentos torácicos y tres primeros lumbares
para la división simpática y segmentos sacros intermedios para la división parasimpática)
y en núcleos del tronco del encéfalo (división parasimpática). Por esa razón, la rama
simpática utiliza exclusivamente nervios espinales, mientras que la parasimpática
utiliza tanto nervios espinales como craneales (ved la figura 23).
Figura 23. Representación esquemática de las dos divisiones principales del sistema nervioso
autónomo: el sistema nervioso simpático y el sistema nervioso parasimpático

El esquema funcional y anatómico de la regulación autonómica o vegetativa puede resumirse
en un conjunto de interacciones entre los niveles central y periférico. A nivel central
existen una serie de estructuras encargadas de la regulación de la homeostasis interna,
como, por ejemplo, diferentes áreas corticales, algunos núcleos talámicos, la amígdala,
el hipocampo, y la formación reticular. Prácticamente toda la información procedente
de estas áreas y núcleos se integra en el hipotálamo. Del hipotálamo salen conexiones
directas e indirectas (a través del núcleo del tracto solitario) hacia la médula espinal
y el tronco del encéfalo. A partir de este nivel, las neuronas cuyo soma se localiza
en el sistema nervioso central (núcleos del tronco del encéfalo o asta ventral de
la médula espinal) salen para sinaptar con los ganglios autónomos (que en el caso
de la rama simpática el ganglio se localiza lindante al sistema nervioso central,
mientras que en el caso de la rama parasimpática se ubica a una distancia considerable,
cerca de la diana que inervar). Las neuronas preganglionares simpáticas dejan el sistema
nervioso central a partir de los nervios espinales torácicos y los primeros lumbares,
mientras que las neuronas parasimpáticas lo hacen a través de los nervios craneales
III, VII, IX y X y a través de los nervios espinales de la zona sacra (S2-S4). En
el ganglio autónomo se da la sinapsis entre la neurona procedente del sistema nervioso
central (denominada neurona preganglionar) y la neurona que inervará el tejido diana
(neurona postganglionar).
En el SNP nos encontramos tanto con fibras eferentes somáticas y viscerales, que llevan
la información desde el sistema nervioso central hasta la musculatura esquelética
(somáticas), la musculatura lisa, el corazón y las glándulas (viscerales), como con
fibras aferentes somáticas y viscerales, que transmiten información al sistema nervioso
central referente a los órganos de los sentidos, a los receptores de la piel y de
los músculos (somáticas), y a los órganos internos (viscerales).
Por otro lado, resulta importante destacar que el sistema nervioso autónomo puede
interactuar con el sistema neuroendocrino. Un ejemplo clave de esta interacción es
lo que sucede cuando un animal está delante de un agente potencialmente peligroso
y se pone en marcha la respuesta de estrés (ved la figura 24).
Figura 24. Interacción de los sistemas neuroendocrino (eje hipotálamo-pituitario-adrenal –HPA–)
y autonómico en la respuesta al estrés

En respuesta al estrés, las neuronas parvocelulares del núcleo paraventricular del
hipotálamo sintetizan la hormona liberadora de corticotropina (CRH). Esta última es
liberada junto con la vasopresina en la sangre (eminencia media), produciendo la secreción
en la circulación sanguínea de la hormona adrenocorticotropa (ACTH) por parte de las
células secretoras de la hipófisis anterior. La ACTH activa la captación de glucosa
en los músculos y estimula la secreción de glucocorticoides en la corteza de la glándula
suprarrenal. Los glucocorticoides facilitan la presencia de glucosa en los tejidos
que la requieren para poner en marcha la respuesta más adaptativa. Por otro lado,
en relación con el sistema autónomo, la activación del sistema nervioso simpático
se inicia cuando la información hipotalámica llega a las células preganglionares simpáticas
de la médula espinal, por medio del núcleo paraventricular del hipotálamo o, indirectamente,
a través del núcleo del tracto solitario. Esta información llega a la cadena ganglionar
simpática paravertebral, donde se localiza la sinapsis con las neuronas posganglionares.
Estas últimas liberan noradrenalina en los diferentes órganos que inervan. Asimismo,
las neuronas preganglionares simpáticas producen la activación directa de la médula
de la glándula suprarrenal, estimulando la liberación de adrenalina al torrente circulatorio.
Las sustancias secretadas por la acción del sistema nervioso simpático (noradrenalina
y adrenalina) aumentan el flujo sanguíneo a los músculos y provocan que el glucógeno
almacenado se convierta con rapidez en glucosa para ser utilizada. Los glucocorticoides
liberados en la circulación sanguínea promueven la movilización de la energía almacenada
y potencian los numerosos efectos mediados por el sistema nervioso simpático. El sistema
nervioso simpático también inerva directamente la corteza de la glándula suprarrenal,
participando en la regulación de la liberación de glucocorticoides. En definitiva,
el eje HPA y el sistema simpático tienen acciones complementarias en todo el cuerpo,
incluyendo la movilización de energía y el mantenimiento de la presión sanguínea durante
el estrés.























