2.1. SISTEMA SOMATOSENSITIVO OROFACIAL
La percepción es un proceso nervioso que permite al organismo recibir y elaborar la información del entorno contrastándola con la representación cortical. Gracias al sistema somatosensitivo podemos percibir el medio externo e interno otorgándonos la sensibilidad (Figura 1).
Figura 1
Procesos involucrados en el fenómeno de la percepción
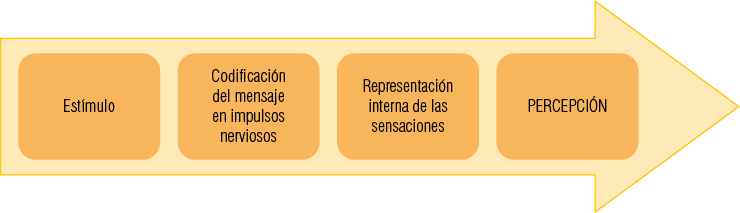
En el encéfalo, la información captada desde los diferentes receptores se utiliza para cuatro funciones: Percepción, Control del movimiento, Regulación de los órganos internos y Mantención de la activación. Todo sistema sensorial tiene un diseño en común caracterizado por receptores, vías ascendentes, corteza sensitiva primaria y corteza de asociación (Figura 2).
Figura 2
Típica vía somatosensitiva constituida por tres neuronas sensitivas
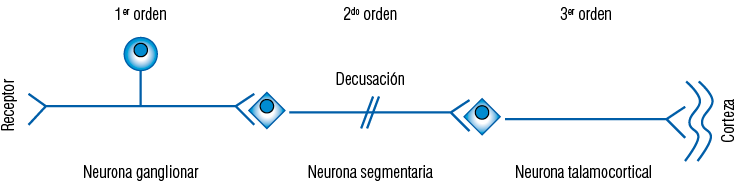
Las vías del sistema somatosensitivo orofacial se encuentran dispuestas en serie y en paralelo organizadas de forma somatotópica, es decir ciertas áreas corporales proyectan a zonas específicas de la corteza somestésica. La porción distal de la neurona de primer orden o aferente primaria se caracteriza por tener una diferenciación específica para cada tipo de estímulo, llamada receptor. Existen receptores específicos para cada tipo de estímulo y la respuesta generada por la estimulación estará directamente relacionada con la calidad del estímulo, es decir, de la intensidad y duración. De acuerdo a la intensidad, el estímulo se clasifica en: adecuado, umbral, subumbral. Según la respuesta al estímulo, los receptores se clasifican en: receptores de adaptación rápida o fásicos, y receptores de adaptación lenta o tónicos.
La sensibilidad de un área corporal está en relación al campo receptor, el cual es un área corporal circunscrita correspondiente a la superficie receptora de la neurona ganglionar. El campo receptor está inervado por la ramificación del nervio periférico de la neurona ganglionar en la cual se encuentran los receptores (Figura 3).
Un campo receptor tiene dos cualidades que le confieren mayor o menor poder de discriminación; ellas son el tamaño y el traslape. El tamaño es importante en la resolución espacial del estímulo. A menor área del campo receptor, mayor discriminación. El traslape de campos receptores permite mayor poder de discriminación. A menor traslape, mayor discriminación. La densidad de receptores dentro de un área también afecta la capacidad discriminatoria. A mayor densidad y menor traslape de pequeños campos de receptor que existan en un área, mayor será la discriminación (Figura 4). Otro atributo importante para una buena discriminación es la presencia de inhibición lateral.
Figura 3
Diagrama que describe un campo receptor
La neurona de proyección corresponde a la segunda neurona o neurona segmentaria de la vía somatosensitiva.

Figura 4
Los campos de receptor son comparables por analogía a los pixeles de una imagen, mientras mayor sea la densidad y menor su tamaño mayor resolución existirá

La capacidad de discriminar la forma, tamaño, textura y peso de un objeto sin reconocimiento visual se denomina estereognosia oral, y está enormemente desarrollada en la cavidad oral debido a la gran densidad y variedad de receptores presentes en ella. Debido a que la boca es la puerta de entrada al organismo, la estereognosia oral sirve para explorar el medio externo y prevenir la ingesta de elementos dañinos.
2.2. RECEPTORES OROFACIALES
La cavidad oral es un área del organismo humano que se caracteriza por una densa, múltiple y variada presencia de receptores, así como de una gran representación en la corteza somestésica, lo que le otorga la facultad de una alta discriminación de diversos tipos de estímulos. Gracias a esa característica podemos discriminar diversos grados de termalgesia, formas, texturas, sabores. La cavidad oral satisface necesidades básicas del ser humano como la alimentación, hidratación, comunicación y afecto. En el recién nacido es su principal forma de vinculación con la madre, y durante el desarrollo, el lactante iniciará la exploración del medio externo a través de la boca. Las cualidades anteriores son consecuencia de los receptores presentes en el territorio orofacial, los cuales se clasifican en la Tabla 1.
Tabla 1
Clasificación general de los receptores orofaciales
|
Información sensitiva |
• Mecanoreceptores de tacto y presión (epicrítico, protopático) • Termorreceptores • Nociceptores • Receptores dentarios (pulpares, periodontales) |
|
Información propioceptiva |
• Articulares • Husos neuromusculares • Órganos tendinosos de Golgi |
|
Información sensorial |
• Receptores gustativos y olfato • Receptores deglución y vómito |
2.2.1. Exteroceptores
Son responsables de la sensibilidad somática y se ubican en mayor concentración en la región anterior de la cavidad bucal, donde las sensaciones de dientes, periodonto y mucosas son importantes en la discriminación táctil y en el control de la fuerza masticatoria en relación a los distintos alimentos. Particularmente, los receptores táctiles y de presión se concentran más en los labios y punta de la lengua, que son la zona del cuerpo donde existe la mayor densidad de estos receptores. En estas zonas hay una alta sensibilidad táctil, permitiendo distinguir dos estímulos diferentes separados hasta por 1 mm. También se encuentran receptores táctiles en la mucosa palatina, así como en la mucosa gingival.
Los mecanorreceptores de tacto y presión se clasifican en:
a. Corpúsculos de Merkel. Son receptores tónicos de campo receptor pequeño y de adaptación lenta. Indican con mucha precisión la localización de la presión sobre la piel.
b. Corpúsculos de Meissner. Son receptores fásicos de campo receptor pequeño, aunque más grande que el de los receptores de Merkel, y de adaptación rápida.
c. Corpúsculos de Pacini. Son receptores fásicos de campo receptor grande y adaptación muy rápida. Tienen poca precisión para indicar la localización del estímulo, pero responden a vibraciones de alta frecuencia.
d. Terminaciones de Ruffini. Son receptores tónicos con campo receptivo grande y adaptación lenta, detectan el estiramiento de la piel. La información que proviene de los mecanorreceptores viaja por las fibras nerviosas A-beta (Figura 5).
Los termorreceptores y los nociceptores del dolor se encuentran más concentrados en la porción externa de los labios y en la región anterior de la cavidad bucal, ejerciendo una actividad protectora al detectar la temperatura de los alimentos. De allí se explica la mayor sensibilidad dolorosa de la cavidad oral. Las terminaciones nerviosas que detectan las noxas son denominadas nociceptores, los cuales son de diversos tipos en cuanto a su estructura y a la velocidad de conducción del impulso nervioso. La existencia de nociceptores con diferentes velocidades de conducción hace que el dolor se perciba en forma bifásica, es decir, un momento en que se percibe el dolor en forma rápida, seguido luego de percepción dolorosa más lenta. Los nociceptores se clasifican en:
Figura 5
Diagrama de los diferentes tipos de mecanorreceptores y nociceptores
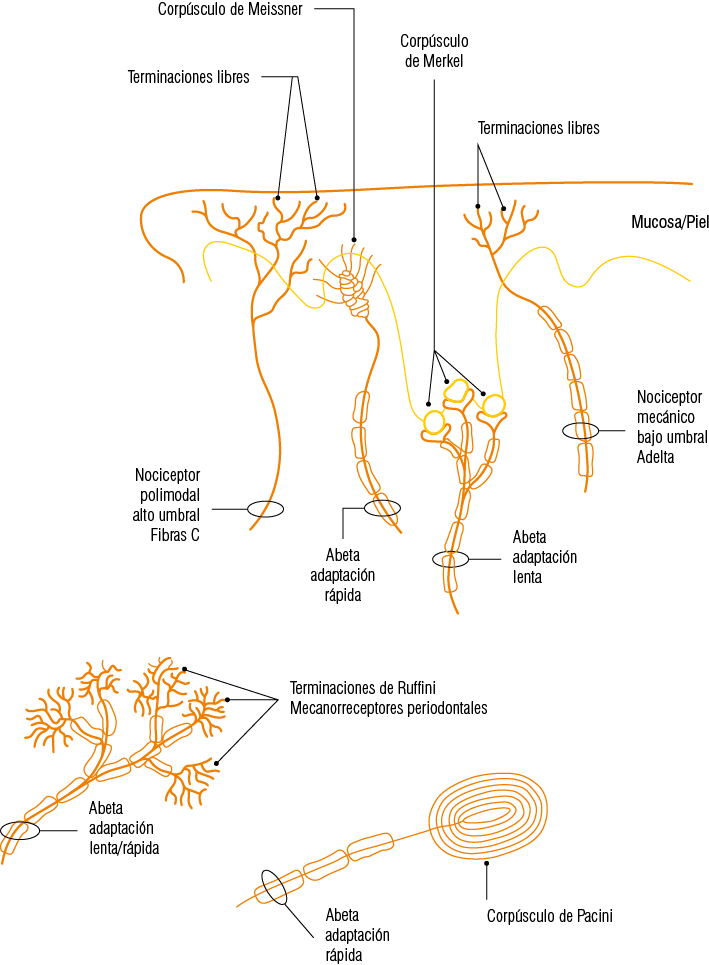
a. Nociceptores mecánicos de alto umbral, los que corresponden a terminaciones de fibras A beta. Ellos descargan frente a estímulo intenso contribuyendo a la percepción normal del dolor.
b. Nociceptores mecánicos de bajo umbral, constituidos por terminaciones libres mielínicas A delta de pequeño diámetro, los cuales descargan frente a estímulos térmicos y mecánicos potencialmente dañinos como por ejemplo una punción o alimentos a alta/baja temperatura ya sea por calor o congelación. Ellos evocan lo que se conoce como primer dolor, cuya función es generar el reflejo de retirada. Este dolor se caracteriza por durar solo mientras el estímulo se encuentra presente, una vez retirado el dolor cesa. Este dolor es bien localizado y su función es alertarnos de una amenaza o noxa.
c. Nociceptores polimodales de alto umbral, formados por terminaciones libres de fibras amielínicas C. Ellas se estimulan indistintamente por estímulos nociceptivos mecánicos (presión intensa), térmicos (temperaturas extremas) y químicos (substancias osmóticas externas, mediadores de la inflamación liberados en el sitio de la lesión, p. ej. K+, prostaglandinas, bradikinina). Estos nociceptores participan en el dolor generado por daño tisular capaz de desencadenar la liberación de mediadores de la inflamación en el sitio de la lesión, y de neuropéptidos (sustancia P, CGRP) y neurotrofinas (factor de crecimiento neural) por vía axonal retrógrada. Al ser estimulados evocan el segundo dolor, caracterizado por ser de tipo urente, difuso, mal localizado y sostenido en el tiempo.
Una característica propia de la nocicepción es que la sensación dolorosa, al contrario de otros tipos de sensibilidad, no se atenúa con la estimulación repetida, sino que se hace más intensa, esto se denomina hiperalgesia. La hiperalgesia se debe en parte a un fenómeno de sensibilización periférica (los nociceptores se vuelven más sensibles por la liberación de factores de inflamación, como las prostaglandinas) y en parte a un fenómeno de sensibilización central (en la sinapsis de los núcleos sensitivos del trigémino, entre las fibras aferentes y las neuronas de segundo orden trigeminotalámicas, la cual se potencia con la estimulación repetida).
2.2.2. Propioceptores
Se describen los: a) husos neuromusculares; b) órganos tendinosos de Golgi; y c) propioceptores articulares. Estos entregan información acerca de los movimientos y posiciones de la mandíbula en el espacio. Ellos se encuentran distribuidos en los músculos mandibulares y en las articulaciones temporomandibulares. Serán descritos en detalle en el capítulo de mecanismos neuromusculares periféricos.
2.2.3. Visceroceptores
Se encuentran asociados a la sensibilidad sensorial como gusto y olfato y a la actividad vegetativa como la deglución, salivación, vómito, etc. Estos receptores se ubican por excelencia en la lengua, faringe, laringe y nariz.
2.3. VÍAS SENSITIVAS GENERALES
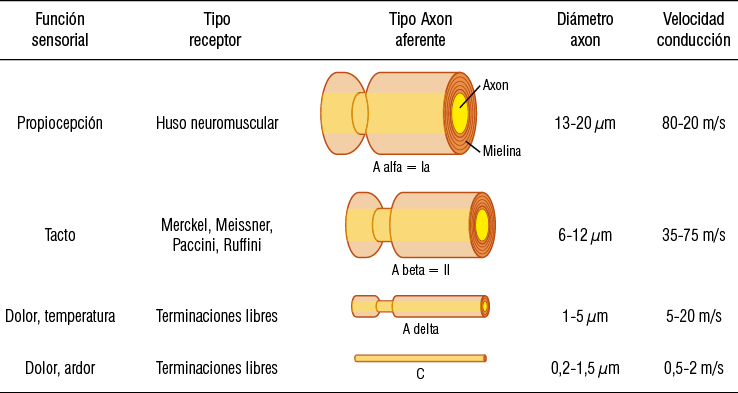
Los diversos estímulos captados por los receptores antes descritos viajarán por diferentes vías axonales, a través de los nervios sensitivos hacia los correspondientes núcleos sensitivos. La información propioceptiva muscular y articular utiliza fibras axonales aferentes mielinizadas de gran diámetro y alta velocidad de conducción tipo A alfa - Ia, (sinónimos ambas). Los mecanorreceptores para tacto/presión de piel, mucosa, periodontales y articulares utilizan fibras mielínicas de diámetro y velocidad intermedia tipo A beta - II (sinónimos ambas). La sensación térmica y dolorosa captada por los termorreceptores y nociceptores es conducida por fibras mielínicas de diámetro pequeño A delta y fibras amielínicas de baja velocidad de conducción tipo C (Figura 6).
Figura 6
Tipos de fibras sensitivas clasificadas según diámetro del axón, velocidad de conducción, receptor y función sensorial
2.4. TRIGÉMINO SENSITIVO
El nervio trigémino está compuesto por tres ramas independientes: el oftálmico, el maxilar y el mandibular. Los nervios oftálmico y maxilar son ambos sensitivos, en cambio el mandibular es sensitivo y motor.
Las ramas sensitivas trigeminales transmiten la información mecánica, térmica, nociceptiva y propioceptiva de las regiones craneofaciales hacia el SNC. El nervio trigémino posee una influencia sobre el crecimiento, desarrollo y mantención de las estructuras y tejidos craneofaciales a través de sus funciones tróficas. Por sus mecanismos reflejos brinda protección a los sistemas sensoriales, así como también a los sistemas homeostáticos internos de cambios ambientales.
El nervio trigémino es la base de los diferentes arcos reflejos orofaciales. El trigémino conduce la mayor parte de la información sensitiva de la región orofacial y la duramadre. También es responsable de la inervación motora de la musculatura del primer arco branquial: temporales; pterigoideos mediales y laterales; maseteros; milohioideos; genihioideos, vientres anteriores del digástrico; así como de los músculos tensor del tímpano y tensor del velo palatino.
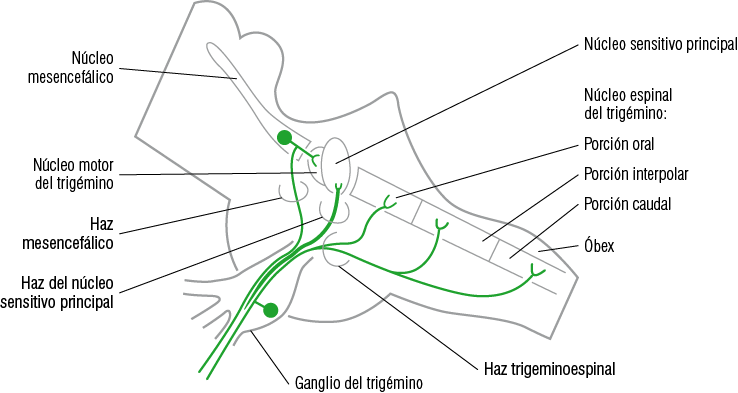
Su ganglio trigeminal es considerado como un ganglio sensitivo del SN, similar a los ganglios espinales. De su borde anterior, nacen las tres ramas periféricas trigeminales. Del borde posterior nacen las fibras que constituyen la prolongación central, las cuales ingresando al SNC irán a conformar los distintos haces que harán sinapsis con sus núcleos respectivos, a saber: núcleo mesencefálico, núcleo sensitivo principal, núcleo espinal, núcleo motor. Las prolongaciones centrales de las neuronas ganglionares que conforman la raíz sensitiva al entrar en la parte media del Puente pueden terminar bifurcándose cerca del 50% en una rama ascendente corta y otra descendente larga; o bien, el resto termina no bifurcándose y agrupándose en ramas ascendentes cortas o descendentes largas. Estas fibras nerviosas al entrar al mesencéfalo formarán tres haces (Figura 7):
1. Haz del núcleo sensitivo principal. Formado por el conjunto de fibras axonales ascendentes bifurcadas y no bifurcadas, que harán sinapsis en el núcleo sensitivo principal. Este haz conduce la sensibilidad de tacto-presión epicrítico y la propiocepción consciente.
2. Haz del núcleo espinal o haz trigeminoespinal. Es el conjunto de fibras axonales descendentes bifurcadas y no bifurcadas, que terminan por hacer sinapsis en el núcleo espinal del V par. Este haz conduce el dolor, la temperatura y el tacto-presión protopático, y en un menor porcentaje el tacto-presión epicrítico y la propiocepción consciente.
3. Haz mesencefálico. Formado por el conjunto de fibras axonales que ingresan mayoritariamente al SNC a través de la raíz motora hacia el núcleo mesencefálico. Conduce información propioceptiva inconsciente y mecanosensitivas periodontales y mucosales (principalmente gingivales y paladar duro).
Figura 7
Diagrama de los núcleos del trigémino y sus haces respectivos
2.4.1. Núcleos sensitivos del trigémino
Los núcleos del trigémino representan los centros segmentarios sensitivos de la región cefálica y están conformados por una larga y continua columna de neuronas que se extiende desde la porción superior del mesencéfalo hasta la médula cervical. Consisten en tres núcleos sensitivos, que en orden rostrocaudal corresponden al núcleo mesencefálico, el núcleo sensitivo principal y el núcleo espinal.
2.4.1.1. Núcleo sensitivo principal
Es el más amplio de los tres núcleos trigeminales. Está ubicado en el puente medio cerca del punto de entrada u origen aparente del trigémino y lateral como levemente dorsal e inferior al núcleo motor. Está constituido por los somas de las neuronas de segundo orden, donde sinaptan las prolongaciones profundas o ascendentes de las neuronas de primer orden, las que en su conjunto constituyen el haz del núcleo sensitivo principal. Los axones de las neuronas segmentarias de segundo orden forman las distintas conexiones de proyección del núcleo sensitivo principal.
El núcleo sensitivo principal recibe las fibras portadoras de información de tacto-presión epicrítico (bien localizado o altamente discriminativo) y de propiocepción consciente o cortical, es decir, de la información propioceptiva que debe llegar a la corteza somestésica para poder tener conciencia de ella. Neuronas del núcleo sensitivo principal, especialmente las localizadas en su subnúcleo dorsomedial, participan en la generación de patrones motores rítmicos durante el acto masticatorio. Constituyen el centro generador de los patrones rítmicos durante la masticación.
2.4.1.2. Núcleo espinal
Es una larga columna de sustancia gris, que se extiende caudalmente a partir del núcleo sensitivo principal hasta los primeros segmentos cervicales de la médula espinal. El núcleo espinal está conformado por neuronas de segundo orden que reciben las conexiones de las prolongaciones profundas o descendentes de las neuronas de primer orden, las que en su conjunto constituyen el haz del núcleo espinal o haz trigeminoespinal. Este haz también contiene información somática general de cuatro nervios craneales: facial (nervios intermedios), glosofaríngeo, vago, hipogloso, y también desde los tres primeros
nervios cervicales.
Las fibras del haz trigémino espinal ocupan una orientación somatotópica y organizada en el núcleo espinal como un rostro invertido: las fibras de los nervios intermedios, glosofaríngeo y vago, así como la división mandibular del V par están situadas dorsalmente; la división oftálmica ventralmente y la división maxilar se sitúa entre ambas (Figura 8).
Figura 8
Esquema de la distribución somatotópica de las vías sensitivas del trigémino y su proyección hacia los diferentes núcleos
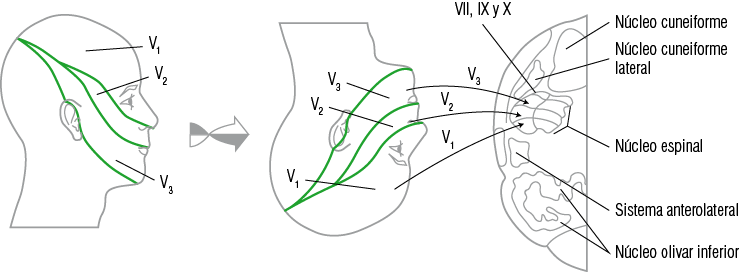
El núcleo espinal se divide de manera anatómica y funcional en tres subnúcleos:
1. Subnúcleo oral. Se extiende desde el polo caudal del núcleo motor trigeminal hasta el subnúcleo interpolar. Su porción más rostral está interdigitada con el subnúcleo ventrolateral del núcleo sensitivo principal, ubicándose medial a este subnúcleo. La característica del subnúcleo oral es su vasto número de neuronas multipolares de diferente tamaño. El subnúcleo oral en conjunto con el núcleo sensitivo principal conforman la unidad rostral del sistema trigeminal que recibe la información de tacto-presión epicrítico y de propiocepción consciente o cortical.
2. Subnúcleo interpolar. Se ubica entre los subnúcleos oral y caudal, se extiende entre el límite caudal del núcleo facial y el extremo caudal (obex) del cuarto ventrículo. Contiene una mezcla casi similar de neuronas predominantemente de tamaño medio y pequeño, 75% de las cuales están relacionadas con un bajo umbral mecanosensitivo. No obstante, también presenta minoritariamente neuronas nociceptivas específicas y neuronas de amplio rango dinámico.
3. Subnúcleo caudal: en sí mismo funciona como un verdadero centro de integración de la información sensitiva orofacial. Este consiste en una larga porción de sustancia gris laminada que emerge desde las astas dorsales de la médula cervical hasta el obex del cuarto ventrículo. Este subnúcleo es especialmente importante en la conducción de la percepción dolorosa de los dientes, y región orofacial, adquiriendo una importancia significativa en el procesamiento del dolor. Sobre las neuronas de segundo orden de este subnúcleo, llamadas también neuronas nociceptivas, convergen los inputs aferentes dolorosos de las regiones superficiales y profundas de la cara que explica el fenómeno del dolor difuso. En este subnúcleo también se ha descrito la existencia de una gran convergencia nociceptiva de diversas estructuras tales como la piel, mucosa, articulaciones temporomandibulares, músculos mandibulares, pulpa dentaria y vasos durales, así como desde otros nervios craneales (VII, IX, X, XII) y cervicales C1, C2, C3. Estas convergencias explican el dolor referido y difuso que frecuentemente se observa en varios cuadros clínicos de dolor orofacial. El subnúcleo interpolar y el subnúcleo caudal, conforman la unidad caudal del sistema trigeminal que recibe la información de dolor, temperatura y tacto-presión protopática. El subnúcleo caudal presenta una morfología y laminación similar a las astas dorsales de la
médula espinal:
• la lámina I, equivalente a la zona marginal de la asta dorsal encontrándose en ella las neuronas nociceptivas específicas;
• la lámina II es equivalente a la sustancia gelatinosa y es el lugar en donde se lleva a cabo la inhibición de la nocicepcion. Aqui se distinguen dos tipos de neuronas, las celulas limitantes de Cajal y las celulas centrales de Cajal;
• las láminas III - IV se denominan núcleo magno celular del sistema trigeminal, equivalente al núcleo proprio de la asta dorsal que recibe estímulos mecánicos propioceptivos de posición, movimiento, discriminación espacial y vibración;
Figura 9
Diagrama que representa la diferente distribución de las fibras nerviosas que conducen la información mecánica y termalgésica que llegan al subnúcleo caudal
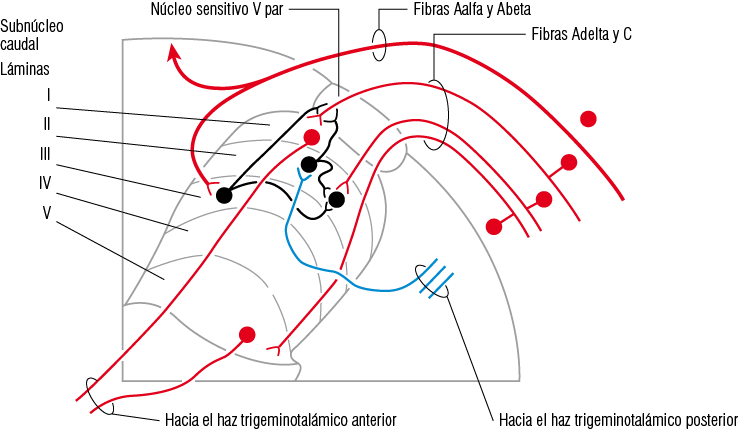
Nótese que las fibras A delta y C se distribuyen en las láminas I - II - V (termalgesia), a diferencia de las fibras A alfa y beta que llegan a la lámina III (propiocepción).
• la lámina V (base de la asta dorsal) se extienden rostralmente desde la médula espinal hasta entrar en la base del subnúcleo caudal. Aqui se encuentran las neuronas de ámplio rango dinámico (Figura 9).
Las neuronas de las láminas I - II - V del subnúcleo caudal se caracterizan por ser nociceptivas y corresponden a dos tipos:
1. Neuronas nociceptivas específicas. Reciben solamente inputs aferentes de axones de fibras tipo A delta y C, y responden a estímulos nociceptivos de tipo mecánico y térmico intensos provenientes de sus campos receptivos. Estas neuronas tienen la capacidad de identificar la localización del estímulo.
2. Neuronas nociceptivas no específicas o de amplio rango dinámico. Reciben inputs aferentes de fibras tipo A alfa y A beta provenientes de los mecanorreceptores de bajo umbral, así como de fibras tipo A delta y C procedentes de los nociceptores mecánicos, térmicos y polimodales de alto umbral. Ellas pueden ser excitadas por estímulos táctiles de baja intensidad, así como por estimulación intensa, por lo que tienen la capacidad de identificar diferentes intensidades del dolor. Su denominación de amplio rango dinámico se debe a su capacidad de activación frente a estímulos con un gran rango de intensidades. Las neuronas nociceptivas de amplio rango dinámico conducen principalmente información nociceptiva, sin embargo, también son capaces de transmitir sensación táctil frente a estímulos débiles. En condiciones patológicas estas neuronas pueden sensibilizarse hasta alcanzar una activación frente a estímulos mecánicos inocuos, desencadenando una sensación dolorosa (Alodinia). Este fenómeno es producido por la sensibilización de la neurona nociceptiva de segundo orden y es la base de la teoría de la sensibilización central. El conjunto de las láminas I, II y V del subnúcleo caudal procesan la información enviándola a centros talámico y finalmente a la corteza somatosensorial.
Las fibras de dolor procedente de las aferencias pulpares del complejo pulpodentinario se conectan principalmente en los subnúcleos oral e interpolar, así como también en las láminas I y V del subnúcleo caudal. En cambio, las aferencias de dolor general (piel, mucosas, músculos y articulaciones) se proyectan mayoritariamente al subnúcleo caudal. Es destacable también que las fibras A alfa y A beta y sus mecanorreceptores de bajo umbral asociados, son especialmente numerosos en tejidos superficiales cutáneos y mucosales de la región orofacial. Este hecho probablemente refleja la importancia de la región orofacial en la función de exploración táctil del ambiente externo.
2.4.1.3. Núcleo mesencefálico
Es una columna neuronal delgada y alargada ubicada rostral al núcleo sensitivo principal en el puente medio y que debe su nombre a que se extiende a lo largo del mesencéfalo. Constituido mayoritariamente por neuronas pseudounipolares (equivalentes a neuronas de primer orden o ganglionares), sus prolongaciones periféricas provienen directamente desde diversos propiorreceptores (husos neuromusculares, órganos tendinosos de Golgi, propioceptores articulares y mecanorreceptores periodontales, gingivales y paladar duro) y penetran al tronco encefálico por la raíz motora del trigémino. Por esta razón se compara a este núcleo con un ganglio sensitivo que ha quedado incluido en el sistema nervioso central. Las prolongaciones profundas del núcleo mesencefálico establecen las diferentes conexiones reflejas. Esta vía consta de una sola neurona ubicada en el núcleo mesencefálico que es segmentaria y ganglionar a la vez. Al núcleo mesencefálico llega la información sobre propiocepción y mecanocepción inconsciente o cerebelosa del territorio trigeminal, procedente de músculos, tendones, articulaciones, receptores periodontales, receptores mucosales. Al mismo tiempo está encargado mayoritariamente de las conexiones reflejas, que constituyen la base de los mecanismos neuromusculares que regulan los movimientos mandibulares.
2.4.2. Conexiones de proyección de los núcleos sensitivos
Los núcleos sensitivo principal, espinal y mesencefálico que funcionalmente representan los centros segmentarios sensitivos de la región cefálica, poseen conexiones de proyección hacia los centros superiores, principalmente para regular la coordinación y el aprendizaje.
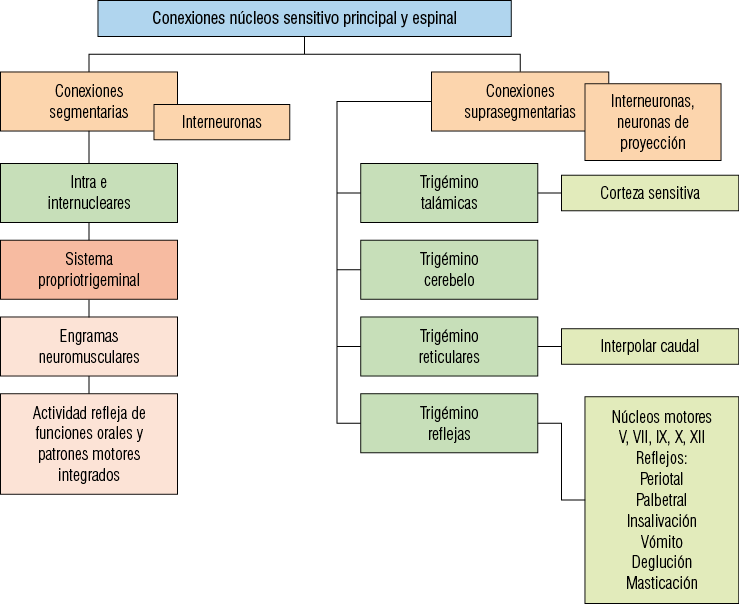
Los núcleos sensitivo principal y espinal poseen las siguientes conexiones:
a. Conexiones segmentarias intranucleares e internucleares: se establecen
por medio de interneuronas cuyos axones se arborizan formando colaterales ascendentes y descendentes que recorren el cuerpo de estos núcleos. Las conexiones intranucleares e internucleares constituyen en su conjunto el denominado “sistema propriotrigeminal”, el cual reúne el subnúcleo caudal con porciones rostrales de los núcleos espinal y sensitivo principal. Su función es modular la actividad de todos los núcleos sensitivos que reciben conexiones desde el ganglio trigeminal. Pertenece al sistema propriotrigeminal una red neural involucrada en el procesamiento sensorial y en la respuesta motriz de diferentes funciones orofaciales a través de la cual es capaz de regular la acción muscular mediante la creación de engramas neuromusculares que se seleccionan adecuadamente según la información sensorial recibida.
b. Conexiones suprasegmentarias: se establecen por medio de neuronas de proyección y de interneuronas. Estas conexiones son:
• Conexiones trigeminotalámicas. Aquellas que corresponden a las vías sensitivas de tacto-presion y termalgésica que ascienden al tálamo a través de los haces trigémino talámico anterior y posterior respectivamente.
• Conexiones trigeminocerebelosas. Por medio de axones provenientes de neuronas de proyección, especialmente del subnúcleo interpolar y caudal del espinal, llegan al cerebelo a través de los pedúnculos cerebelosos inferiores y que están encargadas de la propiocepción inconsciente.
• Conexiones trigeminorreticulares. Las interneuronas de los núcleos sensitivo principal y espinal tienen importantes conexiones con centros de la formación reticular del tronco encefálico, como también neuronas que se proyectan a los núcleos intralaminares del tálamo.
• Conexiones trigeminorreflejas. Se establecen con los diferentes núcleos motores craneales del tronco encefálico tales como: núcleo motor del trigémino, para los reflejos mandibulares; núcleo motor del VII par, para reflejos peribucales y reflejo palpebral; núcleos salivales superiores e inferior para la insalivación del alimento durante la masticación; núcleo interdorsal del X par para el reflejo del vómito; núcleo del IX y XII par para los reflejos linguales durante la masticación y deglución. Las conexiones con los núcleos motores de los pares craneales V, VII y XII, permiten la coordinación refleja de las estructuras que inervan durante el acto masticatorio (Figura 10).
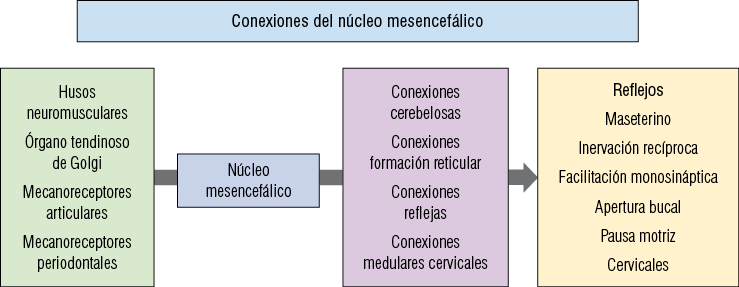
El núcleo mesencefálico posee las siguientes conexiones:
a. Conexiones reflejas: ellas forman los arcos reflejos polisinápticos que controlarán los movimientos de los músculos mandibulares. Las conexiones hacia el núcleo motor del V son bilaterales, ya que la respuesta contráctil se establece en forma bilateral en estos músculos, a pesar de que el estímulo provenga del estiramiento de un solo músculo. También se establecen conexiones reflejas con otros núcleos motores de pares craneales para una mejor coordinación entre los movimientos mandibulares y linguales durante la función masticatoria.
Figura 10
Conexiones de proyección de los núcleos sensitivos del trigémino
b. Conexiones cerebelosas: se establecen a través de los pedúnculos cerebelosos superiores.
c. Conexiones con la formación reticular: se conectan a través de interneuronas con diferentes áreas del sistema o formación reticular principalmente vecinas al núcleo motor del trigémino.
d. Conexiones medulares cervicales: está constituida por la conexión desde el núcleo mesencefálico en forma ipsilateral directa a los segmentos medulares cervicales hasta C2-C3. Ella es el sustrato neural del control de los reflejos trigémino-cervicales, el cual es importante en la coordinación del movimiento y postura de la cabeza durante la función masticatoria (Figura 11).
Figura 11
Resumen de la información, conexiones y reflejos mediados por el núcleo mesencefálico del trigémino
2.4.3. Vías sensitivas trigeminales
El nervio trigémino conduce la sensibilidad por diferentes vías y las agrupa de acuerdo al tipo de sensibilidad, a los receptores involucrados, al diámetro de los axones y según el núcleo sensitivo que proyecta. Cada vía sensitiva porta una sensibilidad específica. Desde un punto de vista funcional y anatómico existen tres vías sensitivas del trigémino.
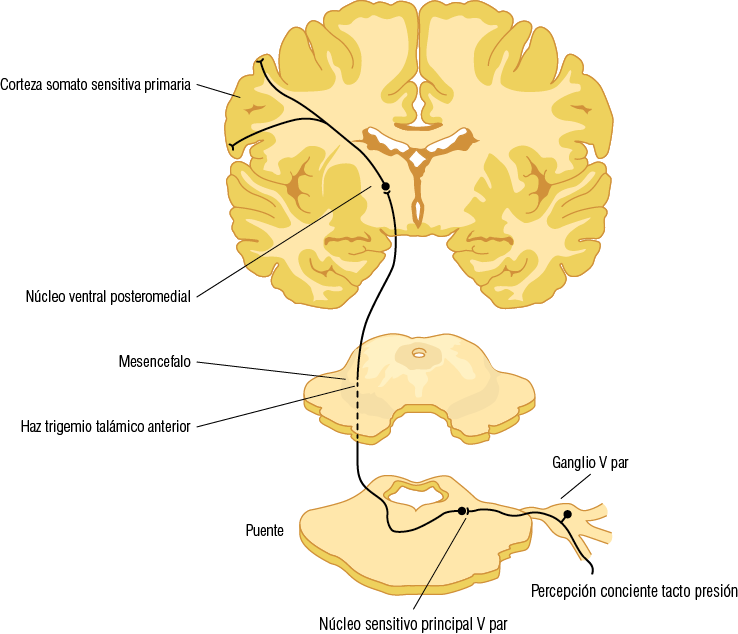
1. Vía mecanosensitiva consciente de tacto y presión. Conduce la sensibilidad de tacto y presión de la piel y mucosas del territorio orofacial y de la sensibilidad propioceptiva consciente proveniente de las articulaciones temporomandibulares y de los músculos mandibulares, las cuales informan acerca de la posición. Las neuronas de primer orden de esta vía corresponden a las neuronas aferentes primarias o ganglionar con fibra axónica tipo A-beta. Esta primera neurona de la vía trigeminal corresponde a una neurona pseudounipolar cuyo soma se ubica en el ganglio trigeminal y su prolongación periférica se diferencia en su extremo terminal en los distintos mecanorreceptores (Merkel, Meissner, Pacini y Ruffini) de las tres ramas del trigémino. Sus prolongaciones centrales forman el haz del núcleo sensitivo principal y el haz del núcleo espinal, los cuales llegan al núcleo sensitivo principal o bien al subnúcleo oral del núcleo espinal del V par donde hacen sinapsis con la segunda neurona. Los axones de las neuronas de segundo orden de esta vía, cruzándose previamente en el mismo segmento, se juntan y forman el haz trigeminotalámico anterior, el cual asciende hasta llegar al núcleo ventral posteromedial del tálamo. Aquí hacen sinapsis con las neuronas de tercer orden o de proyección tálamo-cortical las que finalmente se conectarán con la corteza somestésica primaria ubicada en la circunvolución postcentral o área 1-2-3 de Brodman, así como también a la corteza somestésica secundaria. La información trigeminal que llega a la corteza sensitiva presenta una distribución somatotópica invertida. El homúnculo sensorial del territorio trigeminal se encuentra ocupando casi toda la mitad inferior de la circunvolución postcentral (Figura 12).
Figura 12
Vía mecanosensitiva del trigémino
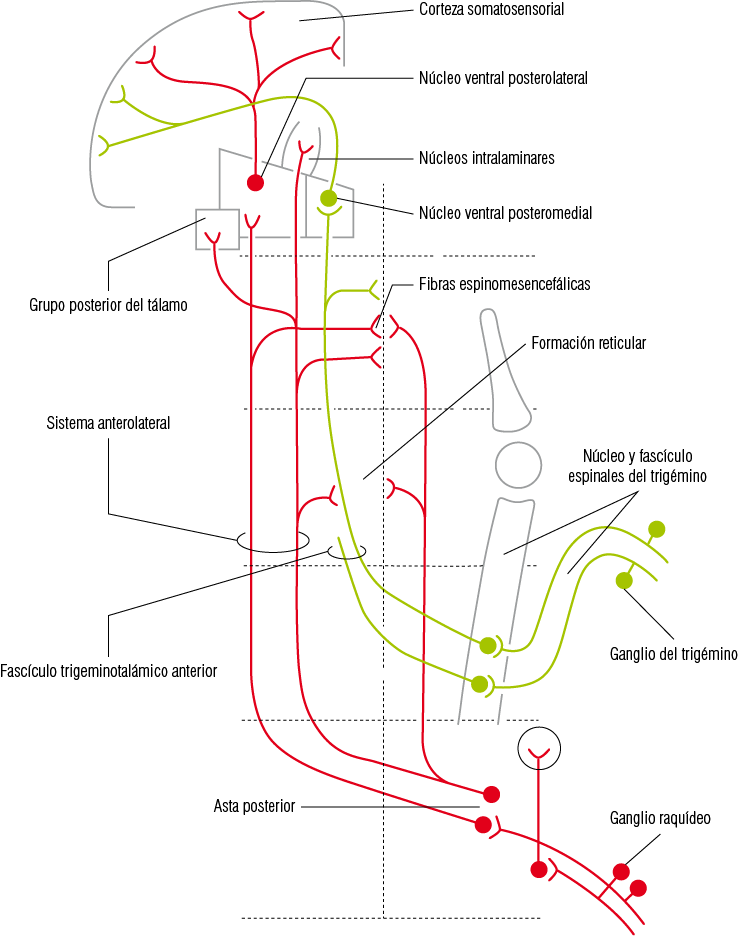
2. Vía termalgesia. Conduce la sensibilidad de temperatura y dolor del territorio oral que es recogida por los nociceptores contenidos en la neurona de primer orden, las que proyectarán la información a través de fibras axónicas A-delta y C al subnúcleo interpolar y caudal del núcleo espinal del V par donde harán sinapsis con la neurona de segundo orden. Esta vía es cruzada y los axones de la neurona de segundo orden forman el haz trigémino talámico anterior que ascienden contralateralmente para llegar al núcleo ventral posteromedial del tálamo y a los núcleos intralaminares del tálamo. Las proyecciones que llegan al núcleo ventral posteromedial del tálamo conducen las sensaciones de discriminación del dolor y la temperatura. En cambio, las proyecciones hacia los núcleos intralaminares participan en el aspecto afectivo asociado al dolor
(Figura 13).
3. Vía propioceptiva inconsciente. Está conformada por fibras axónicas A-alfa provenientes de los propioceptores musculares, articulares y periodontales encargados de la propiocepción inconsciente y de la mecanopercepción periodontal. Esta vía representa la base de los arcos reflejos bineuronales y monosinápticos. El soma de la neurona pseudounipolar de primer orden de esta vía se ubica en el núcleo mesencefálico, al igual que las neuronas ganglionares. Sus aferentes periféricas ingresan mayoritariamente al sistema nervioso central por la raíz motora hasta llegar al núcleo mesencefálico. Sus prolongaciones centrales se dirigen a los núcleos motores de los músculos efectores asociados a los diversos arcos reflejos (Figura 14).
A manera de integración del conocimiento, la sensibilidad que conduce el nervio trigémino se puede agrupar en sistema trigeminal rostral y caudal. El cuadro resumen de las vías trigeminales se describe en la Figura 15.
Figura 13
Vía termalgésica del trigémino
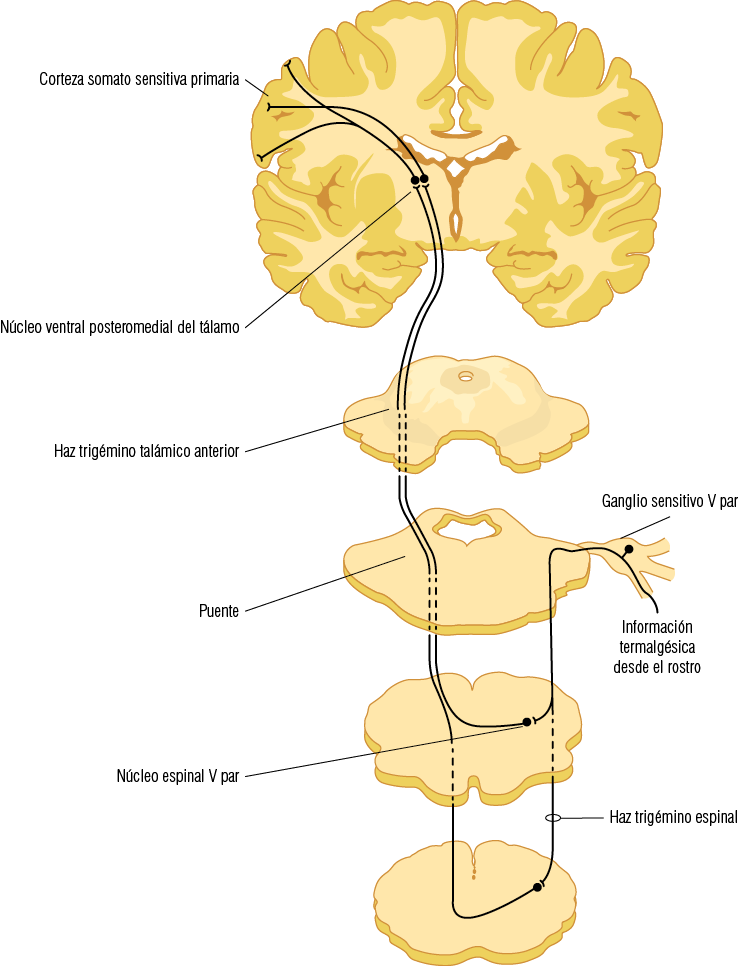
Figura 14
Vía propioceptiva del trigémino
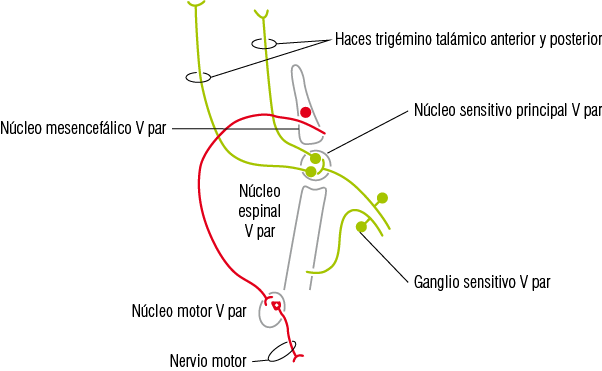
Nótese que esta vía ingresa a través del núcleo motor del trigémino sin hacer conexión en él. La línea color rojo la representa.
2.4.3.1. Sistema trigeminal rostral
Las neuronas de segundo orden se encuentran en el núcleo sensitivo principal y el subnúcleo oral (unidad rostral) del núcleo espinal del trigémino. Está encargado de la transmisión de las vías táctil-presión epicrítico (incluida la información mecanosensitiva periodontal) y propioceptiva cortical del territorio craneofacial. Está conformada por fibras nerviosas mielínicas de gran diámetro. Es equivalente al sistema de los cordones posteriores/lemnisco medial, que es importante para la transmisión de la información mecanosensitiva (tacto-presión fina) y propioceptiva procedente de las extremidades y el tronco (Figura 16).
2.4.3.2. Sistema trigeminal caudal
Las neuronas de segundo orden se encuentran en el subnúcleo interpolar y caudal (unidad caudal) del núcleo espinal del trigémino. Constituye la base estructural de la transmisión de las vías termalgésica y tacto-presión protopático del territorio craneofacial. Contiene fibras mielínicas de pequeño diámetro y fibras amielínicas. Este sistema es análogo al sistema antero lateral de la médula espinal (Figura 17).
Figura 15
Cuadro de las vías sensitivas del trigémino de acuerdo a la fibra nerviosa responsable de la conducción
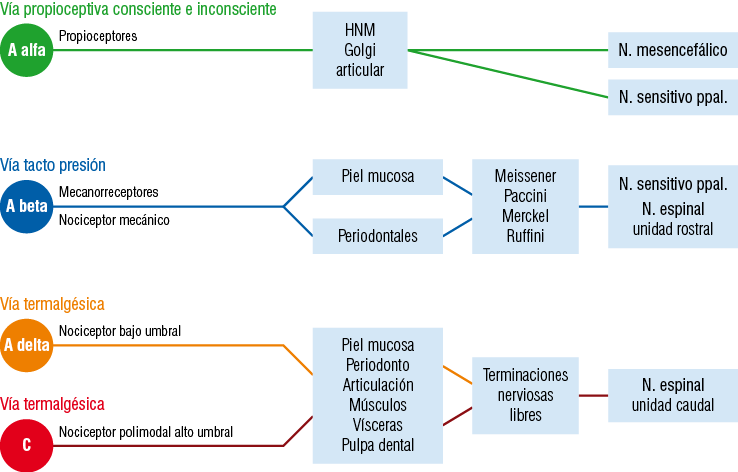
Nótese que la información viaja por vías separadas dependiendo del tipo de estímulo recibido.
Figura 16
Sistema trigeminal rostral
La línea color verde la representa.
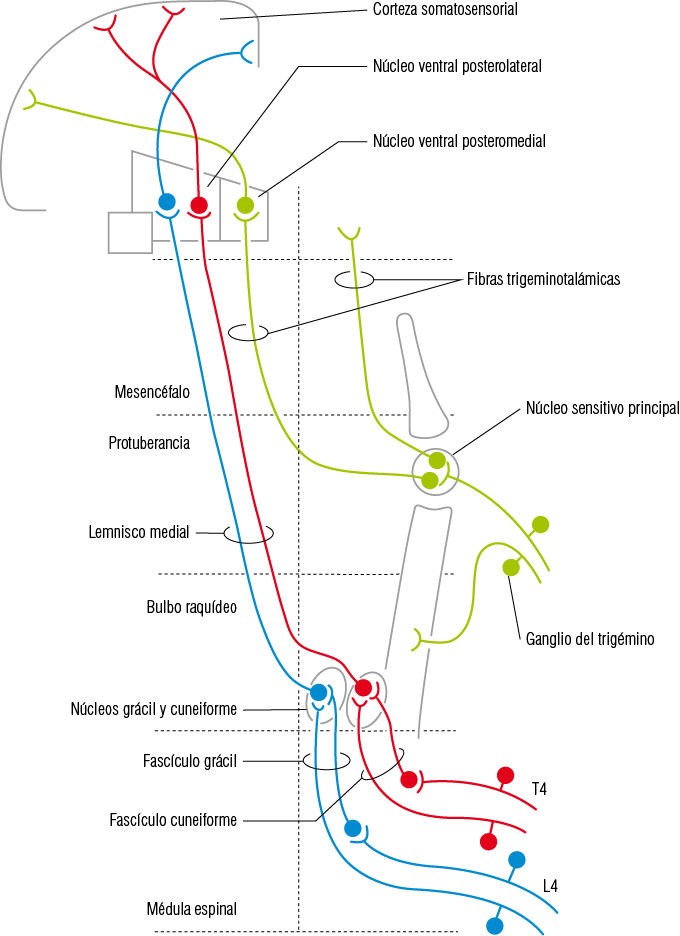
Figura 17
Sistema trigeminal caudal
La línea en color verde la representa.
2.5. SENSIBILIDAD DENTINO PULPAR
2.5.1. Particularidades del órgano pulpar
El diente es un órgano único dentro de nuestra anatomía, que se caracteriza por poseer un núcleo pulpar de tejido blando, vascularizado e inervado, rodeado de tejido duro mineralizado. Muchas diferencias son posibles de observar entre el dolor evocado en los dientes y en otros tejidos en el cuerpo.
Las piezas dentarias tienen muchas particularidades en la forma como ellas perciben los estímulos, lo cual está asociado a su constitución anatómica. La pulpa dental, rodeada de tejido calcificado, tiene muy poco espacio para expandirse en un estado inflamatorio y por ende el dolor es exagerado, incluso en casos de inflamación leve. Frente a temperatura extrema, generalmente nociva para otros tejidos, si es aplicada en dientes sanos no provocará dolor debido a la capacidad de aislamiento térmico del esmalte. Por el contrario, en ausencia del esmalte y exposición de dentina, el diente reacciona con dolor repentino y punzante frente a leves estímulos térmicos que en otra zona del cuerpo pasarían desapercibidos. Es muy difícil distinguir estímulos nocivos térmicos en los dientes, en contraposición a las sensaciones de frío o calor percibidas por nuestra piel. Por ejemplo, el estímulo débil de una corriente de aire sobre la dentina expuesta provoca la mayoría de las veces un dolor intenso, diferente a la piel en donde en condiciones normales, el mismo estímulo de aire evoca simplemente la sensación de un toque ligero. Por lo tanto, se acepta que cualquier estimulación aplicada en un diente, tanto nociva como inocua, resultará la gran mayoría de las veces en una sensación dolorosa. Esta característica sensitiva particular que poseen los dientes puede dificultar al clínico en el momento de discriminar si el dolor que relata el paciente es a causa de un estímulo inocuo u originado por una noxa. Dadas las observaciones antes descritas, es bastante razonable sugerir que los dientes poseen un mecanismo nociceptivo particular por el cual detectan los estímulos. Se describe que las neuronas nociceptivas dentales en sí mismas poseen propiedades adicionales que son diferentes de los otros tejidos en el cuerpo.
La sensibilidad dentaria está asociada al complejo dentinopulpar y diversas teorías han tratado de explicar este fenómeno. Si bien aún no es clara la localización del receptor de dolor dentinopulpar, debido a la dificultad experimental de realizar cortes histológicos que preserven la pulpa dentaria, sí está bastante conocida las vías nerviosas hacia los núcleos sensitivos trigeminales. Antes de describir las posibles formas de transmisión del dolor dentinario y pulpar, es necesario recordar la anatomía dentaria general, el rol del odontoblasto, sus características histológicas y funcionales para comprender las teorías que tratan de explicar el origen, la transducción y la percepción del dolor.
2.5.2. Odontoblasto e inervación pulpar
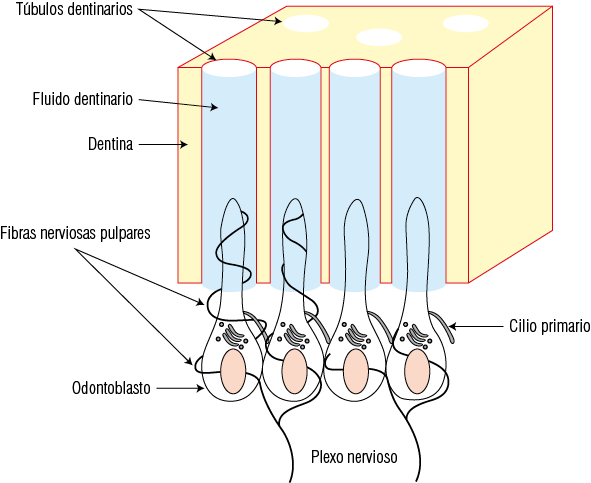
Los odontoblastos están ubicados en la interfaz del complejo dentinopulpar, donde se organizan como una empalizada de células, proporcionando una barrera natural entre los tejidos mineralizados (esmalte y dentina) y el tejido vivo del diente (la pulpa). Las células están conectadas en su polo apical por numerosos complejos de unión (uniones estrechas y desmosomas) que forman una barrera selectiva que puede controlar la relación entre dentina y pulpa y viceversa en condiciones fisiológicas y patológicas. El proceso o prolongación odontoblástico se encuentra dentro de los túbulos dentinarios, y está rodeado por el fluido dentinario que se desplaza hacia el límite amelodentinario o hacia el cuerpo odontoblástico, de acuerdo con una variedad de estímulos térmicos o químicos. El cuerpo celular odontoblástico está en estrecho contacto con las terminaciones del plexo nervioso pulpar. De hecho, los dientes están densamente inervados por neuronas sensoriales primarias ubicadas en el ganglio trigeminal. El suministro de nervios del complejo dentinopulpar está compuesto principalmente de fibras A-delta y fibras C. Las fibras A-delta se localizan principalmente en el límite pulpodentinario, concentrándose en la porción coronal, especialmente en los cuernos pulpares. Los axones A-delta alcanzan la capa de odontoblastos como terminaciones nerviosas libres amielínicas. Alrededor del 30-70% de los procesos odontoblásticos están en contacto con las terminaciones nerviosas. Sin embargo, las fibras no penetran más allá del primer tercio dentinario interno, por lo que se cree que los dos tercios restantes del proceso odontoblástico, por sí solos pueden actuar como una célula sensitiva, o en su defecto, generar mediadores químicos que guíen el crecimiento y acción de las terminaciones nerviosas libres (Figura 18).
Figura 18
Microscopía de tejido dentario
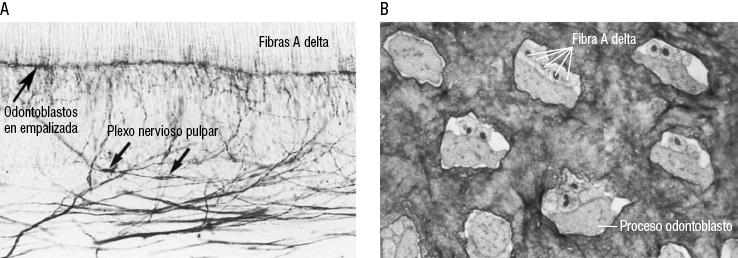
A. Inervación del plexo nevioso pulpar localizado subyacente a la capa odontoblastica. B. Corte de dentina en donde se observan canalículos dentinarios que contienen la prolongación del odontoblasto junto a fibras nerviosas en íntima relación.
La pulpa también es un tejido altamente vascular, con un plexo capilar denso debajo de la capa de odontoblastos que asegura el transporte de nutrientes, oxígeno y células inflamatorias a los odontoblastos. Los odontoblastos se encuentran en un lugar estratégico en el complejo dentinopulpar y mantienen una estrecha relación con las terminaciones nerviosas y vasos sanguíneos de la pulpa, lo que los deja en posición para captar estímulos externos, censar la presencia de microorganismos patógenos, y servir como iniciadores y mediadores de los procesos sensitivos e inflamatorios dentarios.
2.5.3. Teorías de la sensibilidad dentaria
Las teorías que explican el dolor dentario se dividen clásicamente en tres:
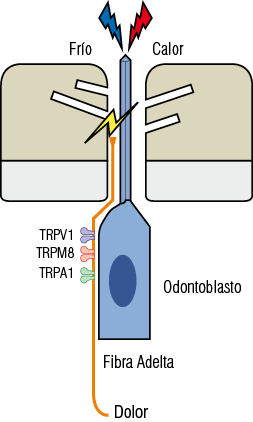
1. Teoría inervación dentinaria. Terminaciones nerviosas libres se encuentran presentes dentro de los canalículos dentinarios. Anteriormente se pensaba que terminaciones nerviosas libres solo llegaban a la predentina, sin embargo, se ha demostrado que la dentina esta inervada en su primer tercio por fibras A delta que cumplen una función mecanoreceptora. Un hecho curioso que avala lo anterior se observa cuando capsaicina, un potente agente químico doloroso que estimula las fibras C, es aplicada sobre la dentina no generando dolor debido a que la dentina solo esta inervada por fibras Adelta (Figura 19).
Figura 19
Esquema de inervación dentinaria
2. Teoría del odontoblasto como transductor mecanosensorial. Sugiere que el odontoblasto actuaría como una célula receptora por despolarización de su membrana y conexión sináptica con una fibra nerviosa a través de un cilio primario ubicado en la membrana plasmática del odontoblasto. En la actualidad se ha demostrado la comunicación interodontoblástica mediada por ATP, molécula que tiene un rol demostrado en la transmisión nerviosa e inmune. Mecanorreceptores y termorreceptores iónicos como TRPV1, TRPV2, TRPA1, TREK-1 y canales de K+ activados por Ca2+ también han sido descubiertos en la membrana odontoblástica, los que captarían estímulos externos para ser transducidos vía ATP y glutamato, otro neurotransmisor que participa en la transmisión del dolor. Es más, estudios han identificado receptores y mediadores además de la presencia de sensores odontoblásticos para variaciones de pH que probablemente cumplan un rol en la detección de cambios fisiológicos o patológicos inducidos por la presencia de invasores bacterianos (Figura 20).
Figura 20
Diagrama que demuestra la inervación asociada al cilio del odontoblasto
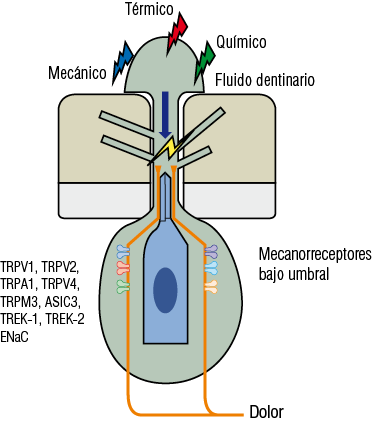
3. Teoría hidrodinámica. Señala que estímulos químicos, térmicos o mecánicos provocan un movimiento del fluido de la linfa contenida en los túbulos dentinarios que estimularían las fibras nerviosas pulpares nociceptivas en la interfase pulpa-dentina por un mecanismo de torsión mecánica de la terminal nerviosa A delta. Esto genera un dolor agudo, intenso y de corta duración que desaparece cuando se retira el estímulo (por ejemplo, al sondaje de la dentina). Se sabe que a mayor diámetro de los túbulos dentinarios mayor es el flujo de la linfa y mayor generación de dolor. Esto explica por qué las lesiones dentinarias en la zona cervical de la corona clínica producen mayor dolor. Como se ha descrito, confirmada está la presencia de receptores y citoquinas que participan en la transducción de señales mecánicas, térmicas y químicas. Sin embargo, aún no se ha identificado el mecanismo molecular por el cual el movimiento de la linfa es transformado en potencial de acción. Confirmando esta teoría, si los túbulos se encuentran obliterados no se producirá generación de dolor. Esta es la base de la terapia de tratamiento de la hipersensibilidad dentinaria mediante sales precipitantes contenidas en dentífrico (Figura 21).
Figura 21
Esquema basado en la teoría hidrodinámica del dolor dentinario
2.5.4. Receptores y respuesta pulpar
Referente a los receptores que participan en la sensibilidad dentinaria, ellos corresponden a nociceptores térmicos y polimodales asociados a fibras A-delta. Estos solo evocan dolor al ser estimulados tanto química como mecánica y térmicamente. La sensación dolorosa es conocida como dolor dentinario. Este dolor dentinario consiste en un dolor agudo, localizado, de corta duración. Esta respuesta sigue frente a cualquier estímulo que altera la hidrodinámica, osmótica o equilibrio iónico de los túbulos dentinarios. Cabe señalar que este dolor no está asociado a un proceso inflamatorio/infeccioso sino más bien a una estimulación térmica, mecánica o química sobre la pulpa, la cual es incapaz de evocar tacto o presión porque la pulpa carece de mecanorreceptores.
La reacción de la pulpa dentaria varía de acuerdo con el estímulo. Estímulos mecánicos, químicos, osmóticos y iónicos son los que generan un movimiento de la linfa de los túbulos dentinarios, produciendo un cambio en la presión osmótica de la linfa que induce excitación inmediata y transitoria de las fibras A-delta. La exposición a azúcares, sales, ácidos, deshidratación por corriente de aire intensa, remoción del barro dentinario o estímulo mecánico como sondaje o fresado dentinario, son los estímulos que evocan dolor de corta duración en una pulpa dentaria sana. Estímulos eléctricos causan desbalance iónico a través de la membrana neural, evocando un dolor transitorio por estimulación de las fibras A delta. Este es el estímulo más adecuado para medir la respuesta de la pulpa y se utiliza en las pruebas de diagnóstico de sensibilidad pulpar. Estímulos térmicos fríos en la corona clínica evocan una rápida respuesta a las fibras A-delta, seguida de un cese inmediato del dolor. El estímulo térmico caliente tiene un efecto bifásico: inicialmente el calor evoca una respuesta al dolor rápida y corta debido al rápido movimiento de fluido causado por un cambio súbito en la temperatura y mediado por las fibras A delta. A medida que la aplicación de calor continúa, existe un período en que cesa la percepción algésica aguda, y aparece un dolor más intenso, de mayor frecuencia y duración. Esto se debe presumiblemente a la dilatación de los vasos sanguíneos causada por el calor acompañado de un aumento de la presión intrapulpar. Esta reacción involucra a las fibras C. A diferencia del dolor dentinario mediado por fibras A-delta, el dolor pulpar es transmitido por fibras C y corresponde a un dolor sordo, profundo, mal localizado y de larga duración, asociado generalmente a procesos reversibles o irreversibles de inflamación/infección pulpar acompañado de mediadores químicos de la inflamación (Tabla 2).
Tabla 2
Características del dolor dentario según fibra nerviosa
|
Fibra A delta |
Fibra C |
|
|
Localización |
Dentina |
Pulpa |
|
Función |
Dolor sensitivo táctil |
Dolor noxa |
|
Reflejo evocado |
Apertura bucal |
Inmovilización |
|
Cualidad del dolor |
Agudo, localizado |
Sordo, mal localizado |
|
Respuesta al calor |
Transitoria |
Persistente |
|
Expresión de péptidos |
CGRP |
CGRP - Sustancia P |
|
Receptores |
P2X3 - TRPV2 |
TRPV1 - TRPV2 |
Figura 25
Propiedades de los diferentes tipos de fibras musculares estriadas

LECTURAS SUGERIDAS
Bleicher F. Odontoblast physiology. Experimental Cell Research. 2014.
Cho YS, Ryu CH, Won JH, Vang H, Oh SB, Ro JY, et al. Rat odontoblasts may use glutamate to signal dentin injury. Neuroscience. 2016; 335:54-63.
Chung G, Jung SJ, Oh SB. Cellular and molecular mechanisms of dental nociception. Journal of Dental Research. 2013.
Guest S, Grabenhorst F. Human cortical representation of oral temperature. Physiology & Behavior. 2007; 92:975-984.
Lee BM, Jo H, Park G, Kim YH, Park CK, Jung SJ, et al. Extracellular ATP induces calcium signaling in odontoblasts. J Dent Res. 2016; 9:200-207.
Liu X, Wang C, Fujita T, et al. External dentin stimulation induces ATP release in human teeth. J Dent Res. 2015.
Maeda K, Ochi K, et al. The ruffini ending as the primary mechanoreceptor in the periodontal ligament: its morphology, cytochemical features, regeneration, and development. CROBM. 1999; 10:307.
Manns A, Silva S, Rodriguez A. Mecanismos neuromuscular. Organización funcional del sistema trigeminal. En: AM Sistema estomatognatico. Fisiología y sus correlaciones clínicas-biológicas. 1ra ed. Madrid: Ripano. 2011; 239-265 (ISBN 9788493828745).
Maorin J, Couble M, Thivichon B, Magliore H. L’Odontoblaste. Un acteur incontournable de la perception de la douleur dentinaire. Médicine/Science. 2013; 29:293-300.
Miller A. Oral and pharyngeal reflexes in the mammalian nervous system: their diverse range in complexity and the pivotal role of the tongue. CROBM. 2002; 13:409.
Sessle B. Mechanisms of oral somatosensory and motor functions and their clinical correlates. Journal of Oral Rehabilitation. 2006; 33:243-261.
Sessle B. Acute and chronic craniofacial pain: brainstem mechanisms of nociceptive transmission and neuroplasticity, and their clinical correlates. CROBM. 2000; 11:57.
Tenenbaum H, Mock D. Sensory and affective components of orofacial pain: is it all in your brain? CROBM. 2001; 12:455.
Trulsson M. Sensory-motor function of human periodontal mechanoreceptors. Journal of Oral Rehabilitation. 2006; 33:262-273.
Trulsson M, Johansson R. Orofacial mechanoreceptors in humans: encoding characteristics and responses during natural orofacial behaviors. Behavioural Brain Research. 2002; 135:27-33.